乙醇在茶叶多糖提取中的应用研究
2016-03-29杨军国王丽丽陈键宋振硕陈林
杨军国,王丽丽,陈键,宋振硕,陈林
乙醇在茶叶多糖提取中的应用研究
杨军国,王丽丽,陈键,宋振硕,陈林*
(福建省农业科学院茶叶研究所,福建福安355015)
乙醇预处理茶叶后,再通过水提可实现高茶多糖提取物的制备。以安溪铁观音为原料,以茶多糖、茶多酚、可溶性蛋白含量和浸出物得率为评价指标,考察乙醇预提取茶叶中乙醇浓度、料液比、温度、提取时间等因素的影响。单因素试验的基础上,正交试验分析发现,温度为醇提茶叶的最显著因素,乙醇浓度次之,而料液比和提取时间影响最小。乙醇预处理茶叶最优工艺参数组合为A1B2C2D1,即乙醇浓度65%、料液比1:25、温度55℃、提取时间20 min,该工艺实施后可再通过水提制得更高含量的茶多糖,为其进一步应用开展及工业化制备提供重要的理论依据。
乙醇;茶多糖;提取
茶多糖(Tea Polysaccharides,TPs)系茶叶中具有生物活性的复合多糖的简称,因其在降血糖方面的突出功效日益受到关注[1-2],众多学者进一步通过动物实验给出了明确的证实[3-5]。茶已逐渐发展为世人的普及饮料,其降血糖功效必将受到更广泛的关注。关于多糖提取分离的方法,主要有酸碱法、水提醇沉法,以及近年新引入的酶解、超声波、超临界萃取、膜分离、色谱分离等提取分离技术[6-8]。然而,茶多糖是一类杂多糖复合物,构象繁杂,现阶段加工制备仅限于实验室阶段,常采用纤维素阴离子交换柱层析法和凝胶柱层析法对其进行分级和纯化,限于成本和得率,尚难用于工业化生产[9-10]。因此,研究开发高茶叶多糖产品的工业化提取制备,对其进一步应用开展尤为重要。
乙醇可用于包括茶叶在内多种植物多糖的分级纯化,且安全环保,发展前景广阔[11-13]。亦可用于蛋白质、鞣质、大分子色素等其他物质液相条件下的沉淀析出,而对茶叶中多酚、氨基酸等小分子物质则有助于水相的浸出。据萧力争等[14]研究报道,采用50%乙醇浸提后,茶叶各品质成分的浸出率显著高于常规水提,总浸出物、氨基酸、茶多酚及碳水化合物分别高出1.39、1.09、1.44和1.23倍。前期本课题组开展了乙醇沉淀分级茶多糖特性研究,结果表明70%浓度乙醇沉淀分级效果最优,且抗氧化活性强[15-16]。进一步研究发现,采用不同提取方式制得茶叶提取物中多糖含量不尽相同[17]。相较于先水提+后醇沉,先醇提+后水提的提取方式可实现茶叶提取物中多糖含量极显著提高,达15%以上。针对该粗茶多糖,正交试验分析发现,醇预提后再水提阶段料液比可显著影响茶多糖含量,乙醇浓度则显著影响粗茶多糖产品得率。由此,乙醇预处理茶叶阶段影响因素如乙醇浓度、时间、温度、料液比等等尚需进一步考察研究,以达到更高效的分离去除茶多酚、可溶性蛋白、茶色素等主要物质,富集纯化茶叶多糖的目的。本文以安溪铁观音为原料,考察乙醇浓度、提取时间、提取温度、料液比等因素对乙醇预处理茶叶的影响,从而实现茶叶浸提液中低多糖析出,而茶多酚、蛋白质等主要物质高析出,这将有助于通过水提制得更高多糖含量的茶制品,以期为实现工业化制备高多糖茶叶提取物提供重要的理论依据。
1 材料与方法
1.1 材料与设备
安溪铁观音购自闽南安溪茶区;福林酚购自北京索莱宝科技有限公司;蒽酮购自上海国药集团化学试剂有限公司;其余均为色谱纯或分析纯试剂。T6新世纪紫外可见分光光度计(北京普析); BioSpec-nano超微量分光光度计(岛津公司); DK-8D型电热恒温水浴槽(上海一恒);DHC-9246A电热恒温鼓风干燥箱(上海精宏)。
1.2 试验方法
1.2.1 茶叶乙醇浸提液的制备及检测以茶多糖、茶多酚、可溶性蛋白和浸出物含量为指标,以乙醇浓度(0、15%、30%、45%、60%、75%、90%)、浸提温度(25℃、35℃、45℃、55℃、65℃、75℃、85℃)、料液比(1∶10、1∶15、1∶20、1∶25、1∶30)、浸提时间(20 min、30 min、40 min、50 min、60 min)为研究因素,进行单因素试验和多因素正交试验。具体方法如下:称取安溪铁观音茶叶3.00 g于250 mL锥形瓶中,常温时(25℃),按照料液比1∶15和玻璃棒搅拌浸提30 min以不同浓度乙醇浸提茶叶,同样参数提取2次,收集浸提液定容至500 mL,检测浸提液中茶多糖、茶多酚、可溶性蛋白和浸出物含量,综合评价选取最优乙醇浓度进行其他因素的考察;在此基础上,设计正交实验以选取最优的浸提温度、料液比和浸提时间。
1.2.2 乙醇预处理参数优化单因素试验的基础上,根据L9(3)4正交试验设计方案,研究乙醇浓度(A)、料液比(B)、提取温度(C)、提取时间(D)等参数对茶叶浸提液中茶多糖、茶多酚、可溶性蛋白和浸出物含量的影响,试验因素和水平设计见表1。
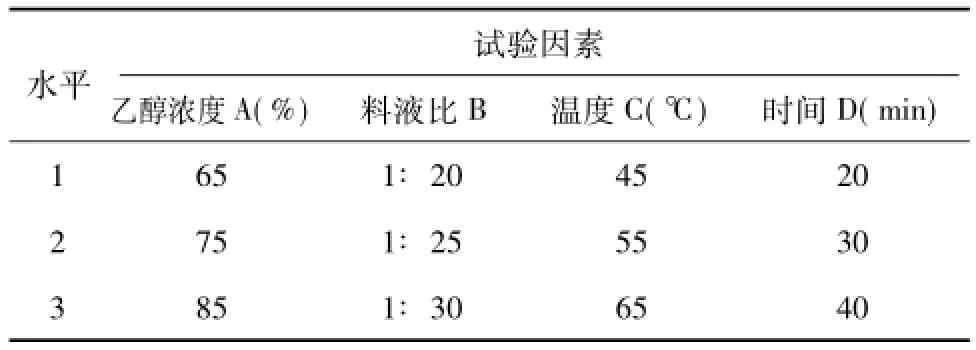
表1 正交试验L9(34)因素和水平Table 1Factors and levels of L9(34)orthogonal experiment
1.2.3 茶多糖含量的测定采用蒽酮-硫酸法,以无水葡萄糖作为标准对照。吸取蒽酮试剂8.0 mL于25 mL容量瓶中,分别滴入1.0 mL不同浓度标准葡萄糖溶液(0、25、50、100、150、200 μg ·mL-1),边滴边摇匀,沸水加热3 min,快速冷却,于600 nm处比色测定,以吸光度值为纵坐标,以葡萄糖含量(μg·mL-1)为横坐标,绘制标准曲线并计算线性回归方程。吸取蒽酮试剂8.0 mL于25 mL容量瓶中,分别滴加浸提液样品1.0 mL,摇匀后沸水加热3 min,快速冷却,600 nm处比色测定,并根据葡萄糖线性标准回归方程计算样品中多糖含量。
1.2.4 茶多酚含量的检测茶多酚含量检测采用GB/T 8313-2008福林酚法。
1.2.5 可溶性蛋白含量的检测BioSpec-nano超微量分光光度计以Cy3标记蛋白,可在波长280 nm时测量蛋白质的浓度。准确移取浸提液样品溶液4 μL于超微量分光光度计目标位置,以光程0.7 mm、波长280 nm处检测可溶性蛋白质含量。1.2.6浸出物含量的测定参照《GB/T 8305-2013茶水浸出物测定》,与1.2.1茶叶浸提液的制备同步进行。
1.3 数据统计与分析
数据分析采用Origin 7.5和Spss 19.0软件,数值表示为平均值±S.E.。
2 结果与分析
2.1 不同乙醇浓度预处理对乙醇浸提液中主要内含成份的影响
乙醇预处理茶叶以后,进一步通过水相浸提可实现茶叶多糖的富集。由此,如何达到乙醇预处理茶叶的最优化,即乙醇浸提液中更高含量的茶多酚、可溶性蛋白、茶色素等主要物质而低含量的茶叶多糖,从而提高后续在水相浸提中,水相浸提物中茶叶多糖的富集程度。如图1所示,为不同乙醇浓度常温提取茶叶时浸提液中的茶多糖、茶多酚、可溶性蛋白及浸出物的含量变化。结果表明,茶多糖含量变化与乙醇浓度呈负相关,与对照相比,至75%浓度乙醇时呈显著降低;而茶多酚、可溶性蛋白等含量变化则呈先升高后降低的趋势,至60%浓度乙醇时含量最高,浸出物含量变化表达了同样的趋势(图1B)。分析认为,水溶液介电常数较高时(乙醇浓度≤60%),益于茶多酚、可溶性蛋白、茶叶浸出物等物质的浸出,随着水溶液介电常数的降低(乙醇浓度≥75%)开始呈反作用效果,而茶叶中水溶性多糖与水溶液介电常数呈正相关,含量逐步降低。综合来看,与低剂量乙醇相比,75%浓度乙醇提取茶叶时,浸提液中茶叶多糖含量显著降低,浸出物含量变化并未呈差异显著性,而90%浓度乙醇浸提茶叶时浸提液中所有物质均呈显著性降低,导致水相浸提茶叶多糖并未起到富集的效果。因此,选取75%浓度作为乙醇处理茶叶的最佳浓度,达到最佳的去除茶多酚和保留较多茶多糖的效果。

图1 不同乙醇浓度下茶叶浸提液中主要物质含量变化Fig.1Contents of major constituents in tea extracts with different ethanol concentrations for pretreatment
2.2 不同温度对醇提茶叶的影响
图2为不同提取温度下75%浓度乙醇茶叶浸提液中主要物质的含量变化,结果表明,茶多糖、茶多酚、可溶性蛋白及浸出物均呈温度依赖效应,随着温度的提高其含量逐渐增加(图2)。如图所示,按差异显著性分析可划分为低温区间25~ 55℃和高温区间65~85℃,温度区间内茶多糖、茶多酚及浸出物等含量变化未见差异显著性;相较于常温提取,至85℃时呈显著性提高。比较来看,可溶性蛋白的含量变化受温度影响较大,提取温度45℃时已达显著性提升。综合分析,选取55℃作为乙醇预处理脱杂的最优温度。
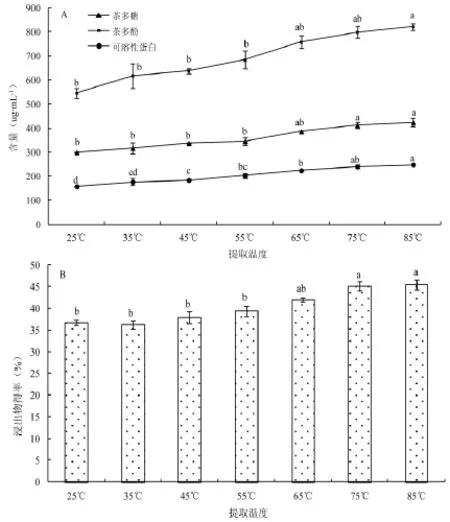
图2 不同温度下醇提茶叶中主要物质含量变化Fig.2Contents of major constituents in tea extracts with different pretreatment temperatures
2.3 不同料液比对醇提茶叶的影响
如图3所示,为不同料液比下75%浓度乙醇55℃时茶叶浸提液中的主要物质含量变化。结果表明,茶多糖与可溶性蛋白含量受料液比影响较小,未见差异显著性变化;茶多酚含量与料液比呈正相关,至1∶20时显著提高(图3A)。从浸出物得率来看,趋势与茶多酚变化相同,至1∶25时显著提高(图3B)。由此,选取料液比1∶25时作为最优处理,浸出物及茶多酚析出量高。
2.4 不同提取时间对醇提茶叶的影响
图4为不同提取时间下茶醇提液中主要物质含量变化,结果表明,茶多糖及茶多酚含量随着时间的延长逐渐增加,40 min时呈显著性提升,多糖析出明显增大;相较来看,可溶性蛋白含量变化未见差异显著性(图4A)。同时,茶叶浸出物得率亦呈递增趋势,50 min时明显增大(图4B)。鉴于本文试验要求醇提液中低含量的多糖析出,而茶多酚、可溶性蛋白、浸出物等高含量析出,综合分析选取30 min进行正交试验的处理参数优化。
2.5 醇提茶叶参数优化
单因素试验基础上,确定多因素协同作用对醇提处理茶叶的影响,从而进一步获得高多糖含量的茶制品。选择L9(34)正交表,考察乙醇浓度、温度、料液比、提取时间等因素对醇提处理茶叶的影响,以茶多糖、茶多酚、可溶性蛋白含量及浸出物得率作为评价指标,要求醇处理茶叶浸提液中茶多糖含量低而茶多酚、可溶性蛋白及浸出物含量高,试验结果见表2。

图3 不同料液比下醇提茶叶中主要物质含量变化Fig.3Contents of major constituents in tea extracts with different ethanol/tea ratio in pretreatment
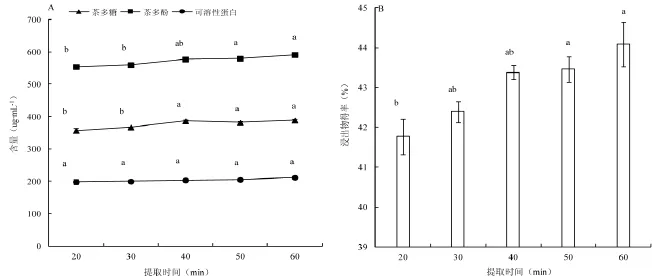
图4 不同提取时间下醇提茶叶中主要物质含量变化Fig.4Contents of major constituents in tea extracts with different pretreatment durations
由表3直观分析可知,不同的评价指标各因素主次顺序基本相同,即茶多糖C>A>B>D、茶多酚C>A>D>B、可溶性蛋白C>A>B>D和浸出物得率C>A>D>B,可见影响醇处理茶叶浸提液中物质含量的主要因素为温度和乙醇浓度。本文以醇处理茶叶浸提液中茶多糖含量低为优选择,由此茶多糖因素优组合为A3B3C1D1,与茶多酚、可溶性蛋白及浸出物得率的优组合A1B1C3D3有所不同。为此,进一步通过方差分析确定显著因素与非显著因素,综合确立醇处理茶叶的最佳工艺参数组合。由表4可知,温度是醇提液中茶多糖、茶多酚、可溶性蛋白及浸出物等物质含量变化的首要影响因素,对可溶性蛋白及浸出物得率呈显著影响,乙醇浓度次之,仅对浸出物得率有显著性影响,料液比及提取时间影响较小,而各因素对茶多糖和茶多酚的含量变化未见显著性影响。结合表3的直观分析结果,温度是首要的考虑因素,茶多糖优水平C1,其他物质优水平为C3,综合确立为优水平C2。乙醇浓度对茶多糖含量变化影响小却显著影响浸出物得率,由此确立优水平A1。而料液比和提取时间对醇提液中物质的含量变化影响最小,可从成本方面予以考虑,确立为优水平C2D1。由此,获得醇处理茶叶的最优水平组合为A1B2C2D1,即乙醇浓度65%、料液比1∶25、温度55℃、提取时间20 min,从而可致乙醇茶叶浸提液中茶多糖析出量低,同时茶多酚、可溶性蛋白及浸出物析出量高,实现水相提取制备茶多糖时的高富集。
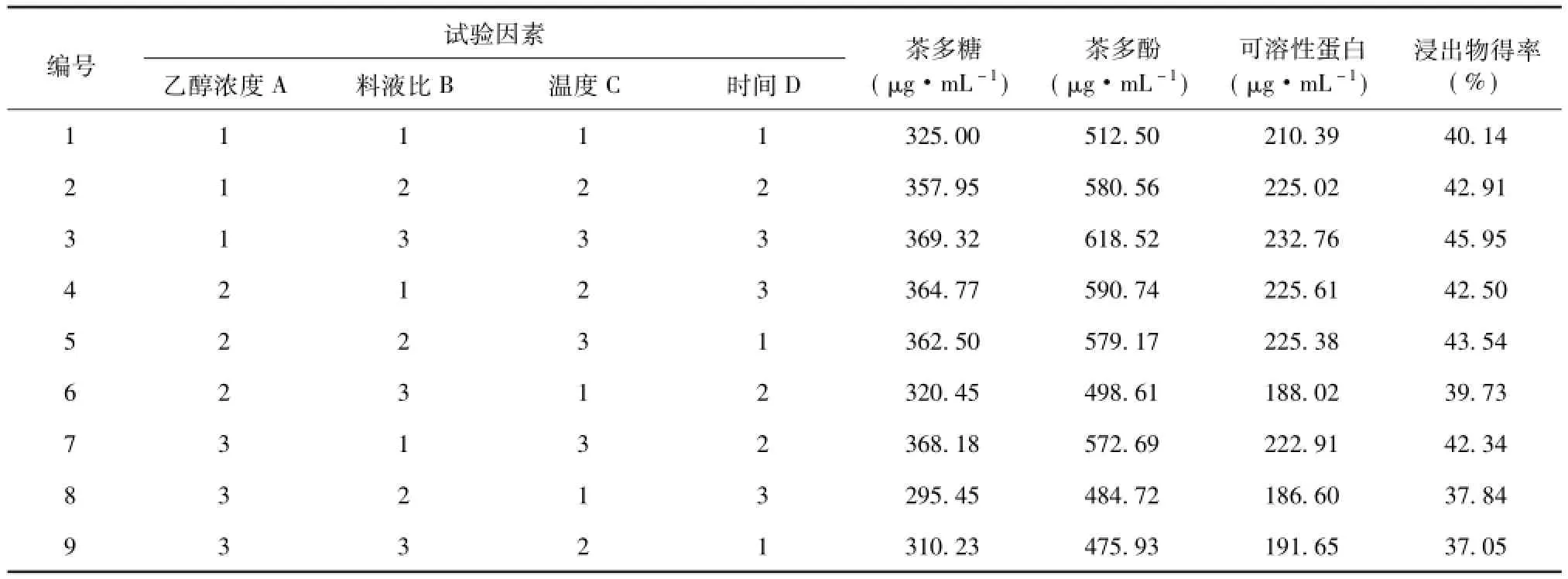
表2 正交试验L9(34)结果Table 2Results of L9(34)orthogonal experiment

表3 正交试验L9(34)极差直观分析表Table 3Visual analysis on range of L9(34)orthogonal experiment

表4 正交试验L9(34)方差分析Table 4Variance analysis on L9(34)orthogonal experiment
3 结论与讨论
乙醇可用于茶多糖的提取分离,多采用水提醇沉的方法[18-20]。本课题组前期研究发现,先采用一定浓度的乙醇提取茶叶后,茶叶再进一步经水相提取可达到富集茶多糖的目的,含量达15%以上,并且具有更高的抗氧化活性[17]。乌龙茶中含量高于绿茶和红茶,约占干重的2.63%[21],导致茶叶中茶多糖的单体提取分离制备运行成本过高,尚难实现工业化生产,其综合分离制备将具有广阔的发展前景。因此,乙醇预提取茶叶可作为在茶多糖提取分离中应用的新视点,同时兼具制备茶多酚和高茶多糖茶提取物,且易实现工业化生产。然而,以茶多糖为评价指标,有关乙醇预提取茶叶尚未见报道。本文正交试验结果表明,温度为醇提茶叶的最显著因素,乙醇浓度次之,而料液比和提取时间影响最小,乙醇预处理最优工艺参数组合为A1B2C2D1,即乙醇浓度65%、料液比1∶25、温度55℃、提取时间20min。该工艺条件实施下,乙醇处理茶叶浸提液中低析出茶多糖而茶多酚、可溶性蛋白及浸出物高析出,从而进一步水相提取茶叶后可获得更高含量的粗茶多糖,这为其进一步应用及工业化生产提供重要的理论依据。
[1]CAO H.Polysaccharides from Chinese tea:recent advance on bioactivity and function[J].International Journal of Biological Macromolecules,2013,62(11):76-79.
[2]杨军国,陈泉宾,王秀萍,等.茶多糖的组成结构及其降血糖作用研究进展[J].福建农业学报,2014,29(12):1260-1264.
[3]Zhou X,Wang D,Sun P,et al.Effects of soluble tea polysaccharides on hyperglycemia in alloxan-diabetic mice[J]. Journal of Agricultural and Food Chemistry,2007,55(14):5523-5528.
[4]Deng Y T,Lin-Shiau S Y,Shyur L F,et al.Pu-erh tea polysaccharides decreasebloodsugarbyinhibitionofαglucosidase activity in vitro and in mice[J].Food&Function,2015,6(5):1539-1546.
[5]Li S,Chen H,Wang J,et al.Involvement of the PI3K/Akt signal pathway in the hypoglycemic effects of tea polysaccharides on diabeticmice[J].InternationalJournalofBiological Macromolecules,2015,(81):967-974.
[6]王忠雷,杨丽燕,曾详伟,等.新技术在中药多糖提取工艺中的单独及协同应用[J].世界科学技术:中医药现代化,2013,15(6):1441-1446.
[7]任小盈,李静,马存强,等.茶多糖的提取与分离纯化技术研究新进展[J].安徽农业科学,2014,42(23):7993-7995,7999.
[8]石奇.植物多糖的新型提取分离技术应用进展[J].西安文理学院学报(自然科学版),2015,18(3):50-54.
[9]倪德江,陈玉琼,谢笔钧,等.乌龙茶多糖OTPS 2-1的光谱特性、形貌特征及热特性研究[J].高等学校化学学报,2004,25(12):2263-2268.
[10]Cai W R,Xie L L,Chen Y,et al.Purification,characterization and anticoagulant activity of the polysaccharides from green tea[J].Carbohydrate Polymers,2013,92(2):1086-1090.
[11]江新凤,高其璋,杨普香,等.乙醇沉淀法提取茶花多糖的研究[J].蚕桑茶叶通讯,2013,(5):31-33.
[12]张宁,武永福.黄花菜粗多糖梯度乙醇提取工艺及其抗氧化活性研究[J].中国食物与营养,2014,20(11):60-62.
[13]李卷梅,聂少平,李景恩,等.香薷多糖的乙醇分级纯化及其性质[J].食品科学,2010,31(19):182-185.
[14]萧力争,胡祥文,蔡金娥,等.绿茶乙醇浸提技术研究[J].天然产物研究与开发,2006,18(4):634-636.
[15]杨军国,陈键,王丽丽,等.乙醇法沉淀茶多糖的抗氧化活性评价[J].福建农业学报,2016,31(2):199-204.
[16]杨军国,陈键,王丽丽,等.醇沉分级粗茶多糖的抗氧化活性比较及变化机制[J].食品工业科技,2016,37(17):96-100,105.
[17]杨军国,宋振硕,王丽丽,等.高活性茶叶粗多糖提取工艺研究[J].食品研究与开发,接收.
[18]许旋骆,晓枫,陈兆星,等.正交试验优化绿茶中茶多糖醇析水提法的实验研究[J].中药材,2005,28(4):327-329.
[19]曹鹏飞.茶多糖提取工艺条件的正交试验研究[J].安徽农业科学,2007,35(14):4287-4322.
[20]陈萍,朱丽云,金晖,等.茶多糖的分离制备及其对ALX模型小鼠的降糖作用研究[J].食品科技,2013,(5):194-196.
[21]宛晓春.茶叶生物化学[M].北京:中国农业出版社,2003:52-57.
Ethanol Pretreatment in Polysaccharide Extraction of Tea
YANG Jun-guo,WANG Li-li,CHEN Jian,SONG Zhen-shuo,CHEN Lin*
(Tea Research Institute,Fujian Academy of Agricultural Sciences,Fu’an,Fujian 355015,China)
After the pre-extraction of tea with ethanol,tea polysaccharides were enriched in the further water extracts.In this paper,Anxi Tieguanyin was employed to assess the effects of ethanol concentration,ratio of solid to liquid,temperature and time on the pre-ethanol extracting tea via the contents of tea polysaccharide,tea polyphenols,soluble proteins and extracts yield.Based on the single factor test,orthogonal test suggested that temperature was the most significantly factor,ethanol concentration the second,and the least of solid-liquid ratio and time.The optimal pre-extracting conditions with ethanol for the high content of tea polysaccharides in the further water extracts were A1B2C2D1as follows:25 time liquid of solid,extracted at 55℃for 20min with 65%ethanol,and provided the theoretical base for its application and industrial production.
ethanol;tea polysaccharides;extraction
Q 538
A
2096-0220(2016)04-0192-08
2016-10-21初稿;2016-11-29修改稿
福建省自然科学基金项目(2015J05057);福建省农业科学院“青年科技英才百人计划”项目(YC2015-8);福建省属公益类科研院所基本科研专项(2015R1012-8);福建省农业科学院茶叶研究所重点项目(2014-cys-03)。
杨军国(1980-),男,博士,主要从事茶叶生物化学与综合利用。E-mail:95711139@qq.com
*通讯作者:陈林(1975-),男,博士,副研究员,主要从事茶叶加工、茶叶生物化学与综合利用。E-mail:82785676@qq.com
