磺胺二甲嘧啶在水溶液中的光化学降解
2016-03-24陈晓旸于海瀛浙江师范大学地理与环境科学学院浙江金华3004浙江省农业科学院环境资源与土壤肥料研究所杭州300
陈 伟,陈晓旸,于海瀛*(.浙江师范大学地理与环境科学学院,浙江金华3004;.浙江省农业科学院环境资源与土壤肥料研究所,杭州300)
磺胺二甲嘧啶在水溶液中的光化学降解
陈伟1,陈晓旸2,于海瀛1*
(1.浙江师范大学地理与环境科学学院,浙江金华321004;2.浙江省农业科学院环境资源与土壤肥料研究所,杭州310021)
摘要:为了研究磺胺二甲嘧啶(SM2)的环境光化学行为,更好地理解磺胺类抗生素在实际环境中的归趋和生态效应,实验研究了SM2在水溶液中的光降解动力学及环境因素对其光解的影响,探讨了不同初始浓度(1、2、5、10、15、20 mg·L-1)、不同光源(1000 W氙灯和300 W汞灯)、不同pH(2.0、3.0、5.0、7.0、8.0、9.0、10.0、11.0)、不同类型腐殖质[腐植酸(HA)和富里酸(FA)]对SM2光解的影响。结果表明:在300 W汞灯和1000 W氙灯2种光源下,SM2的光解均符合准一级动力学方程,但其光解速率常数存在明显差异,k (300 W汞灯)>k(1000 W氙灯);在同一光源下,SM2的光解速率常数随着初始浓度的增加而减小。溶液pH显著影响SM2的光解速率。在300 W汞灯照射下,HA和FA均抑制了SM2的光解,并且随着HA或FA浓度的增加,抑制效果更为明显;在相同光解条件下,HA对SM2光解的抑制作用大于FA。
关键词:磺胺二甲嘧啶(SM2);光化学降解;pH;初始浓度;腐植酸(HA)
陈伟,陈晓旸,于海瀛.磺胺二甲嘧啶在水溶液中的光化学降解[J].农业环境科学学报, 2016, 35(2):346-352.
近年来,医药品及个人护理用品(PPCPs)已成为一类新兴环境污染物,其在环境中的迁移、转化、归趋以及潜在的环境风险已成为环境领域的研究热点。抗生素主要用于人类和动物的疾病防治,提高牲畜生长速度,其在医药、畜牧和水产养殖业的大量使用造成了环境中耐药菌和抗性基因(Antibiotic Resistance Genes,ARGs)日益增加[1-3],其在水体[4]、土壤[5]等介质中的检出数量及检出率均较高。抗生素不仅可以选择性抑杀一些环境微生物,而且能够诱导抗药菌群的产生,从而导致特殊的生态毒理效应。抗生素类污染物作为新的环境污染物得到了广泛关注[6-8]。
磺胺类抗菌药(Sulfonamides,SAs)因具有价格低廉、广谱抗菌等特点,被普遍用作药物类饲料添加剂添加到畜禽饲料中,以防治畜禽疾病和提高畜禽生长速度。目前磺胺类兽药是畜禽养殖业广泛使用的兽用抗生素之一。抗生素类药物进入畜禽体内后,不能完全代谢,会以原药及活性代谢产物的形式随粪便排出体外。这类化合物不断进入环境,表现为“持续存在”的状态,因此也被称为“假”持久性环境污染物[9-10]。城市生活污水、畜禽养殖场废水和水产养殖废水都是水环境潜在的抗生素污染源。这3种典型废水中,养猪场废水中磺胺类药物检出频率最高,以磺胺甲口恶唑、磺胺二甲嘧啶(SM2)和磺胺甲氧嘧啶为主[11]。为了了解兽用抗生素在畜禽粪便中的残留情况,Zhao等[12]选取了全国的8个省份进行研究,结果表明SM2在猪粪中的浓度高达1.73 mg·kg-1。Li等[13]调研了珠江三角洲区域土壤中兽药的残留情况,结果发现土壤中8种磺胺类兽药的残留浓度范围达33.3~321.4 μg·kg-1。
光化学反应可以使抗生素发生不可逆的变化,并广泛发生在水体透光层[14-15]和土壤[16]等环境介质上。光降解是抗生素类污染物在环境中的重要转化途径,也是决定有机污染物环境归趋的重要途径,而且光解可有效影响其生态毒理效应[17-18]。抗生素的光化学转化受自身分子结构及环境条件的影响,其反应速率及途径由光源[19-20]、初始浓度、水环境pH值和溶解性物质[21-22]等多种因素决定[23]。本文选择SM2为代表性磺胺类抗生素,系统研究了SM2在水环境中的光解行为及环境因素对其光解的影响,旨在揭示其光解动态规律,为含该药物的废水治理提供科学依据,研究结果将有助于揭示和理解磺胺类抗生素在实际环境中的归趋和生态效应。
1 材料与方法
1.1试剂与仪器
SM2(纯度≥99%)购于百灵威公司,结构如图1所示,乙腈为色谱纯,乙酸为优级纯,氢氧化钠、硫酸均为分析纯,购于上海安普实验科技股份有限公司。腐植酸(HA)和富里酸(FA)购于国际腐殖质协会(IHSS),其特征参数与化学成分已有报道(http:// www.humicsubstances.org/index.html)。本实验主要选用两种腐殖质,一种是腐植酸IHSS Suwannee River Humic Acid StandardⅡ(SRHAⅡ,2S101H),另一种是富里酸IHSS Suwannee River Fulvic Acid StandardⅡ(SRFAⅡ,2S101F),实验用水为超纯水。
300 W高压汞灯、1000 W氙灯、截止290 nm滤光片、石英试管、石英冷阱、XPA-7型旋转式光化学反应仪,均购于南京胥江机电厂;戴安高效液相色谱(HPLC)仪(配有可变波长紫外检测器);电子天平;Acton SP-300单色仪;岛津UV-2550型紫外分光光度计;FZ-A型辐照计,UV-M型紫外辐照计购于北京师范大学光电仪器厂。
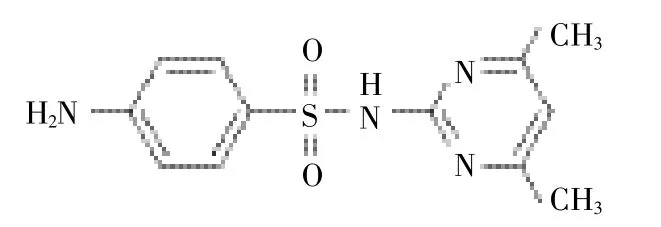
图1 SM2的结构Figure 1 Structure of sulfamethazine
1.2光化学降解实验
光解实验中,应用以下两种光源:UV-vis光源,为300 W高压汞灯,配备石英水冷套管;模拟日光(λ>290 nm)光源,为1000 W氙灯。
UV-vis和模拟日光(λ>290 nm)光照下的光解实验在XPA-7型旋转式光化学反应仪中进行。保持反应箱内通风,以控制反应温度为(35±1)℃。反应溶液置于50 mL石英试管中,于不同时间点(0、0.5、1、2、5、8、10、15、20、25、30、45、60 min)取样,过0.22 μm的一次性针头,存于棕色液相小瓶中,使用HPLC测定溶液中残存的SM2浓度。每个实验3次重复,同时设置以锡箔纸包裹的黑暗对照。
1.2.1 SM2标准母液的配制
用万分之一电子天平准确称取SM20.050 0 g,用超纯水溶解并定容至1000 mL的容量瓶中,得到50 mg·L-1的SM2标准母液,4℃保存。实验时,根据需要用超纯水逐级稀释至所需浓度。
1.2.2不同光源对SM2光解的影响
移取一定量的SM2标准母液,用超纯水稀释成10 mg·L-1的SM2光解反应液。移取15 mL反应液至50 mL石英试管中,加塞,分别置于紫外灯下(300 W高压汞灯)、模拟日光光源(1000 W氙灯,λ>290 nm)下光解,于不同时间点取样测定溶液中残存的SM2浓度。考察不同光源对SM2光解动力学的影响。
1.2.3初始浓度对SM2光解的影响
移取一定量的SM2标准母液,用超纯水分别稀释成1、2、5、10、15、20 mg·L-1的SM2光解反应液。移取15 mL反应液至50 mL石英试管中,加塞,分别置于300 W汞灯下光解,于不同时间点取样测定溶液中残存的SM2浓度。考查初始浓度对SM2光解动力学的影响。
1.2.4溶液pH对SM2光解的影响
考虑到环境污染水体实际的酸碱性,用NaOH和H2SO4配置初始pH为2.0、3.0、5.0、7.0、8.0、9.0、10.0、11.0,初始浓度均为10 mg·L-1的SM2反应液,移取15 mL反应液至50 mL石英试管中,加塞,置于300 W汞灯下光解,于不同时间点取样测定溶液中残存的SM2浓度。考察pH对SM2光解动力学的影响。
1.2.5 HA和FA对SM2光解的影响
溶解性物质对抗生素光化学转化有着显著的影响,HA和FA是天然水体中溶解性有机质(DOM)的主要组成部分,是典型的溶解性物质,也是最重要的天然吸光物质之一。为阐明不同来源、不同类型的腐殖质对SM2光降解动力学的影响,本文研究了不同浓度的SRHAⅡ和SRFAⅡ对SM2光解的影响。
配制初始浓度为10 mg·L-1的SM2溶液。不同浓度的SFHAⅡ(5、10、15 mg·L-1)和SRFAⅡ(5、10、15 mg·L-1)分别加入到10 mg·L-1的SM2溶液中,移取15 mL反应液于50 mL石英试管中,加塞,分别在300 W汞灯照射下光解,于不同时间点取样,测定溶液中残存的SM2浓度。考察不同类型和不同浓度的腐殖质在同一光源下对SM2光降解的影响。
1.3分析方法
SM2的浓度采用戴安公司HPLC(配有真空脱气泵、自动进样器、柱温箱和可变波长紫外检测器)进行定量分析。色谱柱为Waters Symmetry C18(4.6×250 mm,5.0 μm),柱温35℃,流动相为乙腈:0.5%醋酸=(20:80,V:V),流速1.0 mL·min-1,进样量20 μL,检测波长270nm,SM2的保留时间为7.6min。
1.4光源发射光谱、溶液紫外可见-吸收光谱的测定
使用单色仪测得高压汞灯、氙灯两种光源的发射光谱,见图2。将SM2、SRHAⅡ和SRFAⅡ溶液用紫外分光光度计在190~600 nm进行光谱扫描,获得SM2、SRHAⅡ和SRFAⅡ的紫外吸收光谱,见图3。

图2 不同光源的发射光谱Figure 2 Spectra of different light sources
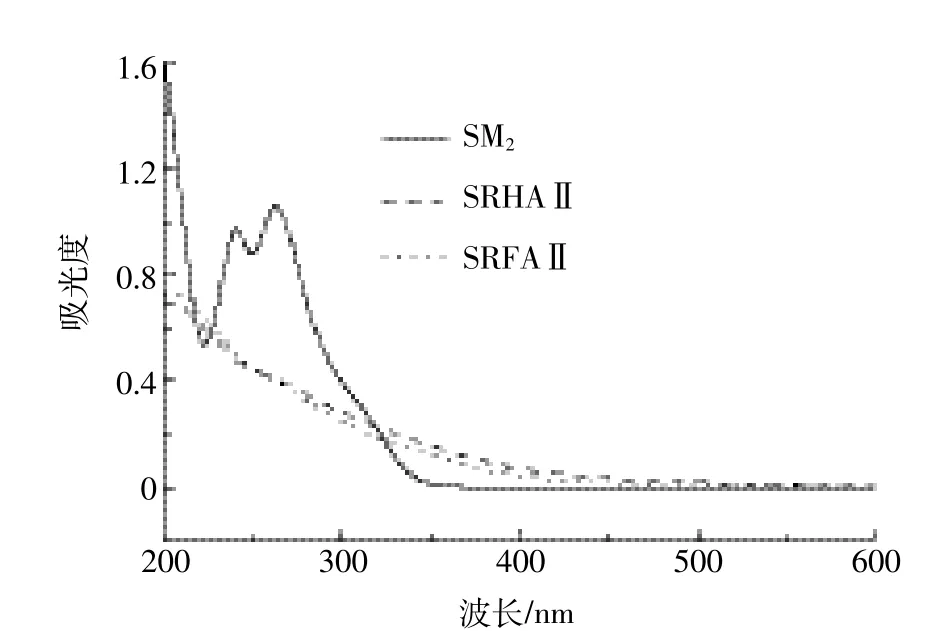
图3 SM2和腐殖质(SRHAⅡ、SRFAⅡ)的紫外-可见吸收光谱图Figure 3 UV-vis absorption spectra of SM2and Suwannee River-Derived Humic Acid(SRHAⅡ)and Suwannee River-Derived Fulvic Acid(SRFAⅡ)
1.5光源强度的测定
300 W高压汞灯、1000 W氙灯(λ>290 nm)2种光源,打开预热30 min,待光照稳定后,利用辐照计(光源条件与装有SM2光解反应液的石英试管相同),直接读数、记录。测得光源在反应溶液中心处的光强如下:300 W汞灯在峰值254 nm(230~275 nm波段)的光强为0.2 mW·cm-2,峰值297 nm(275~330 nm波段)的光强为0.18 mW·cm-2,峰值365 nm(290~330 nm波段)的光强为0.49 mW·cm-2;1000 W氙灯(λ>290 nm)在290~330 nm波段的光强为0.088 mW·cm-2,在400~1000 nm波段的光强为124.7 mW·cm-2。
1.6数据处理
降解动力学过程采用准一级动力学模型拟合,其公式为:
-dC/dt=kC
积分得:
Ct=C0e-kt
两边取对数得:
kt=ln(C0/Ct)
式中t为时间,min;C0为SM2的初始浓度,mg·L-1;Ct为SM2在t时刻的浓度,mg·L-1;k为反应速率常数,min-1。
当SM2光解1/2时(即Ct=C0/2),所需时间为光解半衰期(T1/2,min),则T1/2=ln2/k。
2 结果与讨论
与黑暗对照相比,在紫外灯或模拟日光(λ>290 nm)照射下,不同取样时间SM2的残留浓度C和初始浓度C0相比,均没有显著降低,表明纯水中SM2没有发生光降解或光解非常缓慢。
2.1标准曲线的绘制
用超纯水逐级稀释SM2标准母液,分别配制质量浓度为1、2、2.5、5、10、15、20、50 mg·L-1的标准系列溶液,按照上述条件进行HPLC分析。以标准溶液中模型化合物的峰面积对其浓度(C)作图,得到标准定量曲线,如图4所示。

图4 SM2的HPLC标准曲线Figure 4 Standard curve of sulfamethazine by HPLC
2.2不同光源对SM2光解的影响
由图5可以看出,当SM2的初始浓为10 mg·L-1时,在300 W高压汞灯、1000 W氙灯两种光源下,通过检验ln(C/C0)-t的线性关系,得到r2>0.98,可知SM2的光解符合准一级反应动力学方程。但两种光源下光解速率存在明显差异,表现为300 W高压汞灯照射下,纯水中SM2光解较快,明显大于1000 W氙灯下的光解速率。导致这种结果的主要原因是SM2的光解受本身吸收光谱和不同光源发射光谱的制约。只有当模型化合物的吸收光谱与光源的发射光谱有重叠时,才有可能发生直接光解或自敏化光解[24-25]。
根据SM2的紫外-可见吸收光谱(图3)可知,其吸收波长主要集中在200~290 nm,最大吸收波长在265 nm左右。由此可见,SM2在λ>290 nm的范围内几乎没有光吸收,故在纯水中不能光解。
由图2a可知,汞灯在200~600 nm之间辐射不连续谱线,发射光谱主要集中在短波紫外区(200~290 nm)范围内,而SM2在此范围波长内,具有显著的光吸收,所以在300 W汞灯(λ>200 nm)照射下,纯水中SM2光降解较快。而氙灯的发射光谱(图2b)主要集中在450~500 nm,SM2在此范围波长内无吸收,所以降解较慢。

图5 不同光源对SM2(C0=10 mg·L-1)光解的影响Figure 5 Effects of different light sources on photodegradationkinetics of sulfamethazine in pure water
2.3初始浓度对SM2光解的影响
SM2的初始浓度C0对其UV-vis光解的影响如图6所示。SM2的光解受C0的影响,光解速率常数k随着初始浓度的减小而增加。图7中,SM2的光解速率k与C0具有良好的线性关系(r2>0.97),SM2的光解速率k随C0的减小而增加。这可能是由于在光能一定时,增大初始浓度会使SM2的分子数相应增加,因而分子之间对光子的吸收竞争增强,单位分子平均接受的光能减少,降解的机率降低,光解速率变小,而且光解生成的产物也可能竞争吸收光子。此外,也有可能是光降解过程中有自敏化光解反应的参与。SM2光解速率常数随C0减小而增大的具体原因还需要进一步探究和验证。
2.4溶液pH对SM2光解的影响
通常情况下,自然界中污染环境下的水体酸碱性不恒定。水溶液的酸碱性对含有-COOH、-COOR、-NH2等易电离官能团的抗生素类污染物的光化学转化行为有显著影响。pH通过改变抗生素的存在形式及光化学性质而影响它们的光解动力学及光解机理,对其光解起着促进或抑制的双重作用,光化学反应的各种产物也将改变溶液的酸度,从而影响光解反应。例如磺胺类、氟喹诺酮类等抗生素,分子结构中含有酸碱解离基团,在不同pH条件下具有不同的解离形式,因此其光化学反应活性存在显著差异[25-26]。
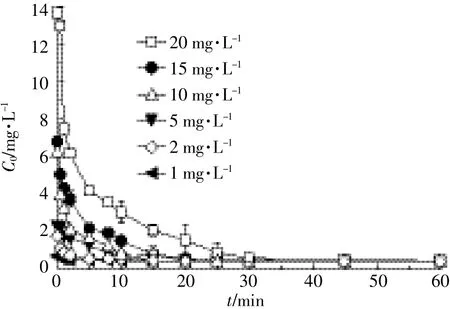
图6 初始浓度(C0)对SM2的UV-vis光解动力学的影响Figure 6 Effects of initial concentrations(C0)on UV-vis photodegradation kinetics of sulfamethazine in pure water

图7 SM2初始浓度(C0)与其反应速率常数(k)的关系Figure 7 Relationship between initial concentration(C0)of sulfadimidine and its reaction rate constant(k)
由图1可知,SM2分子中含有易电离的氨基和磺酰胺基基团,它的溶解度和存在形态受水体酸碱性影响。为进一步了解SM2不同存在形态的光解情况,本研究利用不同pH值的SM2水溶液模拟不同酸碱度的水体开展光解实验。实验中,光照前后,暗对照处理的不同取样时间SM2的残留浓度C和C0相比,均没有显著降低,排除了在光照期间pH影响SM2水解的可能性。
由表1可以看出,在300 W汞灯照射下,溶液的pH对SM2光解速率的影响较大。如图8所示,SM2在不同pH溶液中光解速率表现为:k(pH9.0)>k(pH7.0)>k(pH2.0)>k(pH10.0)>k(pH8.0)≈k(pH5.0)>k(pH3.0)>k(pH11.0)。Gao等[27]研究表明SM2在酸性解离常数(pKa,1=2.6±0.2)至碱性解离常数(pKa,2=8±1)的pH范围内,主要以呈电中性的磺胺(SM02)形式存在,以阳离子(SM2+)、两性离子(SM2+/-)、阴离子(SM2-)形式存在较少;在2个解离常数附近,主要以SM2-、SM2+离子形式存在。因此,SM2在不同pH值下有2种不同的解离形式,解离形式不同可能吸收光谱也不同,所以光解量子产率也会存在差异,从而导致其光化学反应活性出现显著差别。根据实验数据计算:在pH=9.0时,SM2的光解速率常数最大,光解最快;其次是pH=7.0和pH=2.0时,光解速率常数较pH=9.0时相对减小,但是光解速率仍很快。这3个pH点分别在SM2的酸碱解离常数附近,SM2更多以离子形态存在而更有利于光解。pH值为10.0、8.0、5.0时,光解速率常数差异不显著,并且速率变慢,pH值为3.0、11.0时,光解速率最慢,此时绝大多数SM2以中性形态存在,反而不利于其光解。由此可以得出,磺胺类抗生素的存在形态和光化学性质受pH的影响,SM2的离子形态比中性形态更有利于其光解。因此,可通过改变环境中含该药物的废水的酸碱性来加快药物光降解。
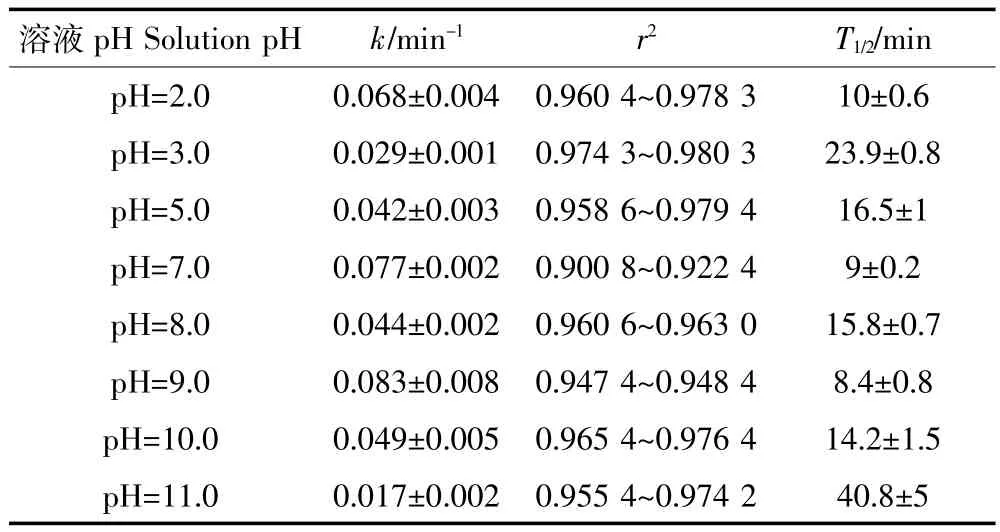
表1 不同pH溶液中SM2(C0=10 mg·L-1)的UV-vis光解动力学参数Table 1 Kinetic parameters for SM2(C0=10 mg·L-1)in aqueous solution with different pH

图8 溶液pH值对SM2(C0=10 mg·L-1)光解速率常数(k)的影响Figure 8 Effect of pH on photolytic rate constant(k)of sulfamethazine in pure water
2.5 HA和FA对SM2光解的影响
在UV-vis和模拟太阳光光解实验的暗对照中,溶液中SM2的C与C0相比均没有明显降低,因此可以认为,在光解实验(每次60 min)中,SM2的浓度降低全部是由光降解作用引起的。
由图9和图10可见,300 W汞灯照射下,分别添加不同浓度的SRHAⅡ、SRFAⅡ时,两者均抑制了SM2的光解,并且随着浓度的增加,抑制效果更为显著。
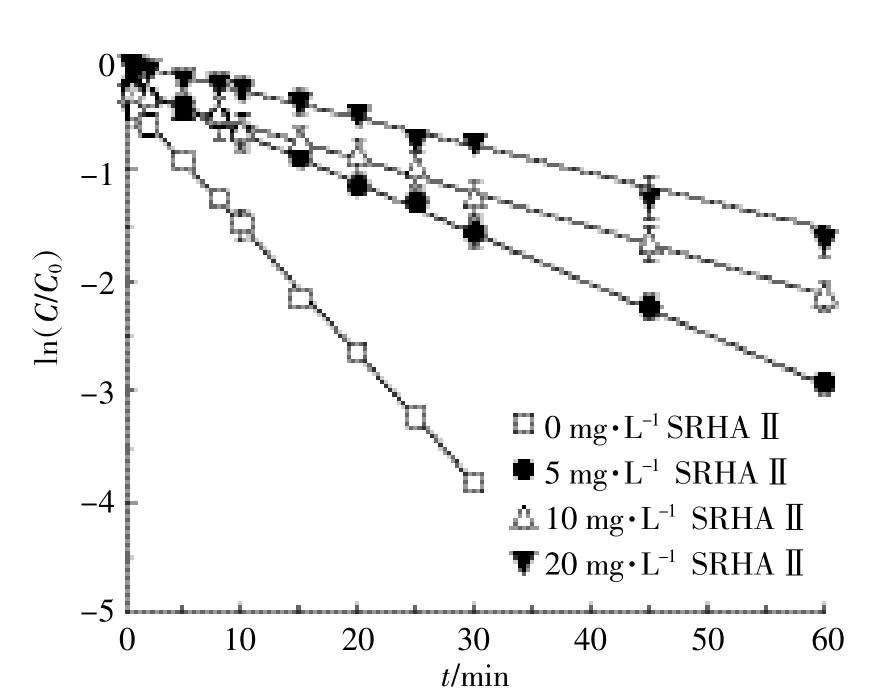
图9 UV-vis光源下不同浓度的SRHAⅡ对SM2光解动力学的影响Figure 9 Effects of different concentrations of SRHAⅡon UV-vis photodegradation kinetics of sulfamethazine in pure water
从SRHAⅡ和SRFAⅡ的紫外吸收光谱图(图3)可以看出,在200~290 nm,两者均有较强的光吸收,而SM2的吸收波长正好也集中在此范围内。在300 W汞灯照射时,SRHAⅡ和SRFAⅡ对光解的抑制是因为其与SM2竞争吸收短波长的光子(200 nm<λ<290 nm),即SRHAⅡ(SRFAⅡ)的光掩蔽效应(腐殖质与化合物竞争光吸收)。随着SRHAⅡ(SRFAⅡ)浓度的增加,竞争吸收短波长的光子增多,光掩蔽效应愈加显著。

图10 UV-vis光源下不同浓度的SRFAⅡ对SM2光解动力学的影响Figure 10 Effects of different concentrations of SRFAⅡon UV-vis photodegradation kinetics of sulfamethazine in pure water
图11显示,在300 W汞灯光源下,分别添加相同浓度的SRHAⅡ、SRFAⅡ时,SRHAⅡ对SM2光解的抑制作用大于SRFAⅡ。此结果表明,同一来源的腐殖质对化合物光解的影响大致相同,而不同的性质及组成对化合物的光解作用效果不同。腐殖质对SM2光解的抑制作用依赖于其来源和组成,SRHAⅡ和SRFAⅡ来源相同但结构、组成不同,所以对SM2光解的影响也不完全相同。前人大量研究表明,HA既可作为光敏剂促进污染物光降解[28-29],也可作为光掩蔽剂或自由基捕获剂而抑制污染物光降解[30],其对抗生素光解的影响表现为双重作用。然而,腐殖质对抗生素类化合物光化学行为的影响机理很复杂,涉及其来源和性质、目标化合物的性质、水中离子、光源光谱等多种因素[25],因此有待进一步的研究。

图11 UV-vis光源下同一浓度的SRHAⅡ、SRFAⅡ对SM2光解动力学的影响Figure 11 Effects of SRHAⅡand SRFAⅡon UV-vis photodegradation kinetics of sulfamethazine in pure water
3 结论
(1)在300 W汞灯和1000 W氙灯2种光源下,SM2的光解符合准一级动力学方程,但其光解速率常数存在明显差异,k(300 W汞灯)>k(1000 W氙灯)。
(2)在同一光源下,SM2的光解速率常数随初始浓度的增加而减小。
(3)SM2的光解速率常数受溶液pH值的影响,表现为SM2以离子形态存在的pH值下的光解速率常数明显大于以中性形态存在的pH值下的光解速率常数。
(4)在300 W汞灯光源下,HA和FA均抑制了SM2的光解,并且随着HA或FA浓度的增加,抑制效果更为明显。
(5)在300 W汞灯光源下,分别添加相同浓度的HA、FA,HA对SM2光解的抑制作用大于FA。腐植酸的组成和光反应活性的不同与其不同的来源、性质有密切关系。
参考文献:
[1] Knapp C W, Dolfing J, Ehlert P A I, et al. Evidence of increasing antibiotic resistance gene abundances in archived soils since 1940[J]. Environmental Science & Technology, 2010, 44(2):580-587.
[2] Martinez J L. Environmental pollution by antibiotics and by antibiotic resistance determinants[J]. Environmental Pollution, 2009, 157(11):2893-2902.
[3] Negreanu Y, Pasternak Z, Jurkvitch E, et al. Impact of treated water irrigation on antibiotic resistance in agricultural soils[J]. Environmental Science & Technology, 2012, 46(9):4800-4808.
[4] Rodil R, Quintana J B, Concha-Graña E, et al. Emerging pollutants in sewage, surface and drinking water in Galicia(NW Spain)[J]. Chemosphere, 2012, 86(10):1040-1049.
[5] Kaiser D, Wappelhorst O, Oetken M, et al. Occurrence of widely used organic UV filters in lake and river sediments[J]. Environmental Chemistry, 2012, 9(2):139-147.
[6] Schwarzenbach R P, Escher B I , Fenner K, et al. The challenge of micropollutants in aquatic systems[J]. Science, 2006, 313(5790):1072-1077.
[7] Kemper N. Veterinary antibiotics in the aquatic and terrestrial environment[J]. Ecological Indicators, 2008, 8(1):1-13.
[8] Segura P A, Francois M, Gagnon C, et al. Review of the occurrence of anti-infectives in contaminated wastewaters and natural and drinking waters[J]. Environmental Health Perspectives, 2009, 117(5):675-684.
[9] Watkinson A J, Murby E J, Kolpin D W, et al. The occurrence of antibiotics in an urban watershed:From wastewater to drinking water[J]. Science of the Total Environment, 2009, 407(8):2711-2723.
[10] Gulkowska A, Leung H W, So M K, et al. Removal of antibiotics from wastewater by sewage treatment facilities in HongKong and Shenzhen, China[J]. Water Research, 2008, 42(1/2):395-403.
[11]姜蕾,陈书怡,杨蓉,等.长江三角洲地区典型废水中抗生素的初步分析[J].环境化学, 2008, 27(3):371-374. JIANG Lei, CHEN Shu-yi, YANG Rong, et al. Occurrence of antibiotics in the aquatic environment of the Changjiang delta, China[J]. Environmental Chemistry, 2008, 27(3):371-374.
[12] Zhao L, Dong Y H, Wang H. Residues of veterinary antibiotics in manures from feedlot livestock in eight provinces of China[J]. Science of the Total Environment, 2010, 408(5):1069-1075.
[13] Li Y W, Wu X L, Mo C H. Investigation of sulfonamide, tetracycline, and quinolone antibiotics in vegetable farmland soil in the Pearl River delta area Southern China[J]. Journal of Agricultural and Food Chemistry, 2011, 59(13):7268-7276.
[14] Ge L K, Chen J W, Wei X X, et al. Aquatic photochemistry of fluoroquinolone antibiotics:Kinetics, pathways, and multivariate effects of main water constituents[J]. Environmental Science & Technology, 2010, 44(7):2400-2405.
[15] Lam M W, Young C J, Mabury S A. Aqueous photochemical reaction kinetics and transformations of fluoxetine[J]. Environmental Science & Technology, 2005, 39(2):513-522.
[16] Wolters A, Steffens M. Photodegradation of antibiotics on soil surface: Laboratory studies on sulfadiazine in an ozone-controlled environment [J]. Environmental Science & Technology, 2005, 39(16):6071-6078.
[17] West C E, Rowland S J. Aqueous phototransformation of diazepam and related human metabolites under simulated sunlight[J]. Environmental Science & Technology, 2012, 46(9):4749-4756.
[18] Kelly M M, Arnold W A. Direct and indirect photolysis of the phytoestrogens genistein and daidzein[J]. Environmental Science & Technology, 2012, 46(10):5396-5403.
[19] Ge L K, Chen J W, Qiao X L, et al. Light-source-dependent effects of main water constituents on photodegradation of phenicol antibiotics:Mechanismand kinetics[J]. Environmental Science & Technology, 2009, 43(9):3101-3107.
[20] MacManus-Spencer L A, Tse M L, Klein J L, et al. Aqueous photolysis of the organic ultraviolet filter chemical octyl methoxycinnamate[J]. Environmental Science & Technology, 2011, 45(9):3931-3937.
[21]葛林科,陈景文,张思玉,等.水中氟喹诺酮类抗生素加替沙星的光降解[J].科学通报, 2010, 55(11):996-1001. GE Lin-ke, CHEN Jing-wen, ZHANG Si-yu, et al. Photodegradation of fluoroquinolone antibiotic gatifloxacin in aqueous solutions[J]. Chinese Science Bulletin, 2010, 55(11):996-1001.
[22] Li Y, Niu J F, Shang E X, et al. Effects of nitrate and humic acid on enrofloxacin photolysis in an aqueous system under three light conditions:Kinetics and mechanism[J]. Environmental Chemistry, 2014, 11 (3):333-340.
[23]张思玉,杨先海,陈景文,等.有机防晒剂在水环境中的光化学行为[J].科学通报, 2013, 58(30):2989-3006. ZHANG Si-yu, YANG Xian-hai, CHEN Jing-wen, et al. Aquatic environmental photochemical behavior of organic sunscreens[J]. Chinese Science Bulletin, 2013, 58(30):2989-3006.
[24] Boreen A L, Edhlund B L, Cotner J B, et al. Indirect photodegradation of dissolved free amino acids:The contribution of singlet oxygen and the differential reactivity of DOM from various sources[J]. Environmental Science & Technology, 2008, 42(15):5492-5498.
[25]葛林科,张思玉,谢晴,等.抗生素在水环境中的光化学行为[J].中国科学B辑:化学, 2010, 40(2):124-135. GE Lin-ke, ZHANG Si-yu, XIE Qing, et al. Progress in studies on aqueous environmental photochemical behavior of antibiotics[J]. Scientia Sinica Chimica, 2010, 40(2):124-135.
[26] Boreen A L, Arnold X A, McNeill K. Photochemical fate of sulfa drugs in the aquatic environment:Sulfa drugs containing five-membered heterocyclic groups[J]. Environmental Science & Technology, 2004, 38 (14):3933-3940.
[27] Gao J, Pedersen J A. Adsorption of sulfonamide antimicrobial agents to clay minerals[J]. Environmental Science & Technology, 2005, 39 (24):9509-9516.
[28] Hassett J P. Dissolved natural organic matter as a microreactor[J]. Science, 2006, 311(5768):1723-1724.
[29] Zhang S Y, Chen J W, Wang Y, et al. Humic acids decrease the photodegradation of the sunscreen UV filter 2-phenylbenzimidazole-5-sulfonic acid in natural waters[J]. Environmental Chemistry Letters, 2012, 10(4):389-394.
[30] Chiron S, Minero C, Vione D. Photodegradation processes of the antiepileptic drug carbamazepine, relevant to estuarine waters[J]. Environmental Science & Technology, 2006, 40(19):5977-5983.
CHEN Wei, CHEN Xiao-yang, YU Hai-ying. Photochemical degradation of sulfamethazine in aqueous solution[J]. Journal of Agro-Environment Science, 2016, 35(2):346-352.
Photochemical degradation of sulfamethazine in aqueous solution
CHEN Wei1, CHEN Xiao-yang2, YU Hai-ying1*
(1.College of Geography and Environmental Sciences, Zhejiang Normal University, Jinhua 321004, China; 2.Institute of Environmental Resource & Soil Fertilizer, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China)
Abstract:As an emerging contaminant, sulfamethazine(SM2)has been widely detected in environmental waters. Investigating the environmental photochemical behavior of SM2in aqueous solution is of great significance for understanding its environmental fates and ecological effects. In this study, the effects of light sources, initial concentrations, pH and humic acids on the photochemical degradation of SM2in aqueous solution were investigated. Results indicated that the photolysis of SM2followed pseudo-first-order kinetics equation, and the photolytic rate constants of SM2under different light sources were significantly different, k(300 W ML)>k(1000 W XL). Under the same photolysis conditions, its photolytic rate constants decreased with increasing initial SM2concentrations. The solution pH significantly influenced the photolysis rates of SM2. With the irradiation of 300 W ML, humic acid(HA)and fulvic acid(FA)could inhibit SM2photolysis, and the inhibitory effects became more obvious at increased concentrations of HA or FA, mainly because of masking effect of light. The inhibitory effect of HA on SM2photolysis was greater than that of FA.
Keywords:sulfamethazine(SM2); photolysis; pH; initial concentration; humic acid(HA)
*通信作者:于海瀛E-mail:yhy@zjnu.cn
作者简介:陈伟(1989—),女,硕士研究生,主要研究方向为抗生素的光化学降解。E-mail:mimuchenhi@163.com
基金项目:国家自然科学青年基金(21307115);浙江省自然科学基金(Y5110338)
收稿日期:2015-08-28
中图分类号:X52
文献标志码:A
文章编号:1672-2043(2016)02-0346-07
doi:10.11654/jaes.2016.02.019
