不同生长模式下人参土壤微生物群落结构研究
2016-03-22王秋霞张迪迪徐成路张亚玉中国农业科学院特产研究所长春130112
孙 海,王秋霞,张迪迪,刘 宁,李 乐,徐成路,张亚玉(中国农业科学院特产研究所,长春 130112)
不同生长模式下人参土壤微生物群落结构研究
孙海,王秋霞,张迪迪,刘宁,李乐,徐成路,张亚玉*
(中国农业科学院特产研究所,长春130112)
摘要:为明确不同生长模式下人参土壤微生物群落结构组成,以野山参、林下参和农田栽参土壤作为试验材料,利用磷脂脂肪酸分析法(PLFA)测定人参土壤微生物群落结构组成。结果表明,不同生长模式下人参土壤中C、N含量不同,野山参土壤中全C和全N含量均显著高于林下参和农田栽参土壤(P<0.05),是农田栽参土壤的10.30和4.61倍;C/N比为野山参土壤>林下参土壤>农田栽参土壤,野山参和林下参土壤C/N比差异不显著,但远高于农田栽参土壤;野山参土壤微生物总量最高为1 671.05 nmol·g-1,农田栽参土壤最低为266.80 nmol·g-1。不同人参生长模式下细菌均为优势菌群,但放线菌在野山参土壤中含量为187.18 nmol·g-1,林下参土壤中为26.12 nmol·g-1,农田栽参土壤中为6.77 nmol·g-1。通过挖掘功能微生物发现,代表抗逆性微生物指标蓝细菌(18∶2ω6)及革兰氏阳性菌与革兰氏阴性菌比值(G+/G-)均为野山参土壤>林下参土壤>农田栽参土壤,野山参土壤中蓝细菌含量是林下参土壤的3.51倍,农田栽参土壤则未检出;野山参土壤中G+/G-分别是林下参土壤和农田栽参土壤的6.93和9.10倍。野山参土壤微生物量大、种群丰度高,生产实践中可通过添加外援微生物改变土壤微生物群落结构及组成提高农田栽参土壤肥力。
关键词:人参;微生物群落结构;磷脂脂肪酸;土壤碳氮比
孙海,王秋霞,张迪迪,等.不同生长模式下人参土壤微生物群落结构研究[J].东北农业大学学报, 2016, 47(2): 16-23. Sun Hai, Wang Qiuxia, Zhang Didi, et al. Study on soil microbial community structure of different growth patterns in Panax ginseng[J]. Journal of Northeast Agricultural University, 2016, 47(2): 16-23. (in Chinese with English abstract)
人参(Panax ginseng C.A. Meyer)为五加科多年生草本植物,按照生长模式可分为农田栽培人参、林下参和野山参。野山参由于掠夺式采挖目前已濒临灭绝,林下参生长环境具有人为干扰少、生长周期长及一定的野山参外部形态和内在品质特征[1]。林下参是高品质人参产品,经济价值和药用价值均高于农田栽培人参。农田栽参是目前人参主要生长模式,但连续栽培园参往往导致连作障碍现象。人参连作障碍产生原因主要有土壤理化性质恶化、植物化感自毒作用、土壤微生物群落结构变化等[2-4]。这三大因素均与土壤存在密切关系,土壤微生物是土壤肥力活性指标,反映土壤扰动情况,土壤微生物群落结构研究可最大限度反映土壤扰动、变迁等时空异质性[5-6]。不同生长模式下人参土壤利用程度不同,野山参和林下参土壤均属森林生态环境,人为干扰小。而农田栽参属于农田生态系统,人为影响大,土地利用和管理水平很大程度上影响土壤质量变化程度[7-8]。
土壤微生物群落是土壤微生态中最重要的功能组分,直接影响土壤肥力[9-10]。张亚玉等在人参土壤肥力方面已对不同生长模式下土壤养分、酶活性、重金属污染情况及单个生长模式下微生物群落结构开展研究[11-13]。而不同生长模式下人参产量和品质差异显著。本研究以野山参土壤微生物群落结构为参照,探讨土壤微生物群落结构对不同生长模式下人参土壤环境响应及影响土壤微生物群落结构因素,为人参科学种植提供依据。
1 材料与方法
1.1材料
野山参土壤样品采自吉林省抚松县露水河黑熊沟山,采集6株野山参。在该区域露水河镇某林下参基地采集林下参,选择同一坡度、坡位、坡向生长,5、10、15、20和25年生林下参,5、10 和15年取3株林下参土壤混合,20和25年取2株混合。野山参和林下参“边抬参边取土”,采样深度为4~10 cm,采集时先除去枯枝落叶层,收集人参及须根周围直径3 cm范围内土壤,将土壤装入封口塑料袋中,带回实验室,一部分-4℃冰箱保存用于测定微生物(48 h内提取完成),另一部分去除枯枝落叶后风干,分别过20目和100目土壤筛,装袋用于土壤化学性质测定。
农田栽参土壤样品采自吉林省长春市乐山镇农田栽参种植基地。采集地土壤类型为白浆土,选择1、2、3、4年生人参多点取样法取样,采样方法采样与野山参和林下参一致,但农田栽参采样深度为0~15 cm。不同生长模式下人参土壤采集点均属于东北嫩江平原,年降雨量586 mm,无霜期151 d,昼夜温差大,冬季温度低,年平均气温4.6℃,气候特点适宜人参生长,采样时间均为7月下旬,具体信息见表1。

表1样品分布信息Table 1 Distribution information of ginseng sample
1.2方法
1.2.1土壤化学性状测定
土壤全C和全N采用德国元素分析仪Vario ELⅢ测定,土水比1∶2.5测定土壤pH,具体方法参照文献[14]。
1.2.2土壤微生物分析
土壤微生物磷脂脂肪酸测定参照White等方法[15]并改进。鲜土加入柠檬酸缓冲液∶氯仿∶甲醇= 0.8∶1∶2,25℃避光震荡提取4 h(转速200 r·min-1),离心3 000 r·min-1,15 min。再加入柠檬酸缓冲液∶氯仿∶甲醇=0.9∶1∶1,震荡,避光保存,经18 h分离后,吸管吸去上层液,保留底层氯仿相在氮气流下吹干。柱层析硅胶(100~200目)0.8 g(120℃下烘干2 h)填充玻璃管柱(直径6 mm),依次加10 mL氯仿、10 mL丙酮、10 mL甲醇,收集到的磷脂脂肪酸在甲醇相中,氮气流下吹干样品。向干样品中加入1 mL甲醇∶甲苯(1∶1)混合液和1 mL 0.2 mol·L-1KOH甲醇溶液,37℃水浴15 min后,冷却至室温,依次加入2 mL去离子水,0.3 mL 1 mol·L-1HAc,2 mL正己烷,震荡2 h(转速200 r·min-1),3 000 r·min-1,离心15 min,甲酯化的C19:0为内标,氮气流下吹干,-20℃下保存。外标为SupelcoTM 37 Component FAME Mix和Bacterial Acid Methl Esters Mix。
检测部分由安捷伦GC-MS(6890 N-5973 N)完成。色谱柱为hp5-MS(30 m×250 μm×0.25 μm)石英毛细管柱。GC-MS分析条件:进样后70℃保持5 min,以20℃·min-1速率升至190℃,保持1 min,以5℃·min-1速率上升到200℃,停留2 min,以10℃·min-1速率上升到280℃,保留8 min。进样口温度为250℃,载气为He(0.9 mL·min-1),分流比为10∶1,离子源温度230℃,四极杆:150℃,质谱全扫描范围:30~600 m·z-1。
1.3数据分析
脂肪酸定量用峰面积和内标曲线法。内标为甲酯化的19∶0,外标为SupelcoTM 37 Component FAME Mix和Bacterial Acid Methl Esters Mix。PLFA含量用nmol·g-1表示。脂肪酸链长以碳原子总数计算,从羧基开始,冒号后数字代表双键数目,ω后数字代表双键位置(从羧基端算起),c表示顺势双键,t表示反式双键,i表示顺势支链,a表示反势支链,br表示不确定支链位置,Me表示甲基位置,cy表示环丙基,磷脂脂肪酸分类见表2。
数据利用Excel 2010软件处理分析,利用SAS9.0方差分析,利用Canoco5作主成分分析和载荷因子分析。

表2磷脂脂肪酸代表微生物Table 2 Characteristic microbial of phospholipid fatty acid
2结果与分析
2.1不同生长模式下土壤理化性状变化
由表3可知,人参土壤pH 5.39~5.65,其中农田栽参土壤pH最低、林下参土壤最高,三种生长模式下差异不显著(P<0.05)。三种生长模式下土壤全C和全N含量差异较大,均以野山参土壤中含量最高,碳氮含量分别为101.4和7.89 g·kg-1,农田栽参土壤最低,分别为9.84和1.71 g·kg-1,林下参土壤介于二者之间,且三种生长模式差异显著(P<0.05)。C/N以野山参土壤最高,农田栽参土壤最低,野山参土壤C/N是农田栽参土壤的19.13倍,差异显著(P<0.05)。
2.2不同生长模式下土壤微生物量和群落组成
野山参和林下参土壤检测出24种磷脂脂肪酸,农田栽参土壤中微生物种类较少,共检出20种磷脂脂肪酸。分析三种生长模式下检测量相对稳定的26种磷脂脂肪酸(见表4),野山参土壤微生物量最高为1 671.05 nmol·g-1,林下参土壤次之为670.64 nmol·g-1,农田栽参最低为266.80 nmol·g-1,差异显著(P<0.05)。不同生长模式下各磷脂脂肪酸含量不同,农田栽参土壤中各磷脂脂肪酸含量为16∶0>I15∶0>a15∶0,林下参土壤中为I15∶0>18∶1w9t> a15∶0,野山参土壤为a15∶0>I15∶0>10Me17∶0。

表3三种生长模式下人参土壤特征值及变化范围Table 3 Mean values and range of variation of the main properties, including some biochemical properties of the soils under different types of planting model
对三种生长模式下人参土壤微生物归类(见表5),细菌和放线菌量显示为野山参土壤>林下参土壤>农田栽参土壤,真菌量为林下参土壤>野山参土壤>农田栽参土壤,其中野山参土壤细菌和真菌量分别是农田栽参土壤的5.57和27.65倍。三种生长模式下细菌均为优势微生物菌群,细菌和真菌量均呈显著差异(P<0.05)。
对细菌组成区分表明(见表5),林下参土壤中厌氧细菌和好氧细菌量均高于其他两种生长模式,农田栽参土壤中未检出好氧细菌。蓝细菌是具有特征性磷脂脂肪酸的原核微生物,野山参土壤中蓝细菌含量显著高于林下参(P<0.05),农田栽参土壤中未检出。革兰氏阳性菌与革兰氏阴性菌比值(G+/G-)一定程度上可表征微生物抗逆境胁迫能力[22],野山参土壤中G+/G-最高25.58,显著高于林下参和农田栽参土壤(P<0.05),表明野山参土壤的抗逆性较强。
2.3不同生长模式对微生物群落结构组成影响
分析三种生长模式下人参土壤微生物PLFA作主成分(见图1),主成分一解释度为34.42%,主成分二解释度为31.66%。主成分一和主成分二可区分不同生长模式下人参土壤微生物群落结构组成,其中农田栽参土壤与主成分一呈高度正相关关系,组内各样点相近,表示农田栽参土壤微生物一致。野山参土壤与主成分二呈高度正相关。林下参和农田栽参与主成分二呈高度负相关关系。
通过各种磷脂脂肪酸主成分因子载荷分析(见图2),磷脂脂肪酸18∶1ω9t和23∶0在主成分一上载荷值较高,是主成分一的代表因子,其中18∶1ω 9t是真菌的代表脂肪酸。代表细菌的I16∶0、代表放线菌的18∶(10Me)和17∶0(10Me)在主成分一上载荷值较低,表明农田栽参土壤真菌较高,细菌和放线菌较低。a15∶0、I15∶0、a18∶0、18∶1ω9t、23∶0在主成分二上载荷值较高,可作为主成分二代表因子,18∶2ω9和18∶2ω6在主成分二上载荷值较低。其中脂肪酸a15∶0、I15∶0和a18∶0为细菌代表脂肪酸,18∶2ω6为真菌标志性脂肪酸。由此可见,野山参土壤细菌较高、真菌较低,而林下参和农田栽参土壤中细菌较低、真菌较高。
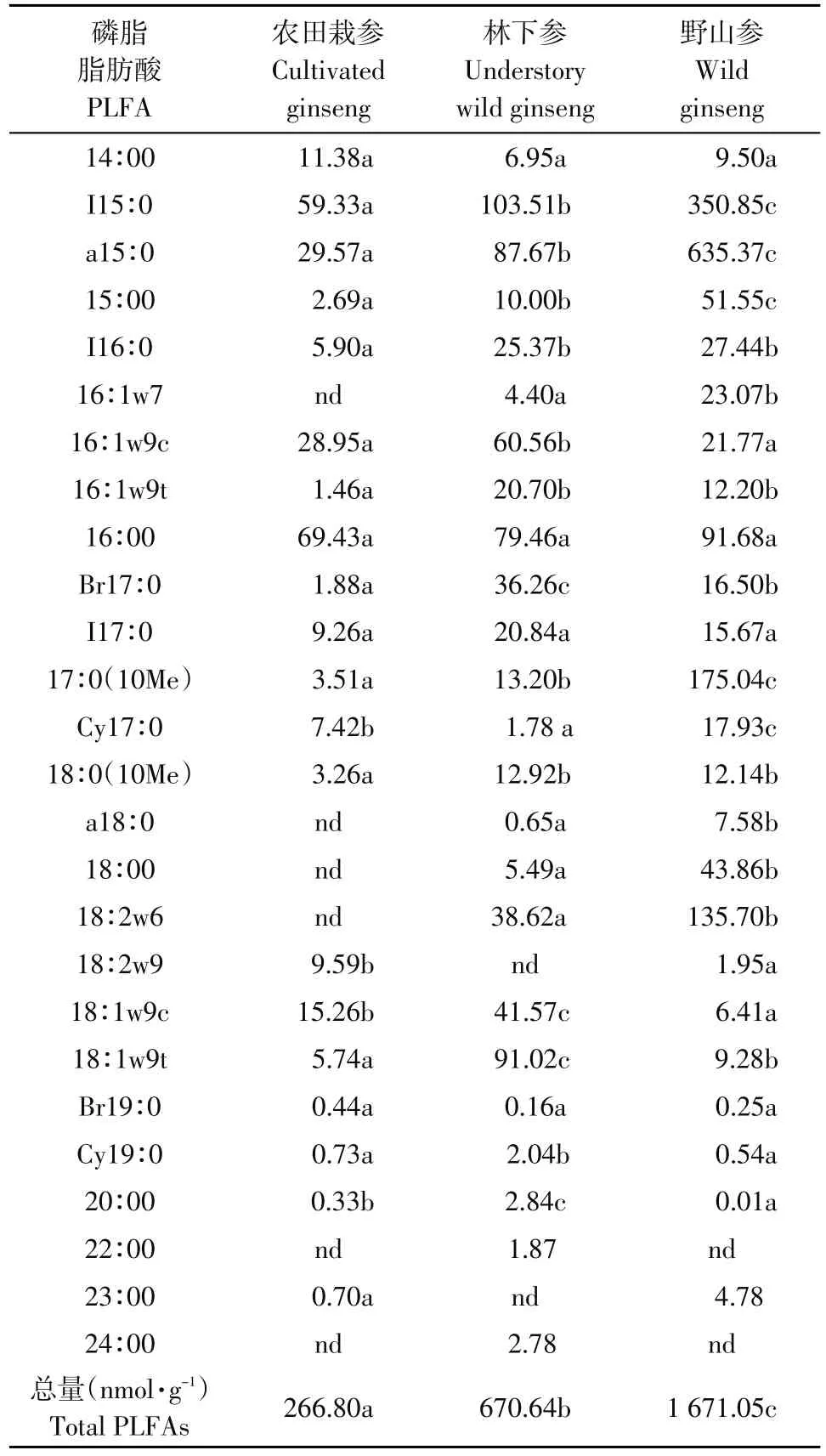
表4三种生长模式下人参土壤磷脂脂肪酸种类及含量Table 4 Type and content of ginseng soil PLFA under different growth patterns
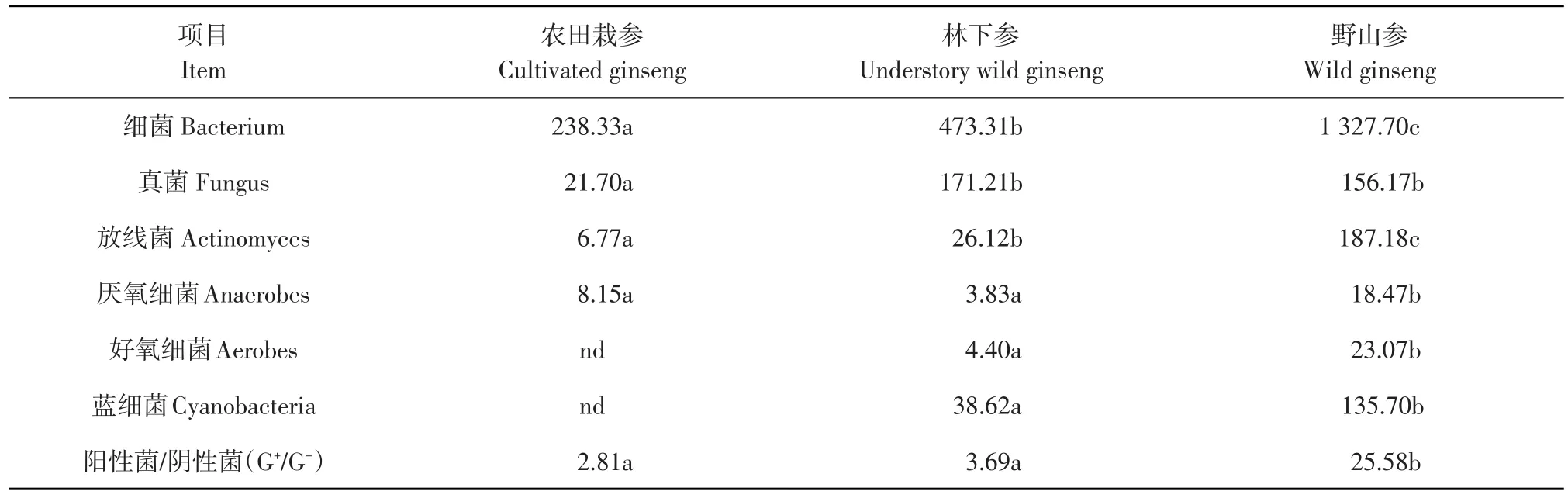
表5三种生长模式下人参土壤微生物数量Table 5 Ginseng soil microbial quantity under different growth patterns

图1不同生长模式下土壤微生物群落PLFA主成分分析Fig. 1 Principle components analysis of PLFA profiles from soil microbial communities under different growth patterns
2.4土壤微生物量(PLFA总量)与土壤因子相关分析
土壤微生物量与土壤因子分析表明,土壤微生物量与全C和全N呈极显著正相关,相关系数分别为0.835和0.888。表明全C和全N是微生物生长和活性的主要营养因子。
3讨论
植物凋落物和分泌物为土壤微生物提供营养,使植物和微生物协同进化,可提高土壤微生物多样性[23]。碳氮作为土壤微生物繁衍的主要碳源和氮源,直接影响土壤微生物群落结构多样性。而土壤中碳氮主要来源于植被枯枝落叶及根系脱落物,野山参土壤中碳氮含量是农田栽参中的10.52倍。本研究中野山参采样点位于长白山山脉,植被丰富、物种多样,属于原始森林环境,林下参虽和野山参在同一区域,但采样点为针阔混交次生林,农田栽参属于农田生态系统,植被单一,受农艺措施影响较大[24]。植被不同导致不同生长模式下人参土壤碳氮含量差异。土壤微生物碳氮比越高,土壤微生物量越高,不同生长模式下人参土壤微生物量高低与土壤中碳氮比一致,以野山参土壤微生物量最高、农田栽参最低,林下参介于二者之间,与前人研究结果一致[25]。
不同生长模式下人参土壤微生物量、优势种群及群落结构组成不同。原因是不同生长模式下土壤凋落物组成和质量不同,导致土壤碳源和氮源多样化,影响微生物群落结构组成,对土壤微生物产生定向调控[26-27],土壤微生物量和土壤因子相关分析表明,碳氮含量直接影响土壤微生物丰度和群落结构组成(相关系数为0.835和0.888)。适宜土壤生境条件是人参形态建成和有效物质积累前提,生产实践中需改良农田栽参土壤,维持养分含量和微生物量,保证养分供应及土壤微生物多样性。

图2不同生长模式下土壤微生物群落PLFA载荷因子贡献及与土壤因子相关性分析Fig. 2 Eigenvector loadings of PLFA contributing and correlation analysis under different growth patterns
土壤微生物群落结构组成差异决定功能多样性[28]。土壤中放线菌一般为人参生长有益菌群,与人参产量和抗病性有关[29],野山参土壤中放线菌占总微生物量的11.20%,林下参土壤为3.89%,农田栽参土壤为2.54%,野山参土壤中放线菌远高于农田栽参土壤,达27.65倍。野山参土壤放线菌无论含量还是在总微生物量中百分比均最高,可能是其生长几十年甚至更长时间不感病原因。蓝细菌是典型原核生物,能在贫瘠甚至极端环境中生存,具有独特固氮和生存能力,在植物碳氮循环中具有重要作用[30-31],野山参土壤中蓝细菌量为135.70 nmol·g-1,林下参土壤中为38.62 nmol·g-1,农田栽参土壤中未检出,可见野山参土壤抗逆境性较高。另外,革兰氏阳性菌比革兰氏阴性菌(G+/G-)一定程度上可表征微生物抗逆境胁迫能力,野山参土壤G+/G-比值最高,证实野山参抗逆境能力最强。野山参土壤中好氧细菌最高,林下参次之,农田栽参未检出,厌氧细菌野山参最高,农田栽参次之,林下参最低,原因是农田栽参通透性变差。
4结论
不同生长模式下人参土壤碳氮储量差异显著,其中野山参土壤最高,林下参次之,农田栽参最低,土壤中碳氮储量影响微生物群落结构多样性。农田栽参土壤中代表真菌的磷脂脂肪酸18∶1ω9t较高,代表细菌的磷脂脂肪酸I16∶0、代表放线菌的磷脂脂肪酸18∶(10Me)和17∶0(10Me)较低;野山参土壤中代表细菌的磷脂脂肪酸a15:0、I15∶0和a18∶0较高,代表真菌的磷脂脂肪酸18∶2ω 6较低;林下参土壤中代表细菌的磷脂脂肪酸a15∶0、I15∶0和a18∶0较低,代表真菌的磷脂脂肪酸18∶2ω6较高。
从微生物群落结构组成看,三种人参生长模式下均以细菌为优势菌群,但有益微生物放线菌含量及百分比在野山参土壤中最高。特殊微生物群落结构使野山参具有极强抗逆性,农田栽参土壤微生物种群单一,抗逆性最弱。
[参考文献]
[ 1 ]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社, 2015: 8.
[ 2 ]肖春萍,杨利民,马锋敏.栽培年限对人参根际土壤微生物活性及微生物量的影响[J].中国中药杂志, 2014, 39(24): 4740-4747.
[ 3 ] Wright C J, Coleman D C. Responses of soil microbial biomass, nematode trophic groups, N-mineralization, and litter decomposition to disturbance events in the southern Appalachians[J]. Soil Biology and Biochemistry, 2012, 20: 34-41.
[ 4 ] Martirosyan V, Ehrlich R, Frend Y, et al. Spatial heterogeneity of a microbial community in a sandy soil ecosystem[J]. Pedobiologia, 2013, 56(4-6): 195-203.
[ 5 ] Liu X L, He Y Q, Zhang H L, et al. Impact of land use and soil fertility on distributions of soil aggregate fractions and some nutrients[J]. Pedosphere, 2010, 20(5): 666-673.
[ 6 ] Ge T D, Chen X J, Yuan H Z, et al. Microbial biomass, activity, and community structure in horticultural soils under conventional and organic management strategies[J]. European Journal of Soil Biology, 2013, 58: 122-128.
[ 7 ]张亚玉,孙海,宋晓霞.农田栽参根区土壤酶活性与土壤养分的关系[J].吉林农业大学学报, 2010, 32(6): 661-665.
[ 8 ]程海涛,张亚玉,张连学,等.林下参不同生育期土壤养分变化的研究[J].中国农学通报, 2011, 27(8): 47-52.
[ 9 ] Ma J, Bu R C, Liu M, et al. Ecosystem carbon storage distribution between plant and soil in different forest types in Northeastern China[J]. Ecological Engineering, 2015, 253/254: 30-38.
[10] Li J, Zhao B Q, Li X Y, et al. Effects of long-term combined application of organic and mineral fertilizers on microbial biomass, soil enzyme activities and soil fertility[J]. Agricultural Sciences in China, 2008, 7(3): 336-343.
[11]张亚玉,孙海,高明,等.吉林省人参土壤中重金属污染水平及生物有效性研究[J].土壤学报, 2011, 48(60): 1306-1313.
[12]孙海,张亚玉,孙长伟,等.林下参土壤中重金属形态分布及生态风险评估[J].农业环境科学学报, 2014, 33(5): 928-934.
[13]孙海,张亚玉,孙长伟,等.不同生长模式下人参土壤养分状况与人参皂苷含量的关系[J].西北农业学报, 2012, 21(8): 146-152.
[14]鲍士旦.土壤农化分析[M].北京:中国农业出版社, 2005.
[15] White D C, Stair J O, Ringeberg D B. Quantitative comparisons of in situ microbial biodiversity by signature biomarker analysis[J]. Journal of Industry Microbiology, 1996, 17: 185-196.
[16] Frostegård Å, Bååth E, Tunlio A. Shifts in the structure of soil microbial communities in limed forests as revealed by phospholipid fatty acid analysis[J]. Soil Biology and Biochemistry, 1993, 25(6): 723-730.
[17] Wang C T, Wang G X, Wang Y, et al. Urea addition and litter manipulation alter plant community and soil microbial community composition in a Kobresia humilis meadow[J]. European Journal of Soil Biology, 2015, 70: 7-14.
[18] Frostegård Å, Bååth E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil[J]. Biology and Fertility of Soils, 1996, 22(1-2): 59-65.
[19] Bardgett R D, Lovell R D, Hobbs P J, et al. Seasonal changes in soil microbial communities along a fertility gradient of temperate grasslands[J]. Soil Biology and Biochemistry, 1999, 31(7): 1021-1030.
[20] White D C, Stair J O, Ringelberg D B. Quantitative comparisons ofin situ microbial biodiversity by signature biomarker analysis[J]. Journal of Industrial Microbiology, 1996, 17(3-4): 185-196.
[21] Zelles L. Identification of single cultured micro-organisms based on their whole-community fatty acid profiles, using an extended extraction procedure[J]. Chemosphere, 1999, 39(4): 665-682.
[22] Kieft T L, Ringelberg D B, White D C. Changes in ester-linked PLFA profiles of subsurface bacteria during starvation anddesiccation in a porous medium[J]. Applied and Environmental Microbiology, 1994, 60(9): 3292-3299.
[23] Fu X L, Yang F T, Wang J L, et al. Understory vegetation leads to changes in soil acidity and in microbial communities 27 years after reforestation[J]. Science of the Total Environment, 2015, 502 (1): 280-286.
[24] Yan F, McBratney A B, Copeland L. Functional substrate biodiversity of cultivated and uncultivated A horizons of vertisols in NW New South Wales[J]. Geoderma, 2000, 96(4): 321-333.
[25]王春阳,周建斌,董燕婕,等.黄土区六种植物凋落物与不同形态氮素对土壤微生物量碳氮含量的影响[J].生态学报, 2010, 30 (24): 7092-7100.
[26] Urbanová M,Šnajdr J, Baldrian P. Composition of fungal and bacterial communities in forest litter and soil is largely determined by dominant trees[J]. Soil Biology and Biochemistry, 2015, 84: 53-64.
[27] Innangi M, Schenk M K, Alessandro F D, et al. Field and microcosms decomposition dynamics of European beech leaf litter: Influence of climate, plant material and soil with focus on N and Mn[J]. Applied Soil Ecology, 2015, 93: 88-97.
[28] Caracciolo A B, Bustamante M A, Nogues I, et al. Changes in microbial community structure and functioning of a semiarid soil due to the use of anaerobic digestate derived composts and rosemary plants[J]. Geoderma, 2015, 245/246: 89-97.
[29]张鸿雁,薛泉宏,申光辉,等.放线菌制剂对人参生长及根域土壤微生物区系的影响[J].应用生态学报, 2013, 24(8): 2287-2293.
[30] Patzelt D J, Hodac L, Friedl T, et al. Biodiversity of soil cyanobacteria in the hyper-arid Atacama Desert, Chile[J]. Journal of Phycology, 2014, 50(4): 698-710
[31] Colica M, Li H, Rossi F, et al. Microbial secreted exopolysaccharides affect the hydrological behavior of induced biological soil crusts in desert sandy soils[J]. Soil Biology and Biochemistry, 2014, 68: 62-70.
Study on soil microbial community structure of different growth patterns in Panax ginseng/
SUN Hai, WANG Qiuxia, ZHANG Didi, LIU Ning, LI Le, XU Chenglu, ZHANG Yayu(Institute of Special Wild Economic Animal and Plant Science, Chinese Academy of Agricultural Sciences, Changchun 130112, China)
Abstract:To understand the effects of soil microbial community structure of different growth patterns (wild ginseng, understory wild ginseng and cultivated ginseng) in Panax ginseng. Soil microbial community structure were determined with phospholipid fatty acid analysis (PLFA) in our study. It was showed that total C and total N contents of wild ginseng soil were higher than that of understory wild ginseng and cultivated ginseng (P<0.05), especially the contents of total C and N, which were 10.30 and 4.61 times in the wild ginseng soil higher than in cultivated ginseng soil; the values of C/N ratio of wild ginseng and understory wild ginseng soil were higher than that of cultivated ginseng soil (P<0.05), while there was no significant difference between wild ginseng and understory wild ginseng soil; thebook=17,ebook=22value of total microbial biomass was highest (1 671.05 nmol·g-1) in wild ginseng soil and was lowest (266.80 nmol·g-1) in cultivated ginseng. The dominant microflora in the three growth patterns was all bacterias. However, the actinomycete was beneficial bacteria for ginseng growth, and the amount of actinomycete was 187.18, 26.12 and 6.77 nmol·g-1in wild ginseng, understory wild ginseng and cultivated ginseng, separately. The soil microbial biomass of 18:2ω6 and gram-negative bacteria/ gram-positive bacteria (G+/G-) were highest in wild ginseng, followed by understory wild ginseng and cultivated ginseng; the content of 18:2ω6 in wild ginseng was 3.51 times than that in understory wild ginseng, and no content in cultivated ginseng. The value of G+/G-in wild ginseng was 6.93 and 9.10 times higher than that in understory ginseng and cultivated ginseng, respectively. By comparison with the other two growth patterns, it was shown that there were highest total C and N contents, largest amount of microbial, highest abundance of species in wild ginseng soil. Cultivated ginseng soil could be changed the soil composition and microbial community structure by adding the microbial fertilizer in production practice.
Key words:Panax ginseng; microbial community structure; phospholipid fatty acid analysis; soil C/N
*通讯作者:张亚玉,研究员,研究方向为药用植物栽培。E-mail: zyy1966999@sina. com
作者简介:孙海(1983-),男,助理研究员,硕士,研究方向为药用植物营养生理。E-mail: caassh@126. com
基金项目:吉林省科技厅项目(20150204053NY)
收稿日期:2015-08-30
中图分类号:S154.1;S567.5+1
文献标志码:A
文章编号:1005-9369(2016)02-0016-08
