基于PVP改性的水合物抑制剂的合成与应用
2016-03-21申小冬武文志梁德青
张 倩,申小冬,武文志,梁德青,龙 臻
(1.中国科学院 天然气水合物重点实验室,广东 广州 510640;
2.广东省新能源和可再生能源研究开发与应用重点实验室,广东 广州 510640;
3.中国科学院 广州能源研究所,广东 广州 510640;4.中国科学院 研究生院,北京 100049)
基于PVP改性的水合物抑制剂的合成与应用
张 倩1,2,3,4,申小冬1,2,3,4,武文志1,2,3,4,梁德青1,2,3,龙 臻1,2,3
(1.中国科学院 天然气水合物重点实验室,广东 广州 510640;
2.广东省新能源和可再生能源研究开发与应用重点实验室,广东 广州 510640;
3.中国科学院 广州能源研究所,广东 广州 510640;4.中国科学院 研究生院,北京 100049)
在聚乙烯基吡络烷酮(PVP)的基础上合成了两种低剂量水合物动力学抑制剂羧基改性的聚乙烯基吡络烷酮(PVPCOOH)和氨基改性的聚乙烯基吡络烷酮(PVPNH2)。采用FTIR,13C NMR,XPS,GPC等方法对合成的PVPCOOH和PVPNH2进行表征。在蓝宝石高压定容反应釜中研究了PVPCOOH和PVPNH2对甲烷水合物生成过程的影响,并与动力学抑制剂PVP进行了比较;同时考察了PVPCOOH和PVPNH2含量和过冷度对其抑制效果的影响,并对PVPCOOH和PVPNH2的抑制机理进行了分析。表征结果显示,合成的两种物质PVPNH2和PVPCOOH分别为氨基改性的PVP和羧基改性的PVP;根据13C NMR谱图计算出PVPCOOH和PVPNH2的纯度均大于99%;PVPNH2,PVPCOOH,PVP三者的相对分子质量分布均较集中。实验结果表明,PVPCOOH和PVPNH2比PVP的水溶性好;PVPCOOH跟PVP的抑制效果相当,但PVPNH2比PVP的抑制效果差;PVPCOOH和PVPNH2的浓度对最大过冷度的测定无明显影响。
天然气水合物;动力学抑制剂;抑制机理;聚乙烯基吡络烷酮
天然气水合物是在高压低温条件下,由一些低沸点的烃类气体(如甲烷、乙烷、丙烷以及氢气、二氧化碳、氮气、硫化氢等)与水分子相互作用而形成的一种非化学计量的笼形络合物[1-4]。在一些油气输送管道及深海作业中由于满足高压低温条件,水合物较易生成,这会造成管道堵塞、油气开采设备失灵等安全事故。
通过添加水合物抑制剂可有效防止水合物的生成,水合物抑制剂包括热力学抑制剂和动力学抑制剂[5]。热力学抑制剂通常存在加入量大[6](含量(w)为10%~60%才能有理想的抑制效果)、成本高、污染环境等问题,正逐渐被淘汰。动力学抑制剂具有用量少[7](含量(w)为0.5%~2%即有较好的抑制效果)、适用范围广、成本低等优点。聚乙烯基吡络烷酮(PVP)是目前较为常用的一种水合物动力学抑制剂[8],但在使用过程中存在难溶解、高过冷度时失效等缺陷,又由于在聚合物分子中添加特殊基团对聚合物的各项性能有较大影响[9],因此可通过在PVP分子链末端添加一些亲水性的基团对其改性。
本工作在PVP的基础上合成了两种低剂量水合物动力学抑制剂羧基改性的聚乙烯基吡络烷酮(PVPCOOH)和氨基改性的聚乙烯基吡络烷酮(PVPNH2)。采用FTIR,13C NMR,XPS,GPC等方法对合成的PVPCOOH和PVPNH2进行表征。在蓝宝石高压定容反应釜中研究了PVPCOOH和PVPNH2对甲烷水合物生成过程的影响,并与动力学抑制剂PVP进行了比较;同时考察了PVPCOOH和PVPNH2含量和过冷度对抑制效果的影响,并对PVPCOOH和PVPNH2的抑制机理进行了分析。
1 实验部分
1.1 装置
生成水合物的装置主要包括蓝宝石高压定容反应釜、恒温空气浴、数据采集和显示模块、压力传 感器、温度传感器、摄像头等。实验装置见图1。

图1 生成水合物的装置Fig.1 Device for the formation of natural gas hydrates.V1-V3 Valves;T1,T2 Temperature sensors;P1,P2 Pressure sensors;BC Buffer cell;GC Gas cylinder;C Crystallizer;MS Magnetic stirrer;DAS Data acquisition system
1.2 原料与试剂
偶氮二异丁腈:纯度大于99.0%,美国Ark公司;1-乙烯基-2-吡络烷酮(NVP):纯度大于99.0%,日本Tci公司;聚N-乙烯基-2-吡络烷酮(PVP K90):纯度大于99.0%,日本东京化学工业股份有限公司;N,N-二甲酰胺(DMF)、乙酸乙酯:纯度大于99.0%,比利时Acros公司;1-丁胺、冰醋酸:纯度大于99.0%,英国Alfa公司。甲烷气体:纯度大于99.0%,广州市粤佳气体有限公司。水为实验室自制的蒸馏水。
1.3 合成方法
PVPNH2和PVPCOOH的合成:称取链引发剂176 mg偶氮二异丁腈,加入到装有温度计、冷凝管和N2导管的三口瓶中,密封后抽真空,在通入氮气3次;依次用注射器将11 mL NVP、280 μL链转移剂1-丁胺(合成PVPNH2)或冰醋酸(合成PVPCOOH)、50 mL DMF加入反应瓶中,再抽真空,并通入氮气3次;最后在氮气保护下置于80 ℃油浴中反应7 h。自然冷却后,倒产物于旋转蒸发器中95 ℃旋走大部分溶剂,冷却后再将其逐滴加到500 mL冷乙酸乙酯中沉淀出白色PVPNH2或PVPCOOH固体,抽滤后将沉淀物置于真空干燥箱中,45 ℃下干燥48 h,再于105 ℃下除水1 h,得到PVPNH2或PVPCOOH。
1.4 结构表征
采用布鲁克公司TENSOR27型傅里叶变换红外光谱仪对PVP,PVPNH2,PVPCOOH进行FTIR测试,溴化钾压片;采用布鲁克公司AVANCE Ⅲ型核磁共振仪对PVP,PVPNH2,PVPCOOH进行13C NMR测试,三甲基硅烷内标,D2O溶剂;采用Waters公司GPC-1515型凝胶色谱仪测定相对分子质量的分布,28 ℃,流量1 mL/min,聚苯乙烯标样,DMF溶剂;采用赛默飞公司ESCALAB 250Xi型X射线光电子能谱对PVPNH2和PVPCOOH进行XPS测试。
1.5 抑制性能的测定
抑制剂的作用效果可根据水合物的生成时间来量化[10]。反应釜内温度恒定为某一值(如4 ℃)后,通入8.0 MPa的甲烷气体,开动搅拌,计时开始。水合物诱导时间(亦称抑制时间)就是釜内通入气体,压力恒定为8.0 MPa,到压力开始骤降、温度开始骤升或者通过摄像头监控到有水合物生成所经历的时间,时间越长,抑制效果越好。
抑制剂的作用效果也可根据抑制剂所能承受的最大过冷度[11]测得。当反应釜内的温度为20 ℃时,通入压力为8.0 MPa的甲烷气体并开动搅拌,搅拌转速恒定为800 r/min(此状态下无法生成甲烷水合物),关闭气阀,然后以恒定的降温速率(如1 ℃/h)逐渐降温至指定温度(此温度低于甲烷水合物的生成温度)。在温降的过程中会有甲烷水合物生成,可通过压力骤降、温度骤升或者摄像头监控进行判断。水合物生成时检测到的温度即为此抑制剂所能承受的最大过冷度,能承受的最大过冷度越大则表示抑制剂的抑制效果越好。
2 结果与讨论
2.1 PVPNH2和PVPCOOH的结构表征
2.1.1 FTIR表征结果
图2为PVPCOOH,PVP K90,PVPNH2的 FTIR谱图。由图2可知,3种物质在1 680 cm-1处均出现了C==O吸收峰且在1 300 cm-1处均出现了C—N吸收峰,表明三者均具有PVP的基本结构[12]。但是PVPCOOH的谱图在3 500,3 000,1 680,1 250 cm-1处出现了明显的羧基特征吸收峰,PVPNH2的谱图中在3 700,2 890 ,900 cm-1处出现了明显的氨基吸收峰。

图2 PVPCOOH,PVP K90,PVPNH2的FTIR谱图Fig.2 FTIR spectra of PVPCOOH,PVP K90 and PVPNH2. PVPCOOH:carboxy-modified polyvinylpyrrolidone;PVP K90:poly-N-vinyl-2-pyrrolidone;PVPNH2:amino-modified polyvinylpyrrolidone.
2.1.213C NMR表征结果
图3为PVPCOOH,PVP K90,PVPNH2的13C NMR谱图。
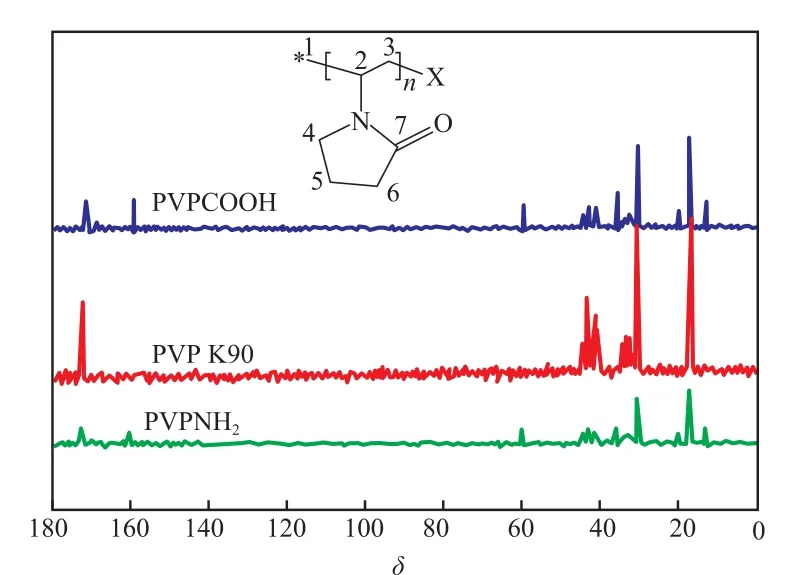
图3 PVPCOOH,PVP K90,PVPNH2的13C NMR谱图Fig.313C NMR spectra of PVPCOOH,PVP and PVPNH2.
由图3可知,3种物质的化学位移δ=31.20,34.75,35.27,42.50,44.38,44.67,177.13时分别对应位置6,4,2,3,5,7的碳原子吸收峰,表明三者均具有PVP的基本结构[13]。对比发现,PVPNH2的13C NMR谱图中δ=47.19处出现了对应于氨基相连的碳原子的吸收峰,δ=13.25处出现了对应于胺链上β位碳原子的吸收峰;PVPCOOH的13C NMR谱图中δ=177.35处出现了对应于羧酸中羰基碳的吸收峰,δ=20.52处出现了对应于 羧酸中α位碳原子的吸收峰。根据13C NMR谱图可计算出PVPCOOH和PVPNH2的纯度均大于99%。
2.1.3 XPS的表征结果
图4为PVPCOOH(C 1s)和PVPNH2(N 1s)的XPS曲线。由图4(a)可知,在结合能为288,286 eV处出现了峰,表明有结构为O—C==O形式的C,说明PVPCOOH中存在O—C==O结构[14]。由图4(b)可知,在结合能为400 eV处出现了峰,表明有结构为—C—NH2形式的N,说明PVPNH2中存在—C—NH2结构[15]。综上,合成的两种物质PVPNH2和PVPCOOH分别为氨基改性的PVP和羧基改性的PVP。

图4 PVPCOOH(C 1s)和PVPNH2(N 1s)的XPS曲线Fig.4 XPS spectra of PVPCOOH(C 1s) and PVPNH2(N 1s).
2.1.4 GPC的表征结果
Mw/Mn值愈大,相对分子质量分布愈宽;其值愈小,相对分子质量分布愈窄。表1为PVPNH2,PVPCOOH,PVP的GPC表征结果。由表1可知,PVPNH2,PVPCOOH,PVP三者的相对分子质量分布均较集中。
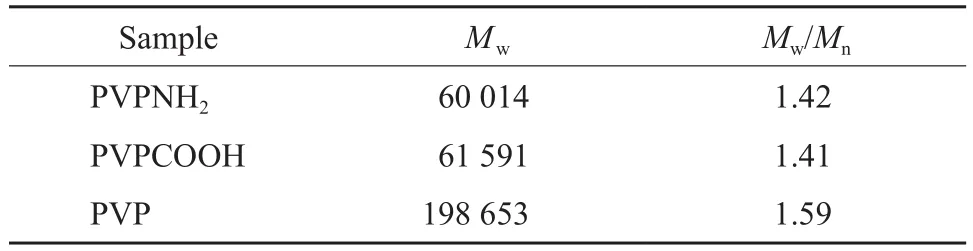
表1 PVPNH2,PVPCOOH,PVP的GPC表征结果Table 1 GPC results of PVPNH2,PVPCOOH and PVP
2.2 PVPNH2和PVPCOOH的抑制性能研究
图5为逐步冷却法测水合物生成的示例曲线。由图5可知,在水合物未生成前,反应釜内的温度、压力均以恒定的速率下降;当水合物生成时,压力会出现骤降,温度则会有相应地升高。水合物生成时的温度即为抑制剂所能承受的最大过冷度。
图6为恒定温度法测水合物生成的示例曲线。由图6可知,刚开动搅拌时压力有所下降、温度略有上升,这是由于部分甲烷溶于水。随后温压保持恒定,直到水合物生成时,压力会出现骤降,温度也会有相应地升高。水合物生成时的时间即为抑制剂的抑制时间。

图5 逐步冷却法测水合物生成的示例曲线Fig.5 Typical graphs for the hydrate formation through standard constant cooling test.Reaction condition:2.0%(w)PVPNH2.

图6 恒定温度法测水合物生成的示例曲线Fig.6 Typical graphs for the hydrate formation through standard constant temperature test.Reaction conditions:subcooling degree of 7 ℃,5.0%(w) PVPCOOH.
表2为逐步冷却法测定水合物生成的结果。8.0 MPa时,甲烷在纯水中与甲烷水合物共存的三相点温度为11 ℃[16],由表2可知,纯水中生成水合物的温度为7.0 ℃,过冷度为4.0 ℃(No.1);含2.0%(w)PVP K90的溶液的过冷度为7.3 ℃(No.5);含2.0%(w)PVPNH2的溶液的过冷度为4.9℃(No.19);含2.0%(w)PVPCOOH的溶液的过冷度为7.0 ℃(No.14)。所能承受最大过冷度的顺序为:PVP K90>PVPCOOH>PVPNH2>纯水。综上表明PVP K90,PVPCOOH,PVPNH23种抑制剂的抑制效果依次降低。由表2还可知,No.7,No.8,No.9,No.10,No.11是冷却速率分别为0.5,1.0,2.0,3.0,4.0 ℃/h时测得的0.1%(w)PVPCOOH溶液所能承受的最大过冷度。对比发现,在各个冷却速率条件下水合物的生成温度均为4.0℃左右,表明抑制剂的作用效果不受冷却速率的影响。No.8,No.12,No.13,No.14,No.15分别显示了0.1%(w)PVPCOOH,0.5%(w)PVPCOOH,1.0%(w)PVPCOOH,2.0%(w)PVPCOOH,5.0%(w)PVPCOOH能承受的最大过冷度为6.9,7.1,7.0,7.0,7.0 ℃;同样No.16~No.20显示5种不同浓度的PVPNH2能承受的最大过冷度均为5.0 ℃左右,表明浓度对同种抑制剂所能承受的最大过冷度无明显作用。作为对比实验的No.2,No.3,No.4,No.5,No.6分别显示了0.1%(w)PVP,0.5%(w)PVP,1.0%(w)PVP,2.0%(w)PVP,5.0%(w)PVP能承受的最大过冷度为6.0,5.9,7.9,7.3,7.3 ℃。说明浓度对PVP所能承受的最大过冷度有影响。其原因可能是因为—COOH和—NH2与水形成氢键,导致PVPCOOH和PVPNH2的抑制机理与PVP的有差异。具体原因有待进一步的研究。
图7为过冷度对PVPNH2和PVPCOOH抑制效果的影响。
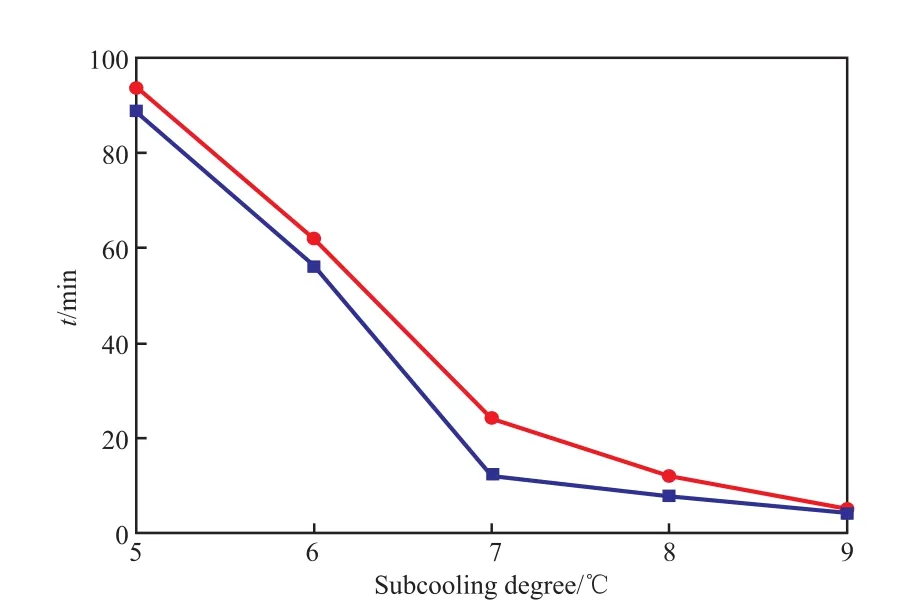
图7 过冷度对PVPNH2和PVPCOOH抑制效果的影响Fig.7 Influences of subcooling degree on the inhibition effects of PVPNH2and PVPCOOH.■ 5.0%(w)PVPNH2;● 5.0%(w)PVPCOOH
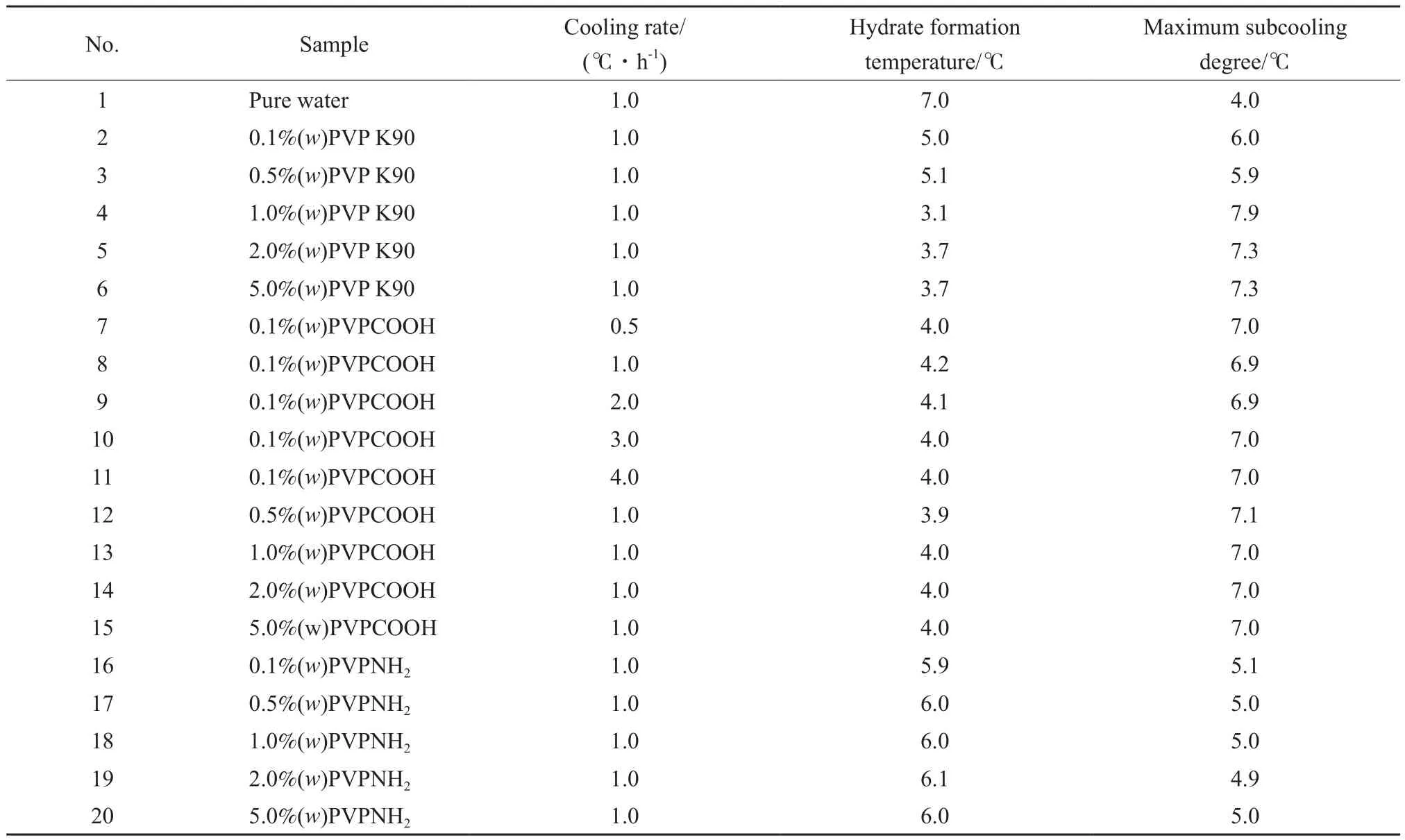
表2 逐步冷却法测定水合物生成的结果Table 2 Results of the constant cooling tests for the hydrate formatio
由图7可知,5.0%(w)PVPNH2溶液在过冷度为5,6,7,8,9 ℃时对应的压力骤降时间为89,56,12,8,4 min;5.0%(w)PVPCOOH溶液在过冷度为5,6,7,8,9 ℃时对应的压力骤降时间为94,62,24,12,5 min。数据表明,PVPNH2和PVPCOOH均随过冷度的增加抑制效果降低,且PVPNH2的抑制效果比PVPCOOH的抑制效果差。
图8为摄像头记录的水合物生成过程。

图8 水合物生成过程Fig.8 Formation process of the natural gas hydrates.a Without hydrate;b Beginning formation of hydrates;c Formation of a large amount of hydrates;d Complete formation of hydrates
2.3 抑制机理分析
水合物的生成过程主要包括成核、生长和聚集3个阶段[17]。目前关于抑制剂抑制水合物生成的机理存在多种假说,Höiland等[18-21]认为水合物笼子或者表面相互作用的抑制剂分子能够改变水合物颗粒的物理和化学性质,从而影响颗粒之间的黏附力,阻碍其聚集。颗粒表面的可润湿性是形成水合物堵塞的关键因素,亲油性水合物颗粒聚集风险小。图9为PVPK90,PVPNH2,PVPCOOH的分子结构,PVPNH2是在PVP主链上添加了氨基,PVPCOOH是在PVP主链上添加了羧基,氨基和羧基均为亲水基团,所以氨基改性和羧基改性的PVP亲水性较好,抑制效果变差。Kuznetsova等[22]认为水合物成核后动力学的因素占主导作用,由于抑制剂的水溶性能远远优于客体分子,抑制剂在水合物成核后在水分子和客体分子之间形成一层膜,使得客体分子与水分子之间的传质阻力增加而导致形成水合物困难。PVPNH2中氨基上的氮原子和PVPCOOH中羧基上的氧原子也可以与水形成氢键,从而使水分子和客体分子之间形成的膜不均匀,阻碍作用变弱,抑制效果变差,同时PVPNH2中添加的支链比PVPCOOH中添加的支链长(见图9)。

图9 PVP K90,PVPCOOH,PVPNH2的分子结构Fig.9 Molecular structures of PVP K90(a),PVPCOOH(b) and PVPNH2(c).
更加重了膜的不均匀性,因此PVPNH2比PVPCOOH的抑制效果差。Lederhos等[23]认为,PVP具有抑制水合物生成的功能是由于其分子结构中含有五元内酰胺环,环的大小与水合物笼形结构中的五面体相近,因此当这些环通过氢键吸附于水合物的晶粒上时,可以产生空间位阻并抑制水合物晶粒的生长。氨基和羧基与水形成氢键,使五元内酰胺环与水形成氢键吸附在水合物晶粒上的几率降低,从而使空间位阻作用减弱,抑制效果变差。
3 结论
1)合成的两种物质PVPNH2和PVPCOOH分别为氨基改性的PVP和羧基改性的PVP;根据13C NMR谱图计算出PVPCOOH和PVPNH2的纯度均大于99%;PVPNH2,PVPCOOH,PVP三者的相对分子质量分布均较集中。
2)PVPCOOH所能承受的最大过冷度为7.0℃,与PVP K90(能承受的最大过冷度为7.3 ℃)的抑制效果相差不大。PVPNH2所能承受的最大过冷度为4.9 ℃,比PVP K90的抑制效果差。但添加—COOH和—NH2后的PVP的水溶性优于PVP K90。
3)过冷度对PVPNH2和PVPCOOH溶液中水合物生成所需要的诱导时间影响较大,过冷度越大,诱导时间越短,水合物越易生成。
4)浓度对抑制剂PVPCOOH和PVPNH2所能承受的最大过冷度无明显影响。
[1] Takeya S,Uchida T,Kamata Y,et al. Lattice Expansion of clathrate hydrates of methane mixtures and natural gas[J]. Angew Chem Int Ed,2005,44(42):6928-6931.
[2] Hester K C,Huo Z,Ballard A L,et al. Thermal expansivity for SⅠ and SⅡ clathrate hydrates[J]. J Phys Chem,2006,111(30):8830-8835.
[3] Sloan E D. Fundamental principles and applications of natural gas hydrates[J]. Nature,2003,426(6964):353-363.
[4] Strobel T A,Koh C A,Sloan E D. Thermodynamic predictions of various tetrahydrofuran and hydrogen clathrate hydrates[J]. Fluid Phase Equilib,2009,280(1/2):61-67.
[5] Zhang J S,Lee Sangyang,Lee Jae W. Kinetics of methane hydrate formation from SDS solution[J]. Ind Eng Chem Res,2007,46(19):6353-6359.
[6] Tavasoli H,Feyzi F,Dehghani M R,et al. Prediction of gas hydrate formation condition in the presence of thermodynamic inhibitors with the elliott-suresh-donohue equation of state[J]. J Pet Sci Eng,2011,77(1):93-103.
[7] 许维秀,李其京,陈光进. 天然气水合物抑制剂研究进展[J]. 化工进展,2006,25(11):1289-1300.
[8] A Kelland. History of the development of low dosage hydrate inhibitors malcolm[J]. Energy Fuels,2006,20(3):826-847.
[9] Bjørn K,Tatyana K,Kjetil A. Molecular dynamics simulations for selection of kinetic hydrate inhibitors[J]. J Mol Graphics Modell,2005,23(6):524-536.
[10] Sun Minwei,Firoozabadi A. New surfactant for hydrate antiagglomeration in hydrocarbon flowlines and seabed oil capture[J]. Chem Eng J,2013,402(7):312-319.
[11] Malcolm A K,Eirin A,Hiroharu A,et al. Kinetic hydrate inhibition with N-alkyl-N-vinylformamide polymers:Comparison of polymers to n-propyl and isopropyl groups[J]. Energy Fuels,2015,29(8):4941-4946.
[12] Qin Huibo,Sun Zhenfeng,Wang Xiaoqin,et al. Synthesis and evaluation of two new kinetic hydrate inhibitors[J]. Energy Fuels,2015,29(11):7135-7141.
[13] Ranucci E,Ferruti P,Annunziata R,et al. NMR spectroscopy and MALDI-TOF MS characterisation of end-functionalised PVP oligomers prepared with different esters as chain transfer agents[J]. Macromol Biosci,2006,6(3):216-227.
[14] 徐秀峰,张蓬洲. 用XPS表征氧、氮、硫元素的存在形态[J]. 煤炭转化,1996,19(1):73-77.
[15] Guo Hongxu,Wang Dongfang,Chen Jianhua,et al. Simple fabrication of flake-like NH2-MIL-53(Cr) and its application as an electrochemical sensor for the detection of Pb2+[J]. Chem Eng J,2016,289 (4):479-485.
[16] Nakamura T,Makino T,Sugahara T,et al. Stability boundaries of gas hydrates helped by methane-structure-H hydrates of methylcyclohexane and cis-1,2-dimethylcyclohexane[J]. Chem Eng Sci,2003,58(2):269-273.
[17] Duchateau C,Peytavy J L,Glenat P,et al. Laboratory evaluation of kinetic hydrate inhibitors:A procedure for enhancing the repeatability of test results[J]. Energy Fuels,2009,23(1):962-966.
[18] Höiland S,Askvik K M,Fotland P,et al. Wettability of freon hydrates in crude oil/brine emulsions[J]. J Colloid Interface Sci,2005,278(1):217-225.
[19] Aspenes G,Dieker L E,Aman Z M,et al. Adhesion force between cyclopentane hydrates and solid surface materials[J]. J Colloid Interface Sci,2010,343(2):529-536 .
[20] Aspenes G,Höiland S,Barth T,et al. The influence of petroleum acids and solid surface energy on pipeline wettability in relation to hydrate deposition[J]. J Colloid Interface Sci,2009,333(2):533-539 .
[21] Erstad K,Höiland S,Fotland,et al. Influence of petroleum acids on gas hydrate wettability[J]. Energy Fuels,2009,23(4):2213-2219 .
[22] Kuznetsova T,Sapronova A,Kvamme B,et al. Impact of lowdosage inhibitors on clathrate hydrate stability[J]. Macromol Symp,2010,287(4):168-176.
[23] Lederhos J P,Long J P,Sum A,et al. Effective kinetic inhibitors for natural gas hydrates[J]. Chem Eng Sci,1996,51(8):1221-1229.
(编辑 杨天予)
Synthesis and application of modified natural gas hydrate kinetic inhibitors based on PVP
Zhang Qian1,2,3,4,Shen Xiaodong1,2,3,4,Wu Wenzhi1,2,3,4,Liang Deqing1,2,3,Long Zhen1,2,3
(1. Key Laboratory of Natural Gas Hydrate,Chinese Academy of Sciences,Guangzhou Guangdong 510640,China;
2. Guangdong Key Laboratory of New and Renewable Energy Research and Development,Guangzhou Guangdong 510640,China;
3. Guangzhou Institute of Energy Conversion,Chinese Academy of Sciences,Guangzhou Guangdong 510640,China;
4. Graduate University of Chinese Academy of Sciences,Beijing 100049,China)
Based on polyvinylpyrrolidone(PVP),two low-dosage kinetic inhibitors for the formation of natural gas hydrates,namely carboxy-modified polyvinylpyrrolidone(PVPCOOH) and aminomodified polyvinylpyrrolidone(PVPNH2),were synthesized and characterized by FTIR,13C NMR,XPS and GPC. The influences of their concentrations and subcooling on the hydrate formation were investigated in a high-pressure sapphire reactor,and compared with the kinetic inhibitor PVP. The results showed that the purities of both PVPCOOH and PVPNH2reached more than 99% and the relative molecular mass distributions of PVP,PVPCOOH and PVPNH2were concentrated. The experimental results indicated that the solubility of both PVPCOOH and PVPNH2in water was higher than that of PVP. The inhibition effect of PVPCOOH to the formation of natural gas hydrates was similar to that of PVP,but the inhibition effect of PVPNH2was worse. The influence of the concentrations of PVPCOOH and PVPNH2on the determination of the subcooling was little. The inhibition mechanisms of PVPCOOH and PVPNH2were analyzed based on the experimental results.
natural gas hydrate;kinetic inhibitor;inhitition mechanism;polyvinyl pyrrolido ne
1000-8144(2016)12-1506-07
TQ 317
A
10.3969/j.issn.1000-8144.2016.12.015
2016-05-26;[修改稿日期]2016-08-27。
张倩(1991—),女,湖南省邵阳市人,硕士生,电话 020-87057705,电邮 zhangqian1@ms.giec.ac.cn。联系人:梁德青,电话 020-87057669,电邮 liangdq@ms.giec.ac.cn。
国家自然科学基金资助项目(51506202);中国石油-中国科学院科技合作项目(2015A-4813)。
