无水保活条件下团头鲂生理应激及鱼肉品质的变化
2016-03-21董韩博张新林
刘 骁,谢 晶,杨 茜,董韩博,张新林
(上海水产品加工及贮藏工程技术研究中心,上海海洋大学食品学院,上海201306)
无水保活条件下团头鲂生理应激及鱼肉品质的变化
刘骁,谢晶※,杨茜,董韩博,张新林
(上海水产品加工及贮藏工程技术研究中心,上海海洋大学食品学院,上海201306)
摘要:为探讨无水保活对团头鲂生理应激和肌肉品质的影响,该文研究了团头鲂无水保活所需的较佳条件,测定了未处理(对照)、无水和恢复3种状态下团头鲂的血液生化以及鱼肉成分、持水力、新鲜度、质构和游离氨基酸等品质指标。结果表明:团头鲂无水保活的较佳生活水温为(14.8±0.2)℃(冬季),以2℃ /h降至休眠温度2℃,充氧包装后在2℃无水保活14 h,在当季暂养水温中((14.8±0.2)℃)恢复24 h后存活率为100%;无水保活14 h后,血液中皮质醇和乳酸浓度、谷草转氨酶和谷丙转氨酶活力显著高于未处理(对照)(P<0.05),血糖浓度和碱性磷酸酶活性明显低于未处理值(P<0.05),当季暂养水温恢复24 h后,基本都恢复至未处理组值,但谷草转氨酶仍明显高于未处理组值(P<0.05);低温无水环境对团头鲂鱼肉中蛋白质和脂肪含量、新鲜度和持水力无影响,但鱼肉的硬度和咀嚼性明显下降(P<0.05),鱼肉游离氨基酸中丝氨酸(Ser)、谷氨酸(Glu)、甘氨酸(Gly)、缬氨酸(Val)和精氨酸(Arg)等含量显著升高(P<0.05),异亮氨酸(Ile)、亮氨酸(Leu)、酪氨酸(Tyr)和苯丙氨酸(Phe)在无水保活过程中无明显变化,当季暂养水温恢复后却显著高于未处理组水平(P<0.05)。因此,团头鲂无水保活中产生的应激反应在恢复24 h后基本消除,且无水保活对鱼肉的食用品质影响较小。该研究结果为无水保活在淡水鱼活鱼运输中的应用提供参考。
关键词:品质控制;温度;鱼;团头鲂;无水保活;生理应激
刘骁,谢晶,杨茜,董韩博,张新林.无水保活条件下团头鲂生理应激及鱼肉品质的变化[J]. 农业工程学报,2016,32(3):295-300.doi:10.11975/j.issn.1002-6819.2016.03.042http://www.tcsae.org
Liu Xiao, Xie Jing, Yang Xi, Dong Hanbo, Zhang Xinlin. Change of physiological stress and flesh quality of Megalobrama amblycephala during suitable waterless keep alive conditions[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(3): 295-300. (in Chinese with English abstract)doi:10.11975/j.issn.1002-6819.2016.03.042 http://www.tcsae.org
0 引 言
团头鲂(Megalobrama amblycephala)属鲤形目,鲤科中的鲂属,俗称武昌鱼。该鱼食性广、饲养周期短且肉质鲜美、营养丰富,被作为优良的草食性鱼类品种在全国普遍推广,是中国最主要的淡水养殖品种之一。笔者对上海地区的调研结果表明,团头鲂进入市场的方式以鲜活为主,死后其经济价值丧失过半,因此团头鲂的保活运输尤为重要。
目前淡水活鱼流通方式以有水运输为主,运输过程中可根据季节、生长阶段和距离的长短,采用改善水质[1]、增加溶氧量[2]、适当降低水温[3]和改变盐度[4]等方法提高运输质量。应激是生命体为适应生存环境所出现的全身性非特异性反应,但由于商业成本以及流通环节(捕捞、暂养、运输、装卸、分销)等会导致鱼体在流通过程中出现有害应激,对机体造成损伤甚至死亡,变相增加成本[5]。相关调研分析表明,中国大宗淡水鱼在流通过程中的损耗成本约占总成本的10%,为发达国家的20倍[6]。近年来,根据水产品变温的生理特性,衍生出的无水保活,因其具有运输量大、物理损伤小等优点成为研究热点。
无水保活是通过生态冰温或麻醉剂使水产品进入休眠状态,然后在无水或雾态的低温状态下进行活体贮存。Zeng等[7]研究表明鲫鱼以1℃/h速率降温至0℃无水保活,时间可达24 h,并且发现低温驯化过程可以促进鲫鱼在无水低氧环境下厌氧代谢,从而减小血液中的氧化反应以达到无水保活的目的。Jamie等[8]通过检测不同暂养环境、降温速率、麻醉剂和包装方式下南美白对虾的血液生理变化及存活率,优化出最佳条件使南美白对虾在无水状态下存活36 h,恢复24 h后的存活率可以达到96%。白艳龙等[9]将黄颡鱼生存温度以3~4℃/h降至2℃休眠后,用湿透的纱布包裹装入纯氧的包装袋中可无水保活24 h。然而,不同水产品休眠温度不同,即使相同品种在不同季节无水保活条件也存在差异,而且目前常用的麻醉剂存在安全隐患。因此,本文探索了团头鲂无水保活所需的较佳条件,并分析了无水保活对团头鲂应激指标和鱼肉品质的影响,为研究淡水鱼的无水保活提供理论基础。
1 材料与方法
1.1材料与试剂
材料:团头鲂购自上海果园农贸市场,选取大小规格相近的团头鲂为试验对象,平均体质量为(548.15±46.26)g,体长(32.46±1.89)cm,为消除运输应激在实验室蓄养池中暂养10d,试验前禁食1 d。
试剂:轻质氧化镁,盐酸,硼酸,溴甲酚绿-甲基红,三氯乙酸,硫代巴比妥酸(TBA)溶液,硫酸铜,硫酸钾,浓硫酸,氢氧化钠。所用试剂均为分析纯,并购自国药集团化学试剂有限公司。
1.2仪器与设备
迈瑞BS-200全自动生化分析仪,深圳迈瑞生物医疗有限股份有限公司;SH-1000Lab-全波长酶标仪,北京宏昌信科技有限公司;5810R高速冷冻离心机,上海艾测电子科技有限公司;Kjeltec8400型全自动凯氏定氮仪,丹麦FOSS公司;Soxtec2050型全自动索氏抽提系统,丹麦FOSS公司;TA.XT Plus 型质构仪,英国SMS公司;全自动循环冷水机广东海利集团;HITACHI8800型氨基酸自动分析仪,日本日立公司。F2640 型多点温度采集仪,美国Fluke公司。
1.3试验方法
1.3.1团头鲂无水保活较佳条件的确定
本试验是通过物理降温的方式诱导团头鲂休眠,以达到无水保活的目的。试验共分为4批,分别在2014年11月,2015年1月、5月和8月即秋冬春夏4个季节进行。每批试验分3组,2组重复,1组验证(100%存活率的条件),每组10条鱼。试验当天,将10条团头鲂放于装有100L水的塑料箱中,使用循环冷水机以2℃/h降温(3℃以下使用−20℃的蓄冷剂),当温度降低到某一点时所有样品出现呼吸缓慢(≤12次/min)、侧翻或静止不动、刺激后基本不动或非常迟缓等现象,此时温度为休眠温度[9-10],然后装入木屑(休眠温度下浸泡1 h后沥干)铺垫的塑料袋(长×宽,120 cm×90 cm)中充氧(80%)包装放于休眠温度下无水保活,一段时间后将休眠中的团头鲂先转移至10℃水中恢复1 h苏醒后,再转移至当季暂养水温中,观察随时间延长其在当季暂养水温恢复24 h后的存活率变化,从而确定团头鲂无水保活的最佳季节、保活温度和时间。本试验所测水温均使用多点温度采集仪进行测量,数据采集间隔为2h。

1.3.2取样方法
本试验以较佳季节的最长无水保活时间和此季节暂养水温中恢复24 h后的团头鲂为试验组,此季节未处理暂养状态下的团头鲂为对照组,每组10条。每条经200 mg/L MS-222的麻醉液致死麻醉后,用注射器尾部静脉取血,血液在4℃下静置2 h后,以4℃、4 000 r/min离心10 min制备血清,−80℃冻存备用。鱼体采血后,取背部肌肉(去鱼皮)用于鱼肉品质分析。
1.4指标测定
1.4.1血液指标
皮质醇(cortisol,COR)浓度测定,采用酶联免疫法[11],试剂盒购自上海邦奕生物科技公司;乳酸采用比色法进行测定[7],试剂盒购自南京建成生物工程研究所;谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate transaminase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、葡萄糖(glucose,Glu)等酶活力和浓度测定[12],在BS-200全自动生化分析仪使用对应试剂盒进行检测。
1.4.2鱼肉品质指标
持水力:参考李念文等[13]方法进行测定;取5 g鱼肉块(M),用滤纸包裹后放于离心管中,在5 000 r/min下离心6 min,沥干表面水分称量(m,g),重复3次,取平均值。
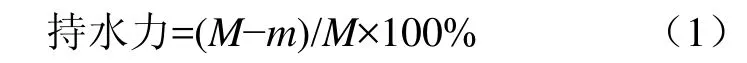
总蛋白:按照GB/T 5009.5-2010[14]中的凯氏定氮法进行测定;准确称取2 g样品移入消化管中,加入0.2 g硫酸铜、6 g硫酸钾及20 mL浓硫酸后加热直至液体呈蓝绿色并澄清透明后,再继续加热0.5~1 h。取下放冷后上机操作。
粗脂肪:根据GB/T 14772-2008[15]中的索氏抽提法进行测定;准确称取5 g样品(M1)和底瓶质量(m1),将样品用滤纸包裹装入底瓶中上机提取,提取后将底瓶在103℃干燥箱中干燥1 h,取出置于干燥器内冷却至室温,称量(m2)。
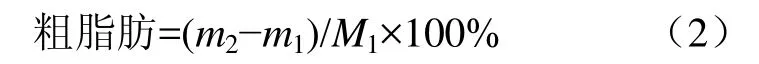
挥发性盐基氮(TVB-N):参照SC/T 3032-2007[16]进行测定;将2 g鱼肉放于消化管中,加入0.5 g MgO后上机操作,其中用0.1 mol/L的HCl滴定,吸收液为40 g/L 的H3BO3。
硫代巴比妥酸值(TBA):根据Li等[17]TBA测定方法;准确称取5 g碎肉置于烧杯中,加入25 mL 20%三氯乙酸溶液和10 mL蒸馏水后匀浆60s,再静置1 h后过滤,滤液用蒸馏水定容至50 mL,取其中5 mL加入5 mL 0.02 mol/L硫代巴比妥酸溶液,沸水浴20 min,取出冷却5 min后在532 nm处测吸光度值A,标准曲线所测常数为7.8。

质构:参照方静等[18]方法略作修改,将鱼肉切成1.5 cm×1.5 cm×1 cm规格,探头类型为P50,测试前速度为2 mm/s,测试速度为1 mm/s,测试后速度为5 mm/s,测定间隔时间为5 s,压缩比为50%;每组每条鱼取背部肌肉3块,每块重复测量3次,取平均值。
游离氨基酸:参照邓捷春等[19]方法略作改动,准确称取样品5.00 g,加入15 mL蒸馏水后均质,以10 000 r/min离心10 min,取9 mL上清液,加入1 mL 50%三氯乙酸,用0.5 mol/L NaOH调pH值至 2.0,0.45 μm微孔过滤后氨基酸自动析仪检测。
1.5数据统计分析
数据使用Excel软件进行整理,使用SPSS17.0软件进行差异性分析,同一系列不同字母表示差异显著(P<0.05)。
2 结果与分析
2.1团头鲂无水保活较佳条件的确定
不同季节的团头鲂无水条件下存活所需要的温度、保活时间与存活率见表1。本试验发现,夏季的团头鲂不适宜无水保活,无水保活3h存活率仅为70%,这可能是因为夏季温度偏高,团头鲂对低温的耐受程度较低;由于春秋季节暂养水温和休眠温度相近,团头鲂低温驯化过程也相近,因此无水保活效果也相近,无水保活5 h,存活率可达100%,可适宜较短距离的保活运输;由于冬季温度较低,团头鲂更能适应低温环境,因此冬季是团头鲂无水保活的最佳季节,而且无水保活时间可延长至14 h,存活率可达100%。
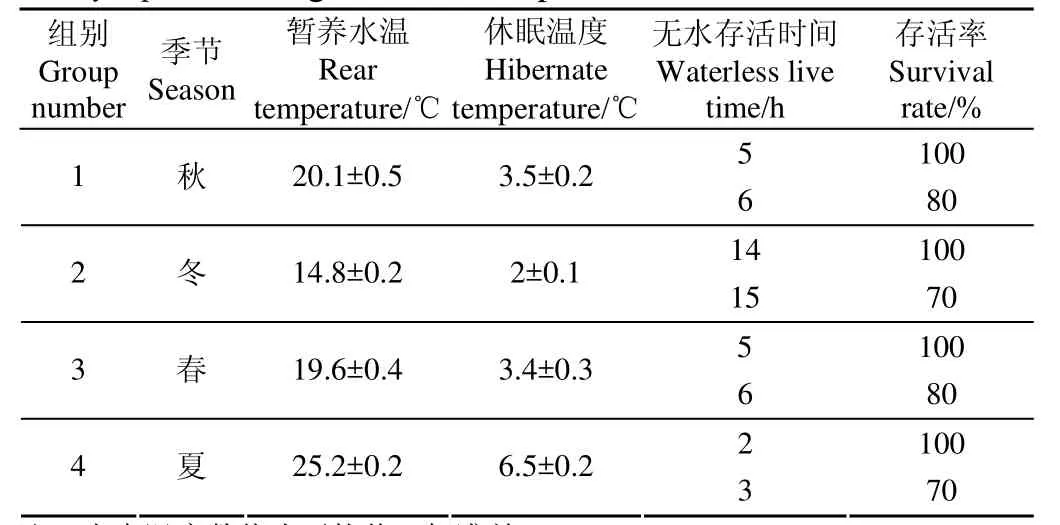
表1 团头鲂在不同季节下无水保活的温度、时间与存活率Table 1 Temperature, time and survival rate of Megalobrama amblycephaladuring waterless keep alive under the different season
2.2无水保活对团头鲂血液生化指标的影响
鱼类生理和病理的变化通常引起血液成分的改变,因此血液生化指标是反映动物应激程度的重要指标[16]。无水保活对团头鲂血液生化指标的影响见表2。
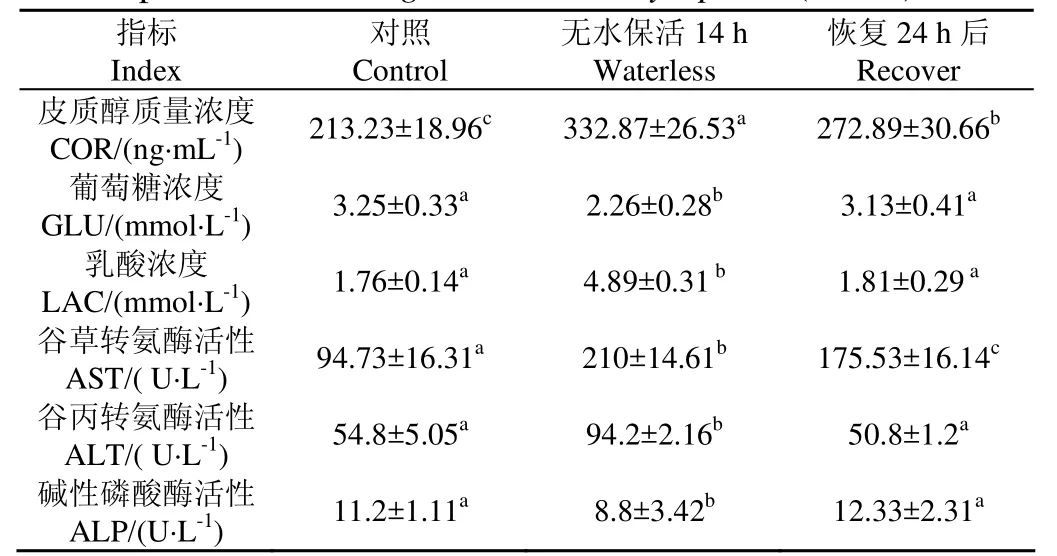
表2 无水保活对团头鲂血液生化指标的影响(冬季)Table 2 Effect of waterless keep alive on blood biochemical parameters of Megalobrama amblycephala (winter)
动物受到应激源刺激后,首先是产生由神经内分泌系统介导的初级反应,下丘脑-垂体-肾上腺轴迅速被激活,促使肾上腺皮质激素COR的合成和释放增加,从而造成血液中COR浓度升高,因此血液中COR的浓度是衡量动物应激程度的首选指标[20]。本研究中团头鲂经过无水保活14 h后,血液中COR浓度与未处理状态下相比显著升高(P<0.05),经过24 h当季暂养水温(14.8±0.2℃)恢复后皮质醇浓度明显下降(P<0.05),这表明团头鲂在低温无水保活过程中做出了应激响应,促使机体应对环境变化以免受伤害,到当季暂养水温中恢复后应激反应有所缓解,Mi[21]研究发现鲫鱼经丁香酚麻醉无水保活后,血液中COR浓度明显增加,这与本试验结果相一致。但恢复后的团头鲂体内COR浓度明显高于对照状态(P<0.05),表明应激反应没有完全恢复,这可能是因为恢复24 h不能使团头鲂在休眠过程中产生的应激响应完全解除,需更长恢复时间。
血糖和乳酸是反映生物体能量代谢的重要指标。本试验中团头鲂无水保活后葡萄糖浓度显著低于未处理状态(P<0.05),原因可能是鱼类适应低温环境初期,体内糖原转化为葡萄糖,产生能量以抵御寒冷,但随着胁迫时间延长,血糖会继续分解为三磷酸腺苷(ATP),为机体提供能量,从而导致血糖降低[22],也可能是团头鲂在无水保活中处于休眠状态,体内新陈代谢速率降低,能量消耗较少;恢复后鱼体血糖浓度与对照并无差异(P>0.05),表明团头鲂经过24 h的恢复可以使血糖回复到未处理组水平。本研究发现团头鲂在低温无水状态下,血液中乳酸含量明显高于未处理状态(P<0.05),表明此时机体内无氧代谢升高,当季暂养水温恢复后回到未处理水平,有研究表明[23],低温驯化或冷应激会使鱼类血液中乳酸含量升高。因此表明团头鲂在无水保活过程中有氧代谢逐渐降低,而随着保活时间的延长无氧呼吸不断增加。
AST、ALT是鱼类重要的转氨酶,主要存在于肝脏中,当肝细胞受损时,AST和ALT会被释放到血液中,因此血清中AST和ALT活力的增加被认为是肝功能损伤最具特异性和广泛使用的指标[24]。由表2可知,团头鲂休眠14 h后,AST和ALT的活性显著升高(P<0.05),表明低温无水环境对团头鲂的肝脏造成损伤,恢复后血液中AST和ALT的活性明显下降(P<0.05),经过当季暂养水温中恢复24 h后得到一定修复;但恢复后的AST活性明显高于未处理水平(P<0.05),这可能是由于长时间的低温无水环境,机体代谢逐渐以无氧呼吸为主,体内抗氧化系统出现问题,导致团头鲂肝脏造成不可修复的损伤,这可能也是团头鲂不能长时间无水保活的主要原因之一,具体原因需进一步研究。王美垚等[25]研究发现吉富罗非鱼30 min内将水温从25℃将至9℃,在9℃冷应激12 h后,鱼体血液中的AST和ALT急剧上升,当季暂养水温中恢复24 h后ALT回复至未处理组水平,但AST仍显著高于未处理组值,这与本试验结果相一致。
ALP可直接参与鱼体中磷酸基团的转移及钙磷代谢,还能够改变病原体的表面结构以增强机体对病原体的识别和吞噬能力,因而在鱼体内的物质代谢和免疫防护中起重要作用[26]。本研究发现团头鲂无水保活后血液中ALP活力明显下降(P<0.05),表明低温无水环境会导致鱼类机体代谢活动下降或免疫能力降低;24 h当季暂养水温恢复后,血液ALP活性回升到未处理组水平,表明鱼体恢复了正常的代谢和免疫能力。
2.3无水保活对团头鲂鱼肉品质的影响
表3为无水保活对团头鲂肌肉粗脂肪和总蛋白含量、保水性、新鲜度和质构的影响。团头鲂经过无水保活后肌肉中的总蛋白和脂肪含量并无明显化(P>0.05),表明团头鲂在低温无水状态下肌肉主要成分不会发生改变;团头鲂在未处理、无水和恢复状态下的肌肉持水力无明显变化(P>0.05),持水力是指肌肉保持水的能力,主要与蛋白质三位网状结构和变性程度相关[27],表明低温无水状态不会破环团头鲂肌肉中蛋白质网状结构,同时不会使蛋白降解。
TVB-N是评价鱼类新鲜度的重要指标,而TBA是评价鱼类脂肪氧化程度的指标。本试验中未处理、无水和当季暂养水温中恢复状态下TVB-N和TBA并无明显变化(P>0.05),说明在低温无水环境对团头鲂肌肉鲜度无影响,且不会导致鱼肉中的脂肪氧化,表明3种状态下的鱼类新鲜程度相一致,均可以安全食用;Mi等[21]研究发现鲫鱼在丁香酚麻醉后低温无水保活38 h会导致肌肉中TVB-N和TBA值明显升高,这可能是由于使用麻醉剂休眠后长时间无水保活所致。
质构是衡量鱼肉组织特性变化的一项重要指标,是体现鱼肉质量的重要指标[28]。本试验主要考察的质构参数为硬度、咀嚼性和弹性。由表3可知团头鲂无水保活后鱼肉的硬度和咀嚼性明显下降(P>0.05),口感有所下降,当季暂养水温中恢复后不能回到未处理组水平,这可能是由于鱼体温度降低,肌肉活动受到限制所致,也可能是因为团头鲂低温驯化初期需要大量的能量,肌肉中糖原分解为葡萄糖,葡萄糖继续分解为水和二氧化碳,使得肌肉中水分增加,而有研究发现[29]鱼肉中含水率越高,鱼肉的硬度和咀嚼性越低;此外有研究表明[30]冬季的团头鲂肌肉硬度和咀嚼性明显低于春季。
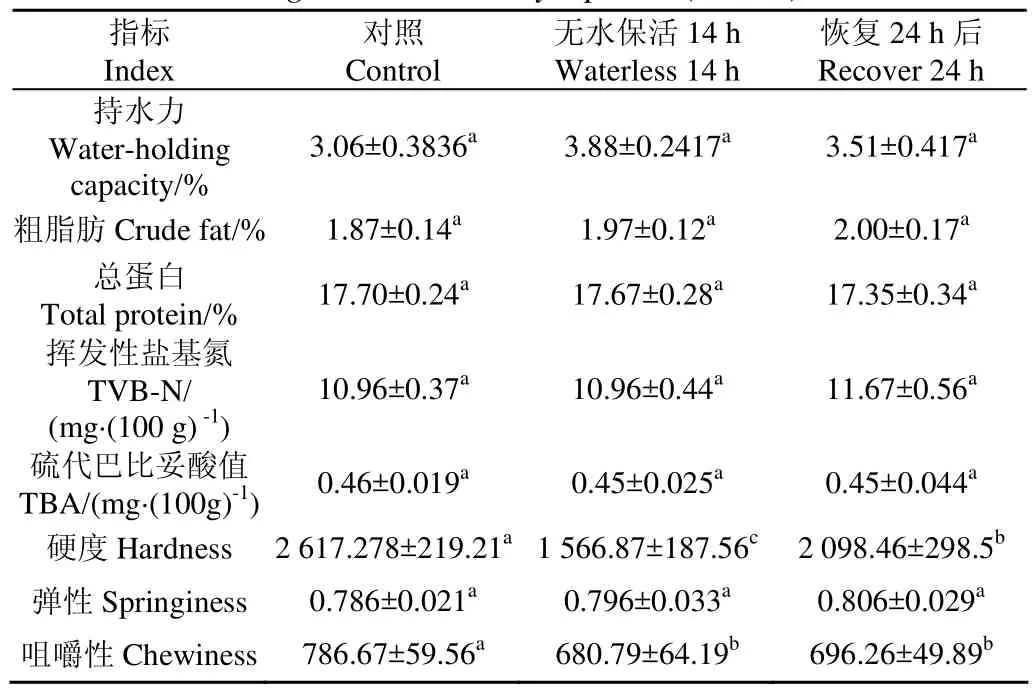
表3 无水保活对团头鲂鱼肉品质的影响(冬季)Table 3 Effect of waterless keep alive on fish quality of Megalobrama amblycephala (winter)
无水保活对团头鲂游离氨基酸的影响见表4。本研究发现团头鲂在无水保活过程中肌肉中的Ser、Glu、Gly、 Val和Arg等含量显著升高(P<0.05),除Glu外其他含量当季暂养水温中恢复后基本都回到未处理组水平;Lys在无水保活过程中显著下降(P<0.05),当季暂养水温中恢复又明显升高(P<0.05),显著高于未处理组水平(P<0.05),而His与之刚好相反,当季暂养水温中恢复后显著低于未处理组水平(P<0.05);Ile、Leu、Tyr和Phe在无水保活过程中无明显变化,当季暂养水温中恢复后明显升高(P<0.05)。Zeng等[7]研究发现鲫鱼在低温无水保活过程肌肉中Val、Leu和His含量明显升高,Lys明显下降。Driedzic等[31]研究发现香鱼体内会通过积累甘油以抵御冷应激,游离氨基酸会作为甘油合成的碳源之一。因此,团头鲂在无水保活和当季暂养水温中恢复过程中肌肉游离氨基酸的变化,可能是鱼体为抵御低温和重新适应正常环境体内的正常代谢活动所致,此推测需进一步证实。此外,由于Glu和Gly等呈味氨基酸的增加,无水保活14 h后团头鲂鱼肉口味可能会更加美味;恢复24 h后由于Leu、Ile和Phe等必需氨基酸的增加,可能会使氨基酸配比合理,营养价值更好。

表4 无水保活对团头鲂鱼肉中游离氨基酸含量的影响(冬季)Table 4 Effect of waterless keep alive on fish free amino acid of Megalobrama amblycephala (winter) mmol·g-1
3 结 论
冬季的团头鲂最适宜无水保活,将团头鲂暂养水温以2℃/h降至2℃休眠后,装入木屑铺垫的袋中充氧包装,无水保活14 h后,将团头鲂先移入10℃的水中恢复苏醒1 h后,再转入当季暂养水温中(14.8±0.2℃)恢复24 h后存活率可达100%。
在低温无水环境中,团头鲂血液中皮质醇和乳酸浓度、谷草转氨酶和谷丙转氨酶活力与对照组相比明显升高(P<0.05),而葡萄糖浓度和碱性磷酸酶活力明显下降(P<0.05),当季暂养水温中恢复后基本都回到未处理组状态,但谷草转氨酶(AST)活性依然显著高于未处理组水平(P<0.05),表明无水保活会对团头鲂肝脏造成永久性损伤;无水保活14 h后鱼肉的肌肉组分和新鲜程度并无明显变化(P>0.05),但鱼肉的硬度和咀嚼性明显下降(P<0.05)。此外鱼肉中一些游离氨基酸含量产生明显变化,如无水保活14 h后丝氨酸、谷氨酸、甘氨酸、缬氨酸和精氨酸等含量与对照组相比显著升高(P<0.05),赖氨酸在无水保活过程中显著下降(P<0.05),而当季暂养水温中恢复24 h后,谷氨酸、赖氨酸、异亮氨酸、亮氨酸、酪氨酸以及苯丙氨酸含量明显高于对照组(P<0.05),组氨酸(His)却显著低于对照组(P<0.05)。
鱼类在无水保活过程中的应激反应是系统的、复杂的,可通过研究鱼类在此过程中体内抗氧化系统和免疫功能的变化,更加深入地了解无水保活对鱼类健康状况的影响,并进一步阐释鱼体的死亡原因。
[参考文献]
[1] Iwama G W, Pickering A D, Sumpter J P, et al. Fish Stress and Health in Aquaculture[M]. Cambridge University Press, 2011: 35-72.
[2] Heery K. Fish transport in the aquaculture sector: An overview of the road transport of Atlantic salmon in Tasmania[J]. Journal of Veterinary Behavior: Clinical Applications and Research, 2009, 4(4): 163-168.
[3] Golombieski J I, Silva L V F, Baldisserotto B, et al. Transport of silver catfish (Rhamdiaquelen) fingerlings at different times, load densities, and temperatures[J]. Aquaculture, 2003, 216(1): 95-102.
[4] Islam M N, Hossain M A. Mortality rate of fish seeds (Labeorohita) during traditional transportation system in the northwest bangladesh[J]. Journal of Scientific Research, 2013, 5(2): 383-392.
[5] Harmon T S. Methods for reducing stressors and maintaining water quality associated with live fish transport in tanks:a review of the basics[J]. Reviews in Aquaculture, 2009, 1(1): 58-66.
[6] 吴慧曼. 淡水活鱼现代流通的装备技术集成与模式优化研究[D]. 北京:中国农业大学,2014:1-2. Wu Huiman. Research on Equipment and Technology Integrating and Mode Optimizting of the Freshwater-Fish Modern Circulation[D]. Beijing: China agricultural university, 2014: 1-2. (in Chinese with English abstract)
[7] Zeng P, Chen T, Shen J. Effects of cold acclimation and storage temperature on crucian carp (Carassiusauratusgibelio) in a waterless preservation[J]. Fish physiology and biochemistry, 2014, 40(3): 973-982.
[8] Jamie G, Skudlarek S D, Coyle L B. Effect of holding and packing conditions on hemolymph parameters of freshwater prawns, macrobrachiumrosenbergii, during simulated waterless transport[J]. Journal of the world aquaculture society, 2011, 42(5): 603-617.
[9] 白艳龙,谭昭仪,邸向乾,等. 黄颡鱼无水保活技术研究[J].食品工业科技,2013,34(1):334-337. Bai Yanlong, Tan Zaoyi, Di Xiangqian, et al. Research of the keep-alive technology without water of yellow catfish[J]. Science and technology of food industry, 2013, 34(1): 334-337. (in Chinese with English abstract)
[10] 刘伟东,薛长湖,殷邦忠,等. 低温下大菱鲆有水和无水保活过程中生理生化变化的研究[J]. 渔业科学进展,2009,30(5):69-74. Liu Weidong, Xue Changhu, Yin Bangzhong, et al. Physiological and biochemical change of Scophthalmus maximus kept alive at low temperature with or without water[J]. Progress in Fishery Science, 2009, 30(5): 69-74. (in Chinese with English abstract)
[11] Wysocki L E, Dittami J P, Ladich F. Ship noise and cortisol secretion in European freshwater fishes[J]. Biological Conservation, 2006, 128(4): 501-508.
[12] 刘波. 高温应激与大黄蒽醌提取物对团头鲂生理反应及相关热应激蛋白表达的影响[D]. 南京:南京农业大学,2012:90-91. Liu Bo. Effects of high temperature stress and anthraquinone extract form Rheum officinale Bail on the physiological response and gene expression of heat shock protein of Megalobrama amblycephala[D]. Nanjing: Nanjing Agricultural University, 2012: 90-91. (in Chinese with English abstract)
[13] 李念文,汤元睿,谢晶,等. 物流过程中大眼金枪鱼(Thunnusobesus) 的品质变化[J]. 食品科学,2013,34(14):319-323. Li Nianwen, Tang Yuanrui, Xie Jing, et al. Physicochemical quality properties of Thunnusobesus during logistical process[J]. Food Science, 2013, 34(14): 319-323. (in Chinese with English abstract)
[14] GB/T 5009.5-2010, 食品中蛋白质的测定[S].
[15] GB/T 14772-2008, 食品中粗脂肪的测定[S].
[16] SC/T 3032-2007, 水产品中挥发性盐基氮的测定[S].
[17] Li J K, Hui T, Wang F L, et al. Chinese red pepper (Zanthoxylum bungeanum Maxim.) leaf extract as natural antioxidants in salted silver carp (Hypophthal michthysmolitrix) in dorsal and ventral muscles during processing[J]. Food Control, 2015, 56(10): 9-17.
[18] 方静,黄卉,李来好,等.不同致死方式对罗非鱼鱼片品质的影响[J]. 南方水产科学,2013,9(5):13-18. Fang Jing, Huang Hui , Li Laihao, et al. Effect of different slaughter methods on quality of oreochromissp Fillets [J]. South China Fisheries Science, 2013, 9(5): 13-18. (in Chinese with English abstract)
[19] 邓捷春,王锡昌,刘源. 暗纹东方鲀与红鳍东方鲀滋味成分差异研究[J]. 食品工业技,2010,31(3):106-108. Dong Jiechun, Wang Xichang, Liu Yuan. Study on difference of taste compounds between Fugu obscurus and Fugu rubripes[J]. Science and Technology of Food Industry, 2010, 31(3): 106-108. (in Chinese with English abstract)
[20] Anusha K D, Jorge M F, Viswanath K. Acclimation of Zebrafish to Transport Stress[J]. Zebrafish, 2013, 10(1): 87-98.
[21] Mi H, Qian C, Mao L. Quality and biochemical properties of artificially hibernated crucian carp for waterless preservation[J]. Fish physiology and biochemistry, 2012, 38(6): 1721-1728.
[22] 常玉梅,曹鼎臣,孙效文,等. 低温胁迫对鲤血清生化指标的影响[J]. 水产学杂志,2006,19(2):71-75. Chang Yumei, Cao Dingchen, Sun Xiaowen, et al. Changes of serum biochemical indices of cpmmon carp affected bycold temperatures[J]. Chinese Journal of Fisheries, 2006, 19(2): 71-75. (in Chinese with English abstract)
[23] Donaldson M R,Cooke S J, Patterson D A, et al.Cold shock and fish[J]. Journal of Fish Biology, 2008, 73(7): 1491-1530.
[24] 杜浩,危起伟,甘芳,等. 美洲鲥应激后皮质醇激素和血液生化指标的变化[J]. 动物学杂志,2006,41(3):80-84. Du Hao, Wei Qiwei, Gan Fang, et al. Changes in serum cortisol and blood biochemical parameters after stresses in American shad[J]. Chinese Journal of Zodogy, 2006, 41(3): 80-84. (in Chinese with English abstract)
[25] 王美垚. 急性低温胁迫及恢复对吉富罗非鱼血清生化、免疫以及应激蛋白基因表达的影响[D]. 南京:南京农业大学,2009:23-30. Wang Meiyao. The Effect of Acute Cold Stress and Recovery on the Serum Biochemical, Immune Indices and HSP70 GeneExpression in the Tissues of Gift Strain Nile Tilapia[D]. Nanjing: Nanjing Agricultural University, 2009: 23-30. (in Chinese with English abstract)
[26] 明建华,谢骏,徐跑,等. 大黄素、维生素C及其配伍对团头鲂生长、生理生化指标、抗病原感染以及两种HSP70s mRNA表达的影响[J]. 水产学报,2010,34(9):1447-1459. Ming Jianhua, Xie Jun, Xu Pao, et al. Effects of emodin, vitamin C and their combination on growth, physiological and biochemical parameters, disease resistance and two HSP70s mRNA expression of Wuchang bream (Megalobrama amblycephala)[J]. Journal of Fisheries of China, 2010, 34(9): 1447-1459. (in Chinese with English abstract)
[27] Jo Y J, Jung K H, Lee M Y, et al. Effect of high-pressure short-time processing on the physicochemical properties of abalone (Haliotis discus hannai) during refrigerated storage[J]. Innovative Food science & Emerging Technologies, 2014, 23: 33-38.
[28] 汤元睿,谢晶,李念文,等. 不同冷链物流过程对金枪鱼品质及组织形态的影响[J]. 农业工程学报,2014,30(5):285-292. Tang Yuanrui, Xie Jing, Li Nianwen, et al. Effects of different cold chain logistics situations on quality and microstructure of tuna (Thunnus obesus) fillets[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2014, 30(5): 285-292. (in Chinese with English abstract)
[29] 林婉玲,关熔,曾庆孝,等. 影响脆肉鲩鱼背肌质构特性的因素[J]. 华南理工大学学报:自然科学版,2009,37(4):135-137. Lin Wanling, Guan Rong, Zeng Qingxiao, et al. Factors Affecting Textural Characteristics of Dorsal Muscle of Crisp Grass Carp[J]. Journal of south china university of technology (Natural science edition), 2009, 37(4): 135-137. (in Chinese with English abstract)
[30] 胡芬,李小定,熊善柏,等. 5种淡水鱼肉的质构特性及与营养成分的相关性分析[J]. 食品科学,2011,32(11):69-73. Hu Fen, Li Xiaoding, Xiong Shanbai, et al. Texture properties of freshwater fish and their correlation with nutritional components[J]. Food Science, 2011, 32(11): 69-73. (in Chinese with English abstract)
[31] Driedzic W R, Ewart K V. Control of glycerol production by rainbow smelt (Osmerusmordax) to provide freeze resistance and allow foraging at low winter temperatures[J]. Comparative Biochemistry and Physiology Part B: Biochemistry & Molecular Biology, 2004, 139(3): 347-357.
Change of physiological stress and flesh quality of Megalobrama amblycephala during suitable waterless keep alive conditions
Liu Xiao, Xie Jing※, Yang Xi, Dong Hanbo, Zhang Xinlin
(Shanghai Engineering Research Center of Aquatic Product Processing & Preservation, College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
Abstract:Currently circulation mode of freshwater fish was water transport. Commercial cost and several transportation procedures, including catch, temporary culture, transport shake, loading, unloading and distribution, induced harmful stress in fish, caused injury and even death. Related research showed the loss cost accounted for about 10% of the total cost in China, which was 20 times that in developed countries. Therefore, waterless keep alive transport of freshwater fish was more and more taken seriously. Hibernated temperature, packing method, survival time and survival rate of four seasons fish live in waterless environment were researched in order to investigate the effects of physiological stress and flesh quality of Megalobrama amblycephala during suitable waterless keep alive condition.Fish were examined at different time points: living in normal temperature (control), waterlessly keeping alive for 14 h (waterless) and then recovering in normal temperature for 24 h (recover). Blood biochemical items including cortisol (COR), glucose (GLU) and lactic acid (LAC) concentration, aspartate aminotransferase (AST), alanine aminotransferase (ALT) and alkaline phosphatase (ALP) activity were determinated and flesh quality indicators such as water holding capacity, total volatile basic nitrogen (TVB-N), thiobarbituric acid (TBA), texture and free amino acids were studied. The results showed: suitable living temperature of Megalobrama amblycephala for waterless keep alive was (14.8±0.2)℃ (at winter), and then dropped (2℃/h) living temperature to 2℃ (hibernated temperature). The hibernated fish were packaged in moist wood-shavings but without added water by plastic bag (120 cm×90 cm) and oxygen-rich atmosphere (80% O2), finally plastic bag was sealed and placed at 2℃ for 14h, survival rate reached 100% after (14.8±0.2)℃ (normal temperature)recovery 24 h. Blood COR and LAC concentration, AST and ALT activity of fish keep alive 14h in waterless were significantly higher than normal level (control) (P<0.05), while blood GLU concentration and ALP activity were significantly lower than normal level (P<0.05). After recovery 24 h, most blood biochemical values returned to normal level, except for blood AST activity was still significantly higher than normal value. Protein and fat content, TVB-N, TBA and the water holding capacity of fish flesh were not influenced in low temperature waterless environment, but the fish flesh hardness and chewiness were significantly decreased (P<0.05). Free amino acids Ser, Glu, Gly, Val and Arg of fish flesh at waterless were significantly higher than normal value (P<0.05), concentrations of Ile, Leu, Tyr, Phe at waterless were not significantly change with normal , however, after recovery 24 h, them were significantly higher than normal (P<0.05). In conclusion, the stress induced by the cold and waterless condition in fish can be eliminated 24 h after recovery, and the changes of fish tasting quality are not significant. The results provide a reference for the application of waterlessly keeping alive in transportation of live freshwater fish.
Keywords:quality control; temperature; fish; Megalobrama amblycephala; waterless keep alive; physiological stress
通信作者:※谢晶,女,上海海洋大学食品学院,教授,博士生导师。上海上海水产品加工及贮藏工程技术研究中心,上海海洋大学食品学院,201306。Email:jxie@shou.edu.cn
作者简介:刘骁,男,山东省安丘市,博士生,研究方向:食品工程。上海上海水产品加工及贮藏工程技术研究中心,上海海洋大学食品学院,201306。Email:lliuxiao0515@aliyun.com
基金项目:“十二五”国家支撑计划项目(2012BAD38B04),2013年上海市科技兴农重点攻关项目[沪农科攻字(2013)第3-4字]
收稿日期:2015-09-04
修订日期:2015-11-30
中图分类号:TS254.1
文献标志码:A
文章编号:1002-6819(2016)-03-0295-06
doi:10.11975/j.issn.1002-6819.2016.03.042
