滇牡丹天然群体的表型多样性
2016-03-21李树发蔡艳飞张秀新薛璟祺熊灿坤瞿素萍
李树发,蔡艳飞,张秀新, 薛璟祺,熊灿坤,瞿素萍*
(1. 国家观赏园艺工程技术研究中心,云南 昆明 650205;2. 云南省农业科学院花卉研究所,云南 昆明 650205;3. 中国农业科学院蔬菜花卉研究所,北京 100081;4. 云南格桑花卉有限责任公司,云南 香格里拉 650000)
滇牡丹天然群体的表型多样性
李树发1,2,蔡艳飞1,2*,张秀新3, 薛璟祺3,熊灿坤4,瞿素萍1,2**
(1. 国家观赏园艺工程技术研究中心,云南 昆明 650205;2. 云南省农业科学院花卉研究所,云南 昆明 650205;3. 中国农业科学院蔬菜花卉研究所,北京 100081;4. 云南格桑花卉有限责任公司,云南 香格里拉 650000)
为揭示滇牡丹天然居群的表型变异程度和变异规律,利用31个形态学指标对9个滇牡丹(Paeoniadelavayi)的天然居群进行表型多样性研究。结果表明,31个表型性状的变异系数(c.v.)为3.22 %~76.12 %,种群间的平均变异系数为25.24 %,表明滇牡丹居群的表型性状离散程度较高。在研究的9个居群中,纳帕海居群(NPH)和梁王山居群(LWS)分别具有最大和最小的变异系数,其变异系数分别为31.03 %和20.11 %。滇牡丹表型性状在居群间和居群内存在着丰富的表型多样性,31个表型性状的平均表型分化系数为73.62 %,群体间的变异是其表型变异的主要来源。利用居群间欧氏距离进行的UPGMA聚类分析结果表明,滇牡丹9个天然居群可以聚为3类,且表型性状没有严格依地理距离而聚类。基于滇牡丹的表型多样性及变异特征,应尽可能地保护较多的居群;从资源利用的角度则应尽量保护群体的完整性以保存其群体内所蕴藏的观赏性状。
滇牡丹;表型多样性;表型分化;保护
滇牡丹(Paeoniadelavayi)为芍药科(Paeoniaceae)芍药属(Paeonia)牡丹组(Sect. Moutan)植物[1-2],是中国西南地区特有种,也是芍药属分布最南的一个牡丹类群,在芍药属植物的起源、演化、地理分布研究方面有重要的学术价值。此外,在芍药属植物中只有滇牡丹和大花黄牡丹(P.ludlowii)拥有黄色花基因,现有牡丹品种中的黄花种质基本都来源于滇牡丹,在杂交育种中具有重要的应用价值[3]。由于滇牡丹的分布区域狭小,生态环境遭到严重破坏和具有较高的研究和应用价值,滇牡丹被认为是渐危种并于1987年被列为国家三级保护植物[4]。
遗传多样性是种质资源保护与评价的重要指标,表型多样性是遗传多样性与环境多样性的综合体现,是了解生物遗传变异的重要线索,被广泛用于物种的保护和驯化研究[5-6]。许多学者在滇牡丹的地理分布、生态环境、形态解剖、核型、分子生物学等方面做过一些研究[2-3,7-8],表明滇牡丹的生存环境、形态和核型方面均表现出多样化,但关于表型多样性的研究报道较少。本试验选取在云南省分布的9个滇牡丹自然居群样本进行表型多样性研究,不仅可以全面了解滇牡丹表型变异程度与变异规律,为筛选优良变异、建立核心种质资源提供参考依据,还可为滇牡丹资源的保护、评价与育种研究提供理论参考。
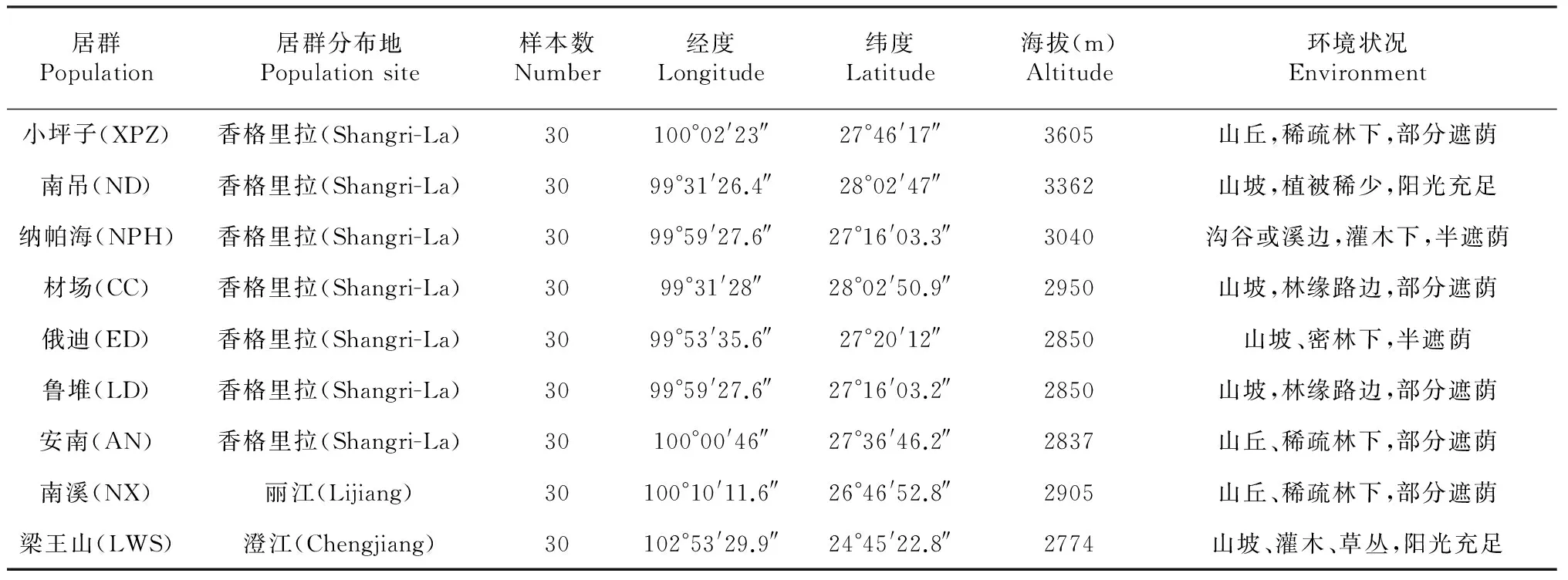
表1 调查的9个滇牡丹天然居群的地理分布情况
1 材料与方法
1.1 群体选择与试验材料采集
在滇牡丹集中分布的滇中(澄江县)和滇西北地区(丽江、香格里拉)选择间隔距离在10km以上、相对隔离的9个野生居群,在选定的各居群内随机选择30株生长正常、无明显病虫害、处于盛花期的植株,为避免样本间的亲缘关系,样本间的直线距离不低于10 m。选定的滇牡丹居群采用全球卫星定位系统(GPS)定位。各居群地理分布信息见表1。
1.2 性状的选取和测定方法
根据《中国植物志》对滇牡丹的分类特征的描述,选取了与叶、花、果形态相关的31个表型性状进行观测,并对相应性状进行编码(表2)。在选定植株上测量株高、老茎高、新梢长、冠幅;分别选取茎干中部和顶端叶片(花序下的第1片叶)测量叶片连叶柄长度、叶长度和宽度,并调查花序数量;每株随机选取3朵完全开放的花朵,测量其花梗长、花径、花瓣的长与宽、柱头、花萼长和宽,调查心皮数量和萼片数量(萼片与苞片易混淆,合在一起统计);根据花瓣的自然形态、硬度和颜色,统计花瓣的质地、形状和花色;果实成熟期在每株植株上随机测量3个果实的果梗长度和粗度、果实的纵径和横径,调查整株的果实数量及种子数量。用游标卡尺测量叶、花、果的长宽,长度测量精度0.5 mm。
1.3 统计分析方法及参数
均值、标准差和变异系数等性状变异特征的计算、方差分析和表型分化系数等的统计参照明军和顾万春[5]、张彩霞等[10]的方法。群体间的表型性状相似性聚类分析采用欧式距离系数,利用非加权配对算数平均法(UPGMA)进行聚类分析。
2 结果与分析
2.1 滇牡丹9个群体的表型特征
研究的9个群体中,小坪子居群(XPZ)的株高和多年生老茎最高,平均分别为162和132.83 cm,新梢和冠幅最长,花最大,花瓣最多,心皮数量也最多,花色大多为黑紫红色、紫红色,少量为黄紫红色,花瓣皱缩,花瓣质地较柔软。此外,该居群的果实数和种子数量最多,分别为7.73个/株和38.60粒/株。居群内植株多丛状、成片分布;南吊居群(ND)的株高和多年生老茎最矮,分别为24.70和6.23 cm,当年生新梢和冠幅也最小,花最小,花黄色,花瓣柔软,心皮数量、果实也最少,居群内植株多单生或2~4株丛生;纳帕海居群(NPH)花以紫红色为主,有少量黄紫红色,花瓣质地坚挺,居群内植株多单生或2~5株丛生;南溪居群(NX)的新梢最短,花紫红色,花瓣微皱、质地较坚挺,居群内植株多单生或2~3株丛生;材场居群(CC)以黄色花为主,有少量花的花瓣基部带紫条斑纹,花瓣质地柔软,居群内植株多连片丛生;俄迪居群(ED)叶片最大,中部叶片和顶部叶片的连叶柄、叶片长和叶片宽最大,花瓣最宽,但花瓣数最少,平均7.73片/朵,花色主要为橙红和橙黄色,花瓣平整、质地较硬,果实横径最小,平均1.58 cm,但种子数量中等,平均6.07粒/株,居群内植株多单生或2~3株丛生;鲁堆居群(LD)的花梗和果梗最长,平均分别为11.04和11.77 cm,其它与俄迪群体相同或相似;安南居群(AN)的柱头最长,平均为1.71 cm,果实纵径也最大,平均1.58 cm,但萼片数最少,花呈紫红色,居群内植株多单生,偶有2~3株丛生;梁王山居群(LWS)的花序数量最多,每株平均3.03个,花黄色,花瓣质地柔软,有少部分花的花瓣基部中脉呈紫红色,植株多单生(表3)。

表2 滇牡丹表型性状及编码
从表3中还可看出,所选择的31个表型性状在群体间均具有显著差异,而株高、老茎高、新梢长、冠幅、中部叶柄长、中部叶长、中部叶宽、顶端叶片长、花序数量、花瓣质地、果实数量和种子数等12个性状在群体内没有显著差异,其他性状在群体内均达到显著差异。

表3 云南滇牡丹表型性状均值与标准误
续表3 Continued table 3
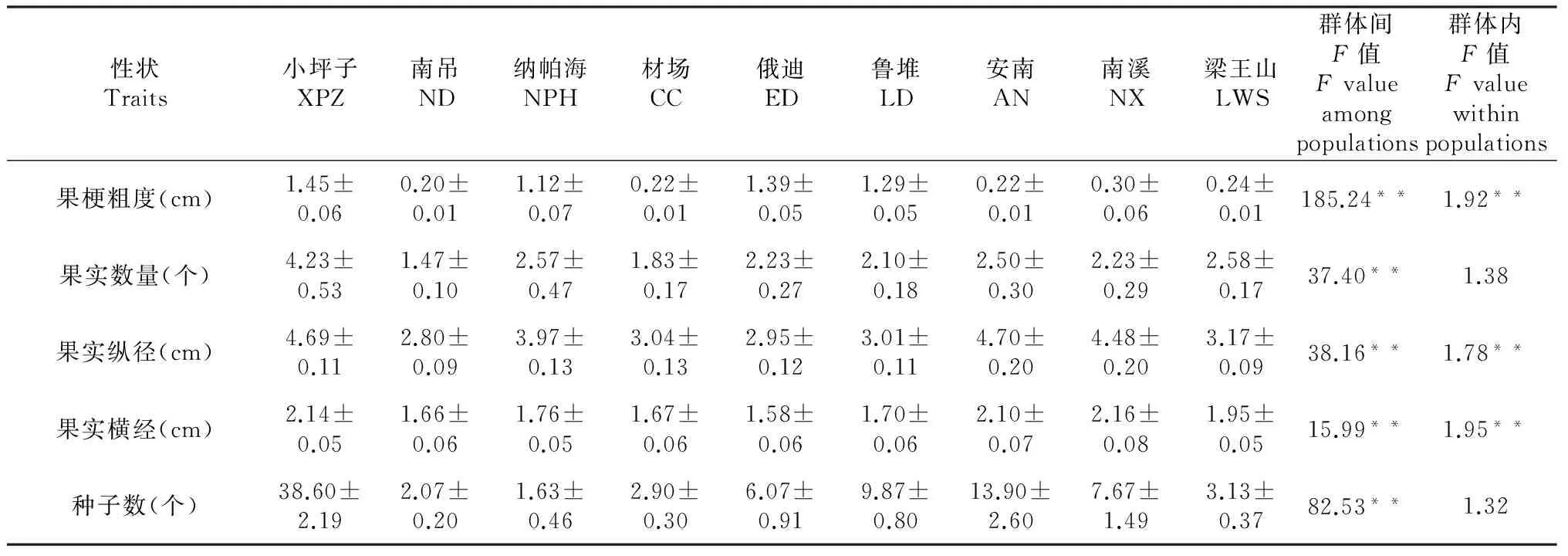
性状Traits小坪子XPZ南吊ND纳帕海NPH材场CC俄迪ED鲁堆LD安南AN南溪NX梁王山LWS群体间F值Fvalueamongpopulations群体内F值Fvaluewithinpopulations果梗粗度(cm)1.45±0.060.20±0.011.12±0.070.22±0.011.39±0.051.29±0.050.22±0.010.30±0.060.24±0.01185.24**1.92**果实数量(个)4.23±0.531.47±0.102.57±0.471.83±0.172.23±0.272.10±0.182.50±0.302.23±0.292.58±0.1737.40**1.38果实纵径(cm)4.69±0.112.80±0.093.97±0.133.04±0.132.95±0.123.01±0.114.70±0.204.48±0.203.17±0.0938.16**1.78**果实横经(cm)2.14±0.051.66±0.061.76±0.051.67±0.061.58±0.061.70±0.062.10±0.072.16±0.081.95±0.0515.99**1.95**种子数(个)38.60±2.192.07±0.201.63±0.462.90±0.306.07±0.919.87±0.8013.90±2.607.67±1.493.13±0.3782.53**1.32
注:*表示在0.05水平上差异性达到显著;**表示在0.01水平上差异性达到极显著。
Notes: *meant significant difference at 0.05 level;**meant very significant difference at 0.01 level.
2.2 滇牡丹表型性状的变异
31个表型性状的变异系数在3.22 %~76.12 %,平均变异系数为25.24 %。离散程度较高的表型性状有老茎高和种子数量,两者的变异系数均超过50 %,分别为68.53 %和76.12 %,可见种子数量在所观测的性状中变异程度最大;变异系数在25 %~50 %的还有新梢长、冠幅、顶端叶柄长、顶端叶长、顶端叶宽、花序数量、花梗长、心皮数量、果梗长度、果梗粗度、果实数量等11个性状;植株间最稳定的性状为花瓣形状,平均变异系数仅为3.22 %,花瓣质地、花色、萼片颜色等性状也较稳定。研究的9个滇牡丹居群中,表型变异最大的是纳帕海居群,变异系数达31.03 %,表型变异最小的是梁王山居群,变异系数为20.11 %(表4)。
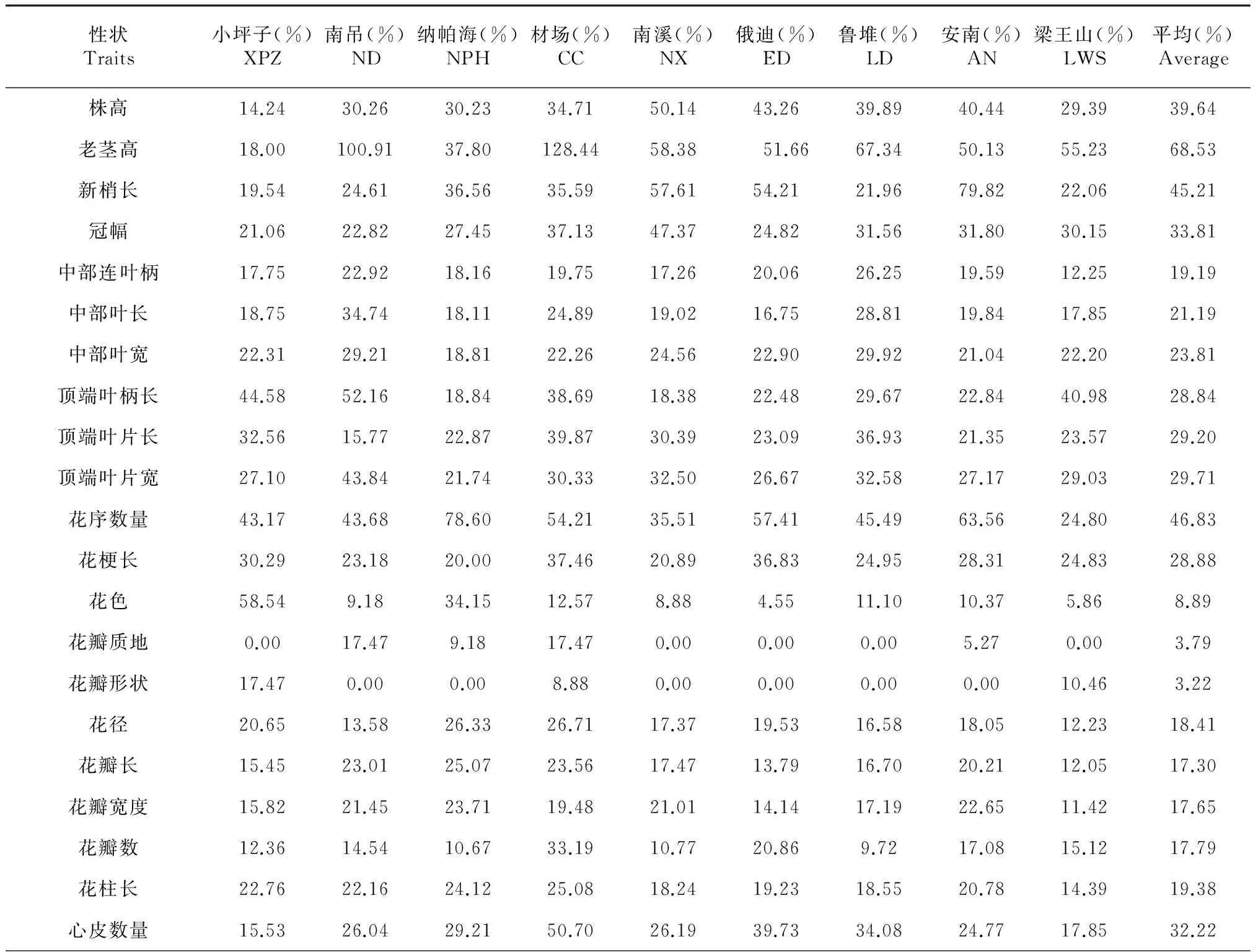
表4 滇牡丹表型性状变异系数
续表4 Continued table 4

性状Traits小坪子(%)XPZ南吊(%)ND纳帕海(%)NPH材场(%)CC南溪(%)NX俄迪(%)ED鲁堆(%)LD安南(%)AN梁王山(%)LWS平均(%)Average萼片颜色33.850.0015.880.0034.770.000.0036.940.0011.95萼片长度20.1110.5731.2424.6026.1115.0519.0319.6322.8021.20萼片宽度19.549.9422.8422.9424.4215.7820.4217.8620.2920.29萼片数量11.6816.7213.3227.1012.0015.058.2017.2816.5216.03果梗长度24.1733.2623.5942.1632.4832.0030.1732.3925.5632.46果梗粗度22.3626.6633.5125.55110.0921.6521.1825.0418.8637.06果实数量37.5038.9686.5049.7953.6767.2234.3054.8637.1349.50果实纵径12.7317.7117.7822.7424.4122.3819.2023.3416.4121.41果实横经11.9920.7714.7419.5319.7421.3120.5618.1314.4118.95种子数31.0953.81152.9456.81106.6582.3544.20100.8465.8876.12平均24.1423.3531.0329.2729.0624.5621.6326.7920.1125.24
2.3 方差分量与群体间表型分化系数
滇牡丹的性状平均表型分化系数为73.62 %,群体间方差分量占总变异的48.64 %,群体内的方差分量占总变异的15.35 %,说明群体间的变异为表型变异的主要来源。花梗长、萼片长、萼片宽、果梗长、果实横径等5个性状在群体内的变异大于群体间的变异,其它性状如株高、冠幅、花直径、花瓣长与花瓣宽、花瓣数量、花色等26个性状则是群体间的变异大于群体内的变异,说明与萼片、花梗及果梗相关的性状的变异主要来自于群体内,而与株高、叶、花、果实数量和种子数等相关性状的变异则主要来自于群体间(表5)。
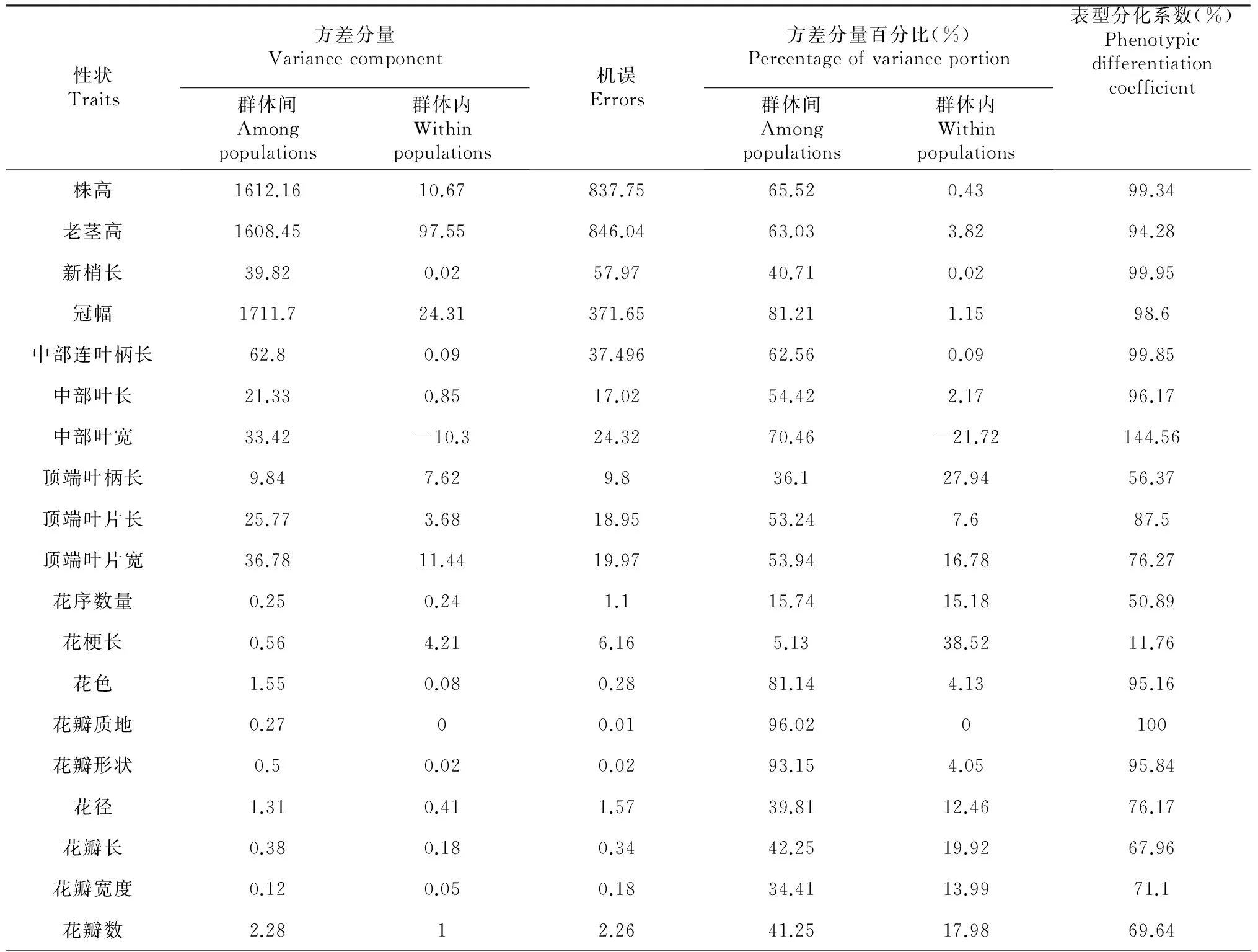
表5 滇牡丹表型性状方差分量与表型分化系数
续表5 Continued table 5

性状Traits方差分量Variancecomponent群体间Amongpopulations群体内Withinpopulations机误Errors方差分量百分比(%)Percentageofvarianceportion群体间Amongpopulations群体内Withinpopulations表型分化系数(%)Phenotypicdifferentiationcoefficient花柱长1.271.121.532.7328.8253.17心皮数量0.840.730.6837.4332.2153.75萼片颜色1.280.530.236325.9570.83萼片长度0.090.120.1625.331.8744.25萼片宽度0.060.070.127.0831.1146.54萼片数量1.271.121.532.7328.8253.17果梗长度1.495.018.669.8133.0522.9果梗粗度0.330.050.0576.1211.4786.91果实数量3.231.022.6946.5814.6376.1果实纵径0.620.40.5140.5426.0260.9果实横经0.050.10.119.4139.2633.08种子数133.2415.9749.2367.158.0589.3平均48.6415.3573.62
2.4 群体间基于表型性状的聚类分析
对表型性状进行聚类分析发现,以欧式距离8.82为阈值,9个滇牡丹居群被分为3组(图1)。小坪子居群(XPZ)为第1组,南吊居群(ND)构成第2组,另外7个居群构成第3组。第1组海拔最高,气温较低,生境为部分遮光环境,其植株最大,花径最大,花瓣最多,花色主要为紫黑、紫红色,少量为黄紫红色,果实和种子数最多,植株多丛状成片分布,与其它两组居群差异显著,单独为一组;第2组海拔高度仅次于第1组,生境内植被稀少、阳光充足,植株和花径最小,心皮数量和果实也最少,花为黄色、少量有紫色斑,与其它两组居群差异显著,单独为一组;第3组的7个居群海拔高度相近、生境相似,花色相同的居群先聚类,再与不同花色聚类。其中,鲁堆居群(LD)与俄迪居群(ED)地理距离较近、海拔相同,生境相似,花色同为橙色或橙色带紫红斑,表型特征相似程度高,聚为一类;梁王山居群(LWS)与材场居群(CC)虽地理距离较远、海拔不同,但因材场群体受金沙江干热河谷影响,其气温相似,花色主要为黄色,少部分为黄中带紫红斑,表型特征较相似,也聚为一类;南溪(NX)、纳帕海(NPH)与安南居群(AN)虽地理距离稍远,但海拔相近,具有相似的生境,且花色相同,均为紫花色,聚为一类。
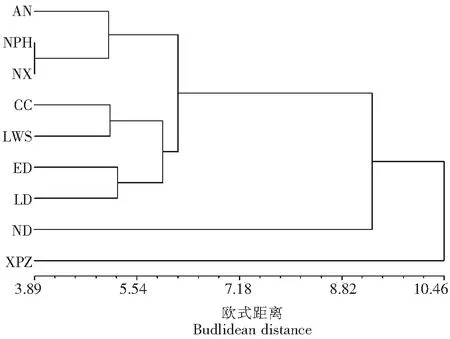
安南居群(AN),纳帕海居群(NPH),南溪居群(NX),材场居群(CC),梁王山居群(LWS),俄迪居群(ED),鲁堆居群(LD),南吊居群(ND),小坪子居群(XPZ)图1 滇牡丹群体基于表型欧式距离的UPGMA聚类Fig.1 UPGMA clustering tree of Paeonia delavayi populations based on Euclidean distances of phenotypic traits
3 讨 论
3.1 滇牡丹的表型变异特征
形态多样性是遗传多样性的表现形式之一,表型性状的变异在适应性和进化上均具有重要意义[5-6]。本研究中观测的31个表型性状在滇牡丹的群体间均达显著差异,其中有19个性状在群体内的差异也达显著水平,表明滇牡丹的形态性状表现出极高的多样性。31个表型性状在群体间的表型分化系数为73.62 %,说明有3/4的表型遗传变异存在于居群间,居群间的变异大于居群内的变异,居群间变异是滇牡丹的主要变异来源,群体间的变异主要表现在观赏性状和繁殖性状上,如株高、冠幅、花冠大小、花色、种子数量等表型性状。与前人的研究相比,本研究的9个滇牡丹居群的表型多样性丰富,高于ISSR标记的分布在滇西的滇牡丹居群的遗传分化系数(GST)0.4349[7]和10个滇牡丹花色类群的表型分化系数42.25 %[12],但是稍低于香格里拉县4个滇牡丹居群的遗传分化系数(Gst) 0.7973[9]。与其他植物相比,滇牡丹表型分化处于较高水平,高于云南含笑(Micheliayunnanensis)的24.38 %[12]、鹅观草(Roegneriakamoji)的28.38 %[13]、中甸刺玫(Rosapraelucens)的69.56 %[14],低于天麻(Gastrodiaelata)的78.83 %[15]、云南黄连(Coptisteeta)的74.405 %[16],与峨眉蔷薇(Rosaomeiensis)的73.55 %[17]、泸定百合(Liliumsargenttiae)的71.22 %[18]相当。
滇牡丹居群间存在较大的遗传分化,其成因可能有以下几点:在居群水平上,繁育系统是影响遗传分化的重要因素。滇牡丹主要依靠飞行能力较弱的昆虫传粉,种子较大,种子散布主要依靠重力,由弱飞行能力的动物授粉和靠种子迁移的植物居群之间的遗传分化显著[19]。滇牡丹的主要繁殖方式是无性繁殖。无性繁殖的扩散能力较弱,不能远距离扩散,使居群之间无法进行基因交流。滇牡丹的分布区域属于横断山区的东南边缘,是横断山区高山深谷地形最典型的区域。随着海拔的升高,气候、植被和土壤等也呈现明显的垂直变化。这种特殊的地形和生境,造成滇牡丹居群间个体迁移率小,基因流偏小,从而形成了居群间较大的遗传分化[3]。对滇牡丹9个天然居群31个表型性状进行聚类分析的结果也表明,滇牡丹的表型性状并没有完全依地理距离而聚类,而是与花色及各居群环境条件的相似程度有关,推测云南滇西和滇中复杂的地理环境和气候条件对云南滇牡丹的表型变异具有较大的影响,滇牡丹丰富的多样性是遗传因素与环境因子共同作用的结果。
群体内的变异是物种多样性的重要组成部分,反映基因突变、环境适应等重要信息,植物种群中保持大的变异蓄积对种群是有利的,使种群在整体上适应可能遇到的大多数环境条件[14]。在滇牡丹9个天然居群中,小坪子居群在株型和花大小等性状上显著优于其它8个居群,从性状的离散程度也就是变异系数来看,小坪子和纳帕海居群的花色变异更丰富,花径的变异也较大,而南吊、南溪、俄迪、鲁堆、安南、材场和梁王山居群内与观赏相关的表型性状,特别是花瓣形状、花瓣质地和花色变异系数较小,表型性状较稳定。表明滇牡丹居群内蕴藏着丰富的观赏性状可供发掘利用,同时也反应了滇牡丹丰富的表型多样性。
3.2 基于表型多样性及变异特征的滇牡丹保护措施初探
物种的遗传多样性水平可以为其现状和保护价值的评估以及迁地保护提供非常重要的信息。一般认为稀有的或分布区狭窄的物种遗传多样性水平偏低[20],但也有些特有和濒危物种仍然保持较高水平的遗传变异[21-23]。虽然滇牡丹的地理分布范围狭小,但是分布区的地形复杂多样、生态环境多种多样,海拔差异大,气候变化显著,在居群间和居群内都表现出丰富的表型多样性,蕴藏着丰富的遗传变异。以上结果支持了龚洵等[3]对滇牡丹现状评估的观点,即滇牡丹拥有较高的遗传、生境和形态的多样性,具有较强的适应能力和进化潜力,并不处于濒危境地。然而,笔者从2009年开始调查滇牡丹发现,昆明西山和嵩明、大理海东、香格里拉鲁堆等居群相继被挖,而种群的自然恢复较困难。人为造成的生境破坏和滥采滥挖使滇牡丹的生存环境面临威胁,分布范围逐年减小,种群数量逐渐下降[3,24],对其采取相应的保护措施已非常紧迫。滇牡丹的表型变异非常丰富,群体间表型分化明显,需要尽可能地保护较多的居群,而其群体内所蕴藏的丰富的株型、花色和花瓣数等观赏性状变异,则要求尽可能多地保护群体中的个体,保存群体生境的完整性,特别是对表型多样性较高的居群应给予足够的重视。在对其进行种质资源的保护和评价、遗传改良及开发利用的过程中,可将群体选择和群体内个体选择结合起来,既能利用居群内的遗传变异,又能利用居群间的遗传变异,从而培育出环境适应性强、观赏性状优良的滇牡丹品种。然而,如何制定更切实有效且经济的保护和利用措施,还需要对其进行繁殖生物学、保护遗传学以及引种驯化和病虫害控制等方面的深入研究。
[1]蔡 健, 李 浩, 赵 翔,等. 22个牡丹品种形态性状的多样性分析[J]. 安徽农业科学, 2015(35):57-59.
[2 ]Hong D Y, Pan K Y, Yu H. Taxonomy of thePaeoniadelavayicomplex (Paeoniaceae) [J]. Annals of the Missouri Botanical Garden, 1998, 85(2):554-564.
[3]龚 洵,潘跃芝,杨志云.滇牡丹的多样性和现状评估[J].西北植物学报, 2003, 23(2):218-223.
[4]傅立国.中国植物红皮书——稀有濒危植物(第一册)[M].北京:科学出版社, 1992:530-531.
[5]陈 睿,鲜小林,秦 帆,等.山茶种质资源主要表型的遗传多样性分析[J].西南农业学报, 2015, 28(6):2706-2713.
[5]Ayele T B, Gailing O, Finkelde Y R. Assessment and integration of genetic, morphological and domographic variation inHageniaabyssinica(Bruce) J. F. Gmel to guide its conservation [J]. Joumal for Nature Conservation, 2011, 19(1):8-17.
[6]杨淑达,施苏华,龚 洵,等.滇牡丹遗传多样性的ISSR分析[J].生物多样性, 2005, 13(2):105-111.
[7]王晓琴.香格里拉滇牡丹遗传多样性研究[D].北京林业大学, 2009.
[9]刘 通,冯 丹,陈少瑜,等.4个滇牡丹天然居群遗传多样性的ISSR分析[J].西部林业科学, 2014, 43(3):31-36.
[10]张彩霞,明 军,刘 春,等.岷江百合天然群体的表型多样性[J].园艺学报, 2008, 35(8):1183-1188.
[11]张艳丽,李正红,马 宏,等.滇牡丹花色类群性状变异分析[J].植物分类与资源学报, 2011, 33(2):183-190.
[12]宋 杰,李世峰,刘丽娜,等.云南含笑天然居群的表型多样性分析[J].西北植物学报, 2013, 33(2):272-279.
[13]肖海峻,徐 柱,翟利剑,等.鹅观草居群表型多样性研究[J].西北植物学报, 2007, 27(11):2222-2227.
[14]李树发,李纯佳,蹇洪英,等.云南香格里拉特有易危植物中甸刺玫的表型多样性[J].园艺学报, 2013, 40(5):924-932.
[15]文国松,萧凤回.4种天麻变型的表型性状遗传多样性研究[J].西部林业科学, 2011, 40(2):21-25.
[16]杨维泽,金 航,李晚谊,等.濒危植物云南黄连不同居群表型多样性研究[J].云南大学学报, 2013, 35(5):719-726.
[17]周宁宁,唐开学,邱显钦,等.云南峨眉蔷薇天然群体的表型多样性[J].西南农业学报, 2009, 22(6):1732-1736.
[18]段 青,崔光芬,王祥宁,等.云南泸定百合遗传多样性的表型与ISSR分析[J].西北植物学报, 2013, 33(6):1106-1113.
[19]Avise J C. Molecular Markers, Natural History and Evolution [M]. New York:Chapman & Hall, 1994:191.
[20]Swensen S M, Allan G J, Howe M, et al. Gene tic analysis of the endangered island endemicMalacothamnusfasciculatus(Nutt.) Green var.nesiotic(Rob.) Kearn (Malvaceae) [J]. Conservation Biology, 1995, 9(3): 404-415.
[21]Kang U, Chang C S, Kim Y S. Genetic structure and conservation considerations of rare endemicAbeliophyllumdistichumNakai (Oleaceae) in Korea [J]. Journal of Plant Research, 2000, 113(2):127-138.
[22]Helenurm K. High levels of genetic polymorphism in the insular endemic herbJepsoniamalvifolia[J]. Journal of Heredity, 2001, 92(5):427-432.
[23]Zawko G, Krauss S L, Dixon K W, et al. Conservation genetics of the rare and endangeredLeucopogonobtectus(Ericaceae) [J]. Mollecular Ecology, 2001, 10(10):2389-2396.
[24]李 奎,郑宝强,王 雁,等.滇牡丹自然种群数量动态[J].植物生态学报, 2012, 36(6):522-529.
(责任编辑 王家银)
Phenotypic Diversity of Natural Populations ofPaeoniadelavayi
LI Shu-fa1,2, CAI Yan-fei1,2*, ZHANG Xiu-xin3, XUE Jing-qi3,XIONG Can-kun4, QU Su-ping1,2**
(1.National Engineering Research Center for Ornamental Horticulture, Yunnan Kunming 650205,China; 2.Flower Research Institute, Yunnan Academy of Agricultural Sciences, Yunnan Kunming 650205,China; 3.Institute of Vegetables and Flowers, Chinese Academy of Agricultural Sciences, Beijing 100081,China; 4. Yunnan Ge-sang Flower Co., Ltd., Yunnan Xianggelila 650000,China)
In order to reveal the variation degree and variation pattern of phenotypic inPaeoniadelavayi, 31 phenotypic traits of 9 natural populations were investigated. The results showed that:the coefficient of variation (c.v.) of 31 phenotypic traits ranged from 3.22 % to 76.12 %, and the averagec.v. between populations was 25.24 %. Those results showed thatPaeoniadelavayihad high variation degree of the phenotypic traits. NPH and LWS populations had the maximum and minimumc.v. among 9 populations, and the values ofc.v. were 31.03 % and 20.11 %, respectively. There were significant differences in the phenotypic variation among and within populations. The mean phenotypic differentiation coefficient was 73.62 %, demonstrating that differentiation among populations was the major source of variation. Using UPGMA cluster analysis, 9 natural populations ofP.delavayidivided into 3 groups, and the phenotypic traits did not gather according to geography distance. It was necessary to conserve more populations according to the phenotypic diversity and variation pattern ofP.delavayi. The integrality of populations should also be kept in order to preserve as more ornamental traits as possible for further utilization.
Paeoniadelavayi; Phenotypic diversity; Phenotypic differentiation; Conservation
1001-4829(2016)10-2470-09
10.16213/j.cnki.scjas.2016.10.040
2015-01-08
国家公益性行业(农业)科研专项“国家重点保护野生花卉人工驯化繁殖及栽培技术研究与示范项目”(201203071);农业部园艺作物生物学与种质创制重点实验室项目;国家科技支撑计划项目(2015BAD10B00)
李树发(1964-),男,研究员,从事花卉资源收集、栽培及育种研究,E-mail:lsf206498@126.com,*为共同第一作者,**为通讯作者,瞿素萍,女,从事花卉遗传育种与繁育技术研究,E-mail:qusuping2002@sina.com。
S685.11
A
