亚甲基蓝对大鼠局灶性脑缺血再灌注后血脑屏障的保护作用①
2016-03-21吴敏方庆师忠芳徐立新董丽萍闫旭杨少华袁芳
吴敏,方庆,师忠芳,徐立新,董丽萍,闫旭,杨少华,2,袁芳
亚甲基蓝对大鼠局灶性脑缺血再灌注后血脑屏障的保护作用①
吴敏1,方庆1,师忠芳1,徐立新1,董丽萍1,闫旭1,杨少华1,2,袁芳1
[摘要]目的探讨亚甲基蓝对大鼠局灶性脑缺血再灌注引起血脑屏障破坏的保护作用。方法雄性Sprague-Dawley大鼠18只随机分为假手术组(n=6)、模型组(n=6)和亚甲基蓝组(n=6)。用线栓法制备大鼠左侧大脑中动脉栓塞1 h再灌注模型。亚甲基蓝组于再灌注即刻及再灌注2 h分别静脉给予亚甲基蓝3 mg/kg、1.5 mg/kg;模型组给予相同体积的生理盐水;假手术组手术操作与模型组相同,不插入线栓,不静脉注射药物。再灌注47 h后HE染色观察大鼠脑缺血周边皮层组织学结构,白蛋白免疫组化染色法检测血脑屏障通透性的变化,免疫组化染色法和免疫荧光双标染色法检测胶质原纤维酸性蛋白(GFAP)和水通道蛋白-4(AQP-4)的表达。结果HE染色显示,模型组缺血周边大脑皮层的细胞和血管形态不完整,而亚甲基蓝组病理变化减轻;模型组白蛋白、GFAP和AQP-4表达均明显高于假手术组(P<0.01),亚甲基蓝组白蛋白、GFAP、AQP-4表达均低于模型组(P<0.05)。免疫荧光双标染色显示,AQP-4与GFAP在星形胶质细胞上共定位。结论亚甲基蓝可能是通过减轻胶质细胞增生及下调AQP-4表达来改善局灶性脑缺血再灌注损伤引起的血脑屏障破坏。
[关键词]脑缺血再灌注;亚甲基蓝;血脑屏障;胶质原纤维酸性蛋白;水通道蛋白-4;大鼠
[本文著录格式]吴敏,方庆,师忠芳,等.亚甲基蓝对大鼠局灶性脑缺血再灌注后血脑屏障的保护作用[J].中国康复理论与实践, 2016, 22(2): 125-131.
CITED AS: Wu M, Fang Q, Shi ZF, et al. Effect of methylene blue on blood-brain barrier after focal cerebral ischemia-reperfusion in rats [J]. Zhongguo Kangfu Lilun Yu Shijian, 2016, 22(2): 125-131.
作者单位:1.首都医科大学北京市神经外科研究所病理生理室,首都医科大学附属北京天坛医院,北京市100050;2.北德克萨斯大学医学中心神经与药理系,美国德克萨斯州沃思堡76107。作者简介:吴敏(1986-),女,汉族,河北曲阳县人,硕士研究生,主要研究方向:脑水肿的发病机制研究。通讯作者:袁芳,女,博士,研究员。E-mail: florayuan@vip.sina.com。
缺血性脑卒中是人类致残、致死的主要疾病,脑缺血再灌注引起的血脑屏障(blood-brain barrier)破坏加重脑损伤[1],因此改善血脑屏障功能是缺血性脑卒中治疗的关注重点。亚甲基蓝是1876年合成的蓝色纺织染料,临床上主要用于高铁血红蛋白血症的治疗[2]。近年来一些研究表明亚甲基蓝对缺血性脑卒中有保护作用,包括改善神经功能,减少脑梗死体积和脑水肿[3-7]。然而,到目前为止,仅有一项研究指出亚甲基蓝对脑缺血再灌注损伤引起的血脑屏障破坏有保护作用,但其应用的是猪心脏骤停12 min再灌注模型,且观察的再灌注最长时间仅为自主循环恢复后6 h[8]。
本实验利用大鼠局灶性脑缺血1 h再灌注47 h模型,分别从血脑屏障通透性及星形胶质细胞(astrocytes, AST)变化两个方面来评价亚甲基蓝对局部脑缺血再灌注引起血脑屏障损伤的保护作用,并初步探讨其保护机制。
1 材料与方法
1.1实验动物及分组
18只健康成年雄性SPF级Sprague-Dawley大鼠,体质量280~320 g,由北京维通利华实验动物技术有限公司提供,许可证号SCXK(京)2012-0001。适应性喂养1周后,用随机数字表法将大鼠分为假手术组、模型组和亚甲基蓝组,每组6只,大鼠术前禁食12 h。
1.2主要实验试剂及仪器
亚甲基蓝(M9140):美国SIGMA-ALDRICH公司。伊红(ZLI-9613)、苏木素(ZLI-9610)、罗丹明标记山羊抗兔荧光二抗(ZF-0316)、Alexa Fluor 488标记山羊抗小鼠荧光二抗(ZF-0512)、抗荧光淬灭封片剂(ZLI-9556):北京中杉金桥生物技术有限公司。胶质原纤维酸性蛋白(glial fibrillary acidic protein, GFAP)抗体(Z0334)、EnVision检测试剂盒(A-K5007):丹麦DAKO公司。水通道蛋白-4(aquaporin-4, AQP-4)抗体(ab128906, ab9512)、白蛋白抗体(ab106582)及山羊抗鸡二抗(ab97135):美国ABCAM公司。正置荧光显微镜(Axio Imager A2):德国ZEISS公司。
1.3模型制备
大鼠以10%水合氯醛3.5 ml/kg腹腔注射麻醉,参照徐立新等[9]报道的线栓法制备左侧大脑中动脉阻塞再灌注模型,以大鼠手术麻醉清醒后出现右侧肢体瘫痪、站立不稳、提尾时向一侧转圈为模型成功的判断标准。
亚甲基蓝组大鼠脑缺血1 h再灌注即刻尾静脉注射亚甲基蓝3 mg/kg(30 min),大鼠脑缺血再灌注2 h后再次尾静脉注射亚甲基蓝1.5 mg/kg(15 min)。
模型组用生理盐水代替亚甲基蓝等体积注射。
假手术组手术操作与模型组相同,不插入线栓,不静脉注射药物。
1.4组织学检测
大鼠脑缺血1 h再灌注47 h,经心脏灌流4%多聚甲醛,取出大脑。脑组织常规石蜡包埋、切片(片厚5 μm),行HE染色。
1.5血脑屏障通透性检查
用白蛋白免疫组化染色法检查血脑屏障通透性的变化[10]。石蜡切片脱蜡至水,0.01 mol/L柠檬酸盐缓冲液(pH=6.0)微波热修复,自然冷却至室温后磷酸盐缓冲液(phosphate buffered saline, PBS)充分漂洗。3% H2O2溶液中室温避光孵育10 min,山羊血清室温封闭1 h,滴加白蛋白一抗(1∶400),4℃过夜。山羊抗鸡二抗(1∶400)室温孵育1 h,DAB显色,苏木素复染,脱水、透明、封片。正置荧光显微镜下观察并拍照。阴性对照用PBS代替一抗,其余步骤相同。
1.6 GFAP及AQP-4免疫组化染色
免疫组化染色为二步法,应用DAKO公司的Envision系统进行。GFAP及AQP-4抗体1∶2000稀释,4℃孵育过夜,然后按Envision系统的A-K5007试剂盒进行显色。阴性对照用PBS代替一抗,其余步骤相同。阳性细胞的染色为浅至棕褐色。
1.7 GFAP及AQP-4免疫荧光双标
0.01 mol/L柠檬酸盐缓冲液(pH=6.0)微波热修复,山羊血清封闭,分别滴加一抗(GFAP抗体1∶400稀释、AQP-4抗体1∶100稀释),4℃孵育过夜。滴加荧光二抗(罗丹明标记的山羊抗兔1∶200,Alexa Fluor 488标记的山羊抗小鼠1∶200),室温孵育1 h,4', 6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole, DAPI)室温孵育5 min,PBS洗涤,抗荧光淬灭封片剂封片。正置荧光显微镜观察、拍照。阴性对照用PBS代替一抗,其余步骤相同。
1.8图像分析
应用Image-Pro Plus 6.0图像分析软件对免疫组化结果进行图像分析。1个标本取1张切片,每张切片在镜下(400×)随机选取缺血周边大脑皮层相邻的5个非重叠视野,计算5个视野中免疫反应阳性细胞积分光密度值(integrated option density, IOD)的平均值。
1.9统计学分析
采用SPSS 17.0软件进行单因素方差分析。实验数据以(±s)表示,组间比较用最小显著性差异法(least-significant difference, LSD)。显著性水平α=0.05。
2 结果
2.1光镜检查
假手术组可见大脑皮层神经元、胶质细胞形态正常,结构完整;神经元胞浆丰富、均匀,胞核呈圆形或椭圆形,核仁清晰;血管形态光滑,弯曲自然,无间质水肿。模型组缺血周边大脑皮层神经元、胶质细胞的细胞间隙增宽,神经纤维网呈空泡样变;神经元胞浆及胞膜形态不规则,边界不清,胞核浓缩,部分细胞呈固缩状;血管周围间隙增宽。亚甲基蓝组神经元、胶质细胞形态相对正常,结构相对完整,病理变化轻;血管较光滑,血管周围间隙增宽现象有明显改善。见图1。
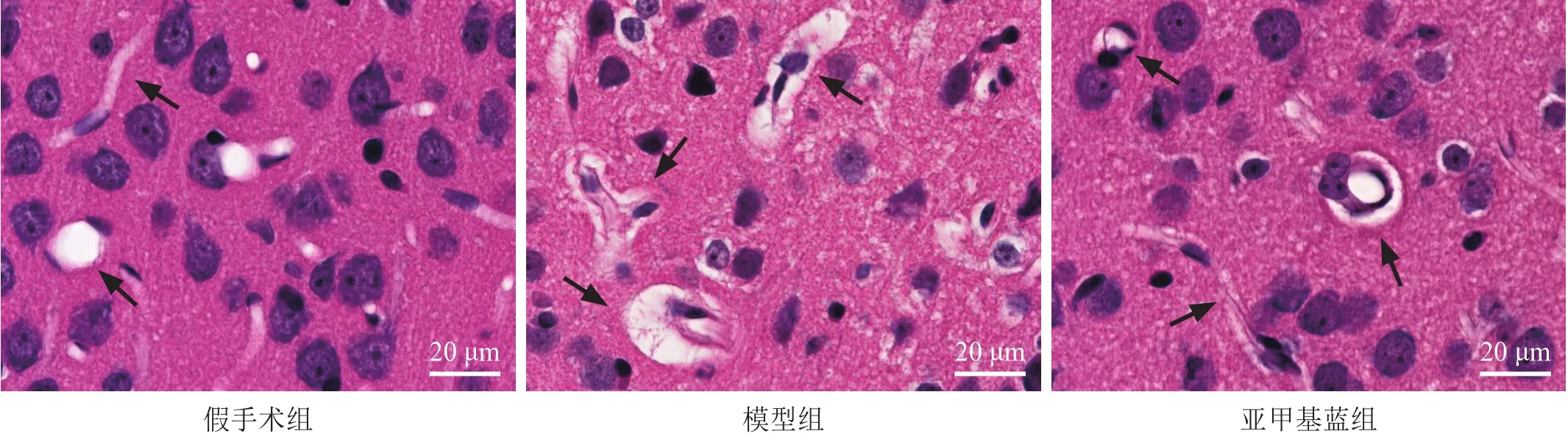
图1 脑缺血周边皮层组织HE染色(400×)
2.2免疫组化染色
2.2.1白蛋白
假手术组脑组织无白蛋白漏出,胞浆内可见轻微白蛋白阳性染色,呈浅褐色。模型组可见缺血周边大脑皮层的神经纤维网及胞浆内均有白蛋白阳性染色,染色增强,神经纤维网肿胀,呈海绵状。经亚甲基蓝治疗后,神经纤维网及胞浆内白蛋白阳性染色减少,神经纤维网肿胀程度减轻,海绵状不明显。见图2。
模型组白蛋白IOD明显高于假手术组,亚甲基蓝组白蛋白IOD明显低于模型组(P<0.01)。见表1。
2.2.2 GFAP
GFAP为AST的特异性标志物[11]。假手术组GFAP阳性细胞数较少,形态正常,着色为浅褐色;细胞突起细长,显示出蜘蛛状分支轮廓,细胞足突包绕血管。模型组缺血周边大脑皮层的GFAP阳性细胞体积增大,着色深染;细胞突起增粗增厚,分支增多,细胞足突缩短,血管周围间隙增宽。而亚甲基蓝组缺血周边大脑皮层的GFAP阳性细胞体积增大减轻;细胞突起分支减少,足突缩短情况有所改善,血管周围间隙较模型组减小。见图3。
模型组GFAP的IOD明显高于假手术组(P< 0.01),亚甲基蓝组GFAP的IOD低于模型组(P< 0.05),但仍高于假手术组(P<0.05)。见表1。
2.2.3 AQP-4
假手术组在血管周围的AST足突可见浅棕褐色染色,呈微弱阳性表达,在胞膜及胞浆上也有少量表达。模型组可见在缺血周边大脑皮层的血管周围AST足突上AQP-4免疫组化染色增强,呈深棕褐色,在胞膜及胞浆内的表达增多。亚甲基蓝组AQP-4在血管周围AST足突、胞膜及胞浆内均有表达,着色较模型组浅。见图4。
模型组AQP-4的IOD明显高于假手术组(P< 0.01),亚甲基蓝组AQP-4的IOD明显低于模型组(P< 0.01)。见表1。
2.2.4免疫荧光双标染色
其中GFAP阳性染色呈红色,AQP-4阳性染色呈绿色,DAPI阳性为呈蓝色的细胞核,染色结果显示GFAP与AQP-4在AST突起上共表达,假手术组AQP-4主要表达在血管周围的AST足突,模型组及亚甲基蓝组AQP-4除在血管周围的AST足突表达外,在AST胞体及突起也表达较多。见图5。
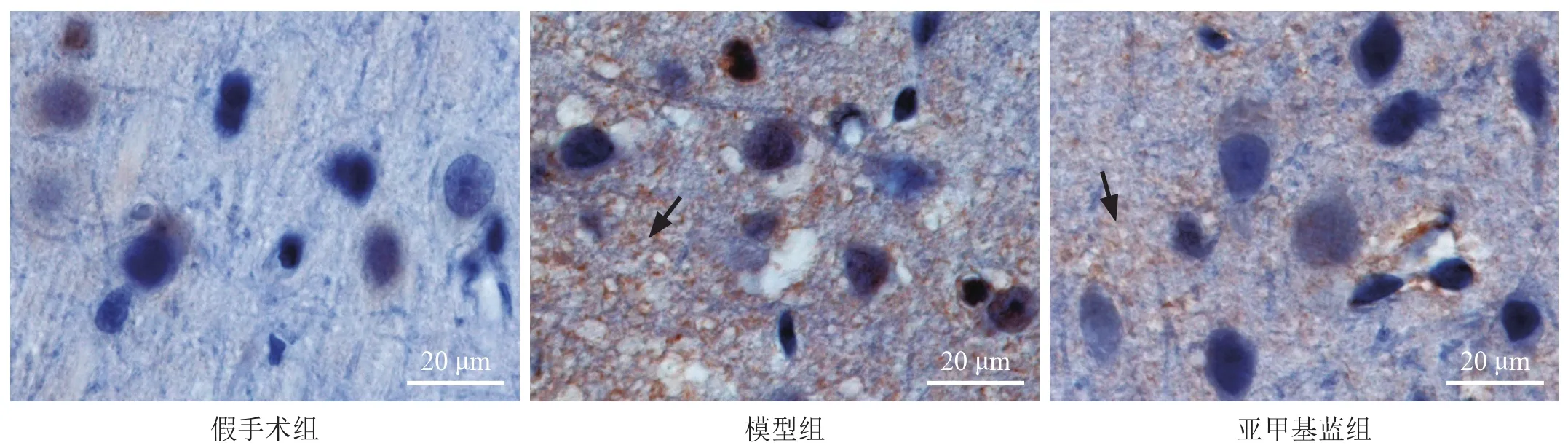
图2 脑缺血周边皮层组织白蛋白免疫组化染色(400×)
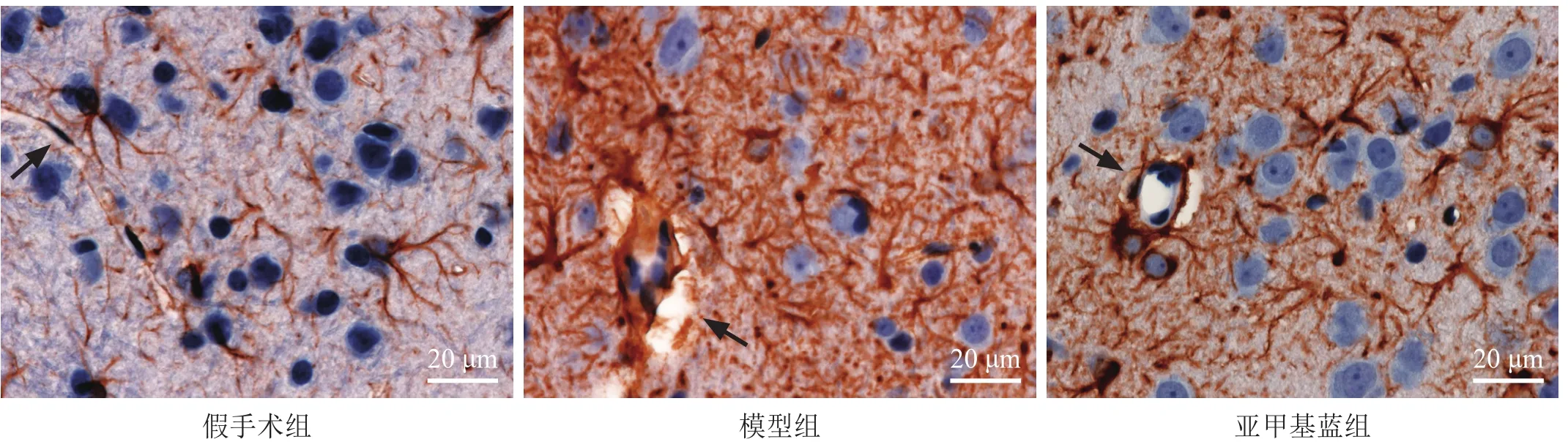
图3 脑缺血周边皮层组织GFAP免疫组化染色(400×)
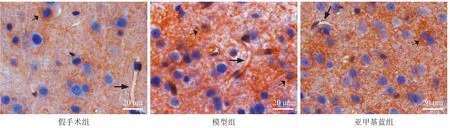
图4 脑缺血周边皮层组织AQP-4免疫组化染色(400×)
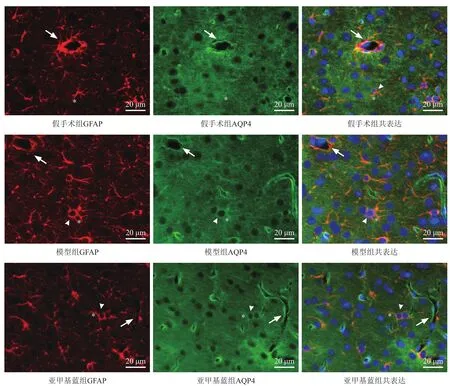
图5 脑缺血周边皮层组织GFAP与AQP-4免疫荧光双标染色(400×)
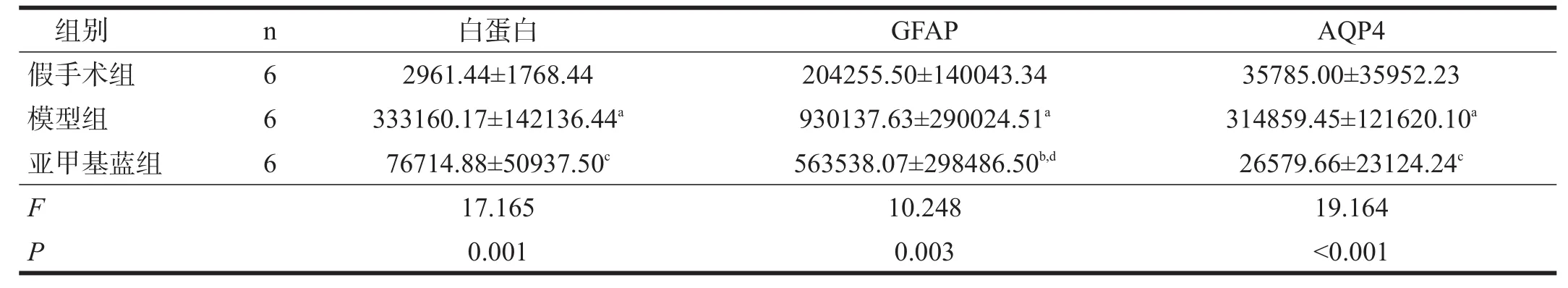
表1 脑缺血周边皮层组织白蛋白、GFAP和AQP-4表达(IOD)
3 讨论
在脑缺血再灌注损伤过程中,血脑屏障作为中枢神经系统“守门人”及调节器,其结构及功能均会遭到破坏,是导致脑损伤的关键环节[12],因此改善血脑屏障的结构及功能是脑缺血治疗的重点。本实验利用大鼠局灶性脑缺血1 h再灌注47 h模型,首先通过HE染色证明亚甲基蓝对大鼠脑缺血再灌注损伤有保护作用,其次通过检测缺血周边大脑皮层血脑屏障通透性以及GFAP、AQP-4等蛋白的表达变化,发现亚甲基蓝对脑缺血再灌注引起的血脑屏障损伤有保护作用。
血脑屏障功能障碍表现为血脑屏障通透性增加。血清白蛋白是血液中分子量为65 kDa的内源性蛋白质,正常生理情况下由于血脑屏障的存在难以漏出到脑实质内。血脑屏障遭到破坏,会导致血清白蛋白从血管漏出到脑实质内[13-14],因此检测白蛋白漏出成为经典的评价血脑屏障通透性的指标[10]。
近些年的研究发现AQP-4是脑内最丰富的水通道蛋白,主要表达在AST足突上,对维持血脑屏障完整性起重要作用[15]。我们在大鼠自由落体脑损伤模型中也观察到,脑外伤引起血脑屏障通透性增加时,AQP-4表达增强[16]。因此AQP-4也被认为是反映血脑屏障血管通透性的特异性标志物[17]。
本实验分别利用白蛋白及AQP-4免疫组化染色法评估血脑屏障通透性的改变,发现脑缺血再灌注损伤引起血脑屏障通透性增加,亚甲基蓝治疗可以显著减少白蛋白漏出及AQP-4表达增强,提示亚甲基蓝能够改善脑缺血再灌注损伤引起的血脑屏障破坏,与Miclescu等在猪的心脏骤停再灌注模型中观察到的亚甲基蓝对血脑屏障的保护作用一致[8]。
血脑屏障由毛细血管内皮细胞、细胞外基质、AST足突和周细胞组成,阻止有毒物质扩散进入脑组织,从而保护脑内微环境稳定。现有的研究表明AST足突为血脑屏障提供结构和功能支持[18],与血脑屏障的形成及通透性密切相关[19]。Miclescu等的研究表明亚甲基蓝对血脑屏障的改善作用可能是通过减少脑组织内的一氧化氮代谢产物实现的[8],本研究从AST角度探讨亚甲基蓝对血脑屏障的保护机制。
近年来的研究发现AST反应性增生与血脑屏障通透性增加有关[20]。本实验中我们用GFAP免疫组化染色法检测AST,观察到大鼠局灶性脑缺血再灌注引起GFAP表达增加,AST形态发生改变,表现为增生、肥大,说明脑缺血再灌注引起AST反应性增生。金媛媛等[21]、李德洁等[22]在大鼠脑缺血再灌注损伤模型中对GFAP表达变化的描述与我们的研究结果一致。Argaw等的研究表明,反应性增生的AST分泌血管内皮生长因子A(vascular endothelial growth factor- A, VEGF-A)增多,VEGF-A能够增加血脑屏障的通透性从而导致血脑屏障破坏[23]。本实验中我们同时观察到正常情况下AST突起细长,足突包绕毛细血管,而脑缺血再灌注引起的AST反应性增生,导致AST突起增粗增厚,足突缩短,血管周围间隙增宽。Mani等利用VEGF诱导AST反应性增生也观察到AST足突从血管处缩回的现象[24]。有研究表明毛细血管内皮细胞之间的紧密连接由AST足突与血管接触诱导产生[25-26],因此我们推测反应性增生的AST足突从血管处缩回也可能是大鼠局灶性脑缺血再灌注引起血脑屏障通透性增加的原因之一。
值得注意的是,近些年的研究发现AQP-4表达增加与AST反应性增生有直接关系[17],本实验也观察到相同的现象。我们应用GFAP与AQP-4免疫荧光双标染色发现正常情况下AQP-4主要表达在血管周围的AST足突,大鼠局灶性脑缺血再灌注引起AQP-4在AST足突及胞体表达增多,与GFAP表达增加一致。
因此,脑缺血再灌注引起AST增生(包括AST足突缩回)以及AQP-4表达增加可能导致血脑屏障功能破坏,亚甲基蓝干预减轻了大鼠局灶性脑缺血再灌注引起的AST过度增生及AQP-4表达增加,可能与亚甲基蓝对血脑屏障的保护作用有关。
我们已有的研究结果表明,亚甲基蓝是一种线粒体电子载体的替代物[27],能够改善局灶性脑缺血1 h再灌注47 h引起的脑水肿[4]。本实验进一步发现亚甲基蓝对脑缺血再灌注引起的血脑屏障障碍有改善作用,推测亚甲基蓝对血脑屏障的保护作用可能是通过减轻AST反应性增生及下调AQP-4表达实现的,但其分子机制还有待深入研究。本研究结果为缺血性脑卒中的治疗提供了新的思路。
[参考文献]
[1] Fang W, Sha L, Kodithuwakku ND, et al. Attenuated blood-brain barrier dysfunction by XQ-1H following ischemic stroke in hyperlipidemic rats [J]. Mol Neurobiol, 2015, 52(1): 162-175.
[2] Oz M, Lorke DE, Hasan M, et al. Cellular and molecular actions of methylene blue in the nervous system [J]. Med Res Rev, 2011, 31(1): 93-117.
[3] Ryou MG, Choudhury GR, Li W, et al. Methylene blue- induced neuronal protective mechanism against hypoxia-reoxygenation stress [J]. Neuroscience, 2015, 301: 193-203.
[4] Fang Q, Yan X, Li S, et al. Methylene blue ameliorates ischemia/reperfusion-induced cerebral edema: An MRI and transmission electron microscope study [J]. Acta Neurochir Suppl, 2016, 121: 227-236.
[5] Shen Q, Du F, Huang S, et al. Neuroprotective efficacy of methylene blue in ischemic stroke: an MRI study [J]. PLoS One, 2013, 8(11): e79833.
[6] Di Y, He YL, Zhao T, et al. Methylene blue reduces acute cerebral ischemic injury via the induction of mitophagy [J]. Mol Med, 2015, 21: 420-429.
[7] Jiang Z, Watts LT, Huang S, et al. The effects of methylene blue on autophagy and apoptosis in MRI-defined normal tissue, ischemic penumbra and ischemic core [J]. PLoS One, 2015, 10(6): e0131929.
[8] Miclescu A, Sharma HS, Martijn C, et al. Methylene blue protects the cortical blood-brain barrier against ischemia/reperfusion- induced disruptions [J]. Crit Care Med, 2010, 38(11): 2199-2206.
[9]徐立新,袁芳.改良的大鼠脑局部缺血模型[J].中国康复理论与实践, 2005, 11(1): 23-24.
[10] Fritze K, Sommer C, Schmitz B, et al. Effect of global system for mobile communication (GSM) microwave exposure on blood-brain barrier permeability in rat [J]. Acta Neuropathol, 1997, 94(5): 465-470.
[11] Simard M, Nedergaard M. The neurobiology of glia in the context of water and ion homeostasis [J]. Neuroscience, 2004, 129 (4): 877-896.
[12] Sandoval KE, Witt KA. Blood-brain barrier tight junction permeability and ischemic stroke [J]. Neurobiol Dis, 2008, 32(2): 200-219.
[13] Stam R. Electromagnetic fields and the blood- brain barrier [J]. Brain Res Rev, 2010, 65(1): 80-97.
[14] Takata F, Tominaga K, Koga M, et al. Elevated permeability of the blood-brain barrier in mice intratracheally administered porcine pancreatic elastase [J]. J Pharmacol Sci, 2015, 129(1): 78-81.
[15] Chu H, Ding H, Tang Y, et al. Erythropoietin protects against hemorrhagic blood-brain barrier disruption through the effects of aquaporin-4 [J]. Lab Invest, 2014, 94(9): 1042-1053.
[16]张琳,袁芳.大鼠脑外伤诱导水通道蛋白4表达增强加重脑水肿[J].首都医科大学学报, 2008, 29(6): 732-736.
[17] Ceccariglia S, D'altocolle A, Del Fa A, et al. Increased expression of aquaporin 4 in the rat hippocampus and cortex during trimethyltin- induced neurodegeneration [J]. Neuroscience, 2014, 274: 273-288.
[18] Obermeier B, Daneman R, Ransohoff RM. Development, maintenance and disruption of the blood-brain barrier [J]. Nat Med, 2013, 19(12): 1584-1596.
[19] Daneman R, Prat A. The blood-brain barrier [J]. Cold Spring Harb Perspect Biol, 2015, 7(1): a020412.
[20] Cheslow L, Alvarez JI. Glial-endothelial crosstalk regulates blood-brain barrier function [J]. Curr Opin Pharmacol, 2015, 26: 39-46.
[21]金媛媛,胡静,冯璐,等.局灶性脑缺血再灌注大鼠神经血管单元的空间构筑[J].中国康复理论与实践, 2015, 21(1): 31-34.
[22]李德洁,范建中,吴红瑛,等.低声压级次声对大鼠脑缺血再灌注后胶质纤维酸性蛋白表达的影响[J].中国康复理论与实践, 2013, 19(2): 124-128.
[23] Argaw AT, Gurfein BT, Zhang Y, et al. VEGF-mediated disruption of endothelial CLN- 5 promotes blood- brain barrier breakdown [J]. Proc Natl Acad Sci U S A, 2009, 106(6): 1977-1982.
[24] Mani N, Khaibullina A, Krum JM, et al. Astrocyte growth effects of vascular endothelial growth factor (VEGF) application to perinatal neocortical explants: receptor mediation and signal transduction pathways [J]. Exp Neurol, 2005, 192(2): 394-406.
[25] Abbott NJ, Ronnback L, Hansson E. Astrocyte-endothelial interactions at the blood- brain barrier [J]. Nat Rev Neurosci, 2006, 7(1): 41-53.
[26] Miner JJ, Diamond MS. Mechanisms of restriction of viral neuroinvasion at the blood-brain barrier [J]. Curr Opin Immunol, 2015, 38: 18-23.
[27] Wen Y, Li W, Poteet EC, et al. Alternative mitochondrial electron transfer as a novel strategy for neuroprotection [J]. J Biol Chem, 2011, 286(18): 16504-16515.
Effect of Methylene Blue on Blood-brain Barrier after Focal Cerebral Ischemia-reperfusion in Rats
WU Min1, FANG Qing1, SHI Zhong-fang1, XU Li-xin1, DONG Li-ping1, YAN Xu1, YANG Shao-hua1,2, YUAN Fang1
1. Department of Pathophysiology, Beijing Neurosurgical Institute, Beijing Tiantan Hospital, Capital Medical University, Beijing 100050, China; 2. Department of Pharmacology and Neuroscience, University of North Texas Health Science Center, Fort Worth, Texas 76107, USA
Correspondence to YUAN Fang. E-mail: florayuan@vip.sina.com
Abstract:Objective To investigate the protective effect of methylene blue (MB) on blood-brain barrier (BBB) injury after focal cerebral ischemia-reperfusion in rats. Methods 18 male Sprague-Dawley rats were randomly divided into sham-operated group (n=6), model group (n=6) and MB treatment group (n=6). The left middle cerebral arteries were occluded for 1 hour and reperfused. MB was infused intravenously immediately after reperfusion (3 mg/kg) and again 2 hours post-reperfusion (1.5 mg/kg), while normal saline was administered in the model group. The sham-operated group was treated as same as the model group without occlusion and infusion. HE staining was used to observe the histological injury in the cortex around the infarcted region 47 hours after reperfusion, while albumin immunohistochemistry was used to evaluate the permeability of the BBB, and immunohistochemistry and double immunofluorescence staining were used to examine the expressions of glial fibrillary acidic protein (GFAP) and aquaporin-4 (AQP-4). Results HE staining showed that cells and blood vessels were not intact in the cortex around the infarcted region in the model group and they were better in the MB treatment group. The expressions of the albumin, GFAP and AQP-4 were higher in the model group than in the sham-operated group (P<0.01), and were lower in MB treatment group than in the model group (P<0.05). The double immunofluorescence staining showed the colocalization of GFAP and AQP-4 in the astrocytes. Conclusion MB may ameliorate the BBB disruption induced by focal cerebral ischemia-reperfusion through reducing gliocyte proliferation and down-regulation of AQP-4 expression in rats.
Key words:cerebral ischemia-reperfusion; methylene blue; blood-brain barrier; glial fibrillary acidic protein; aquaporin-4; rats
(收稿日期:2015-12-01修回日期:2015-12-11)
基金项目:国家自然科学基金项目(No. 81271286; No. 81228009)。
DOI:10.3969/j.issn.1006-9771.2016.02.001
[中图分类号]R743.3
[文献标识码]A
[文章编号]1006-9771(2016)02-0125-07
