新疆薰衣草C-197优选优株快繁体系的建立及快繁
2016-03-17龚松旺玛尔哈巴吾斯满
廖 晴 ,龚松旺 ,玛尔哈巴·吾斯满 ,沙 红 ,高 燕
(1.新疆农业科学院园艺作物研究所,乌鲁木齐 830091;2.新疆霍城县农业技术推广站,新疆霍城 835200)
新疆薰衣草C-197优选优株快繁体系的建立及快繁
廖 晴1,龚松旺2,玛尔哈巴·吾斯满1,沙 红1,高 燕1
(1.新疆农业科学院园艺作物研究所,乌鲁木齐 830091;2.新疆霍城县农业技术推广站,新疆霍城835200)
摘要:【目的】选择新疆薰衣草主栽品种C-197优选优株,并建立快繁体系,研究新疆薰衣草种质资源提纯技术的有效途径,为提高新疆薰衣草产量及质量提供技术支撑。【方法】采用新疆薰衣草C-197优选优株作为外植体材料,进行无菌苗诱导,在培养基中加入不同激素及不同浓度的激素进行丛生苗和生根的诱导,建立其快繁体系。运用快繁体系获得大量优质新疆薰衣草C-197种苗。【结果】在选取薰衣草外植体诱导时,选用优选优株茎段或茎尖作外植体进行无菌苗诱导,诱导培养基为:MS+BA1.0 mg/L;继代培养基为:MS+BA1.0 mg/L+IBA0.3 mg/L;生根培养基为:1/2MS+NAA0.5~1.0 mg/L【结论】新疆薰衣草C-197的优选优株快繁体系的建立,提纯了薰衣草C-197的品种,可大量快繁C-197优质种苗。
关键词:新疆薰衣草;诱导;激素;快繁
0引 言
【研究意义】薰衣草是新疆特色经济花卉之一。据统计,我国每年消耗薰衣草精油70 t左右,其中2/3是新疆生产的,目前我国对薰衣草精油需求量以每年15%以上递增。我国薰衣草虽有几十年的栽培历史,栽培技术已相对完善,但栽培品种却严重退化混杂,生产量及质量在逐年下降,需要对薰衣草种质资源的优化。薰衣草是异花授粉植物,该群体异质性复杂,选择优良个体进行常规繁殖,优良性状是很难稳定遗传的。为获得较稳定的纯合后代和保证选择效果,对新疆主栽品种C-197进行种质的提纯和优化,选择C-197优选优株进行组培快繁试验,建立快繁体系,为薰衣草种质创新奠定坚实的基础。【前人研究进展】国外对薰衣草育种一直都很重视,除传统的系统育种外,还进行基因工程和多倍体育种研究。但我国对薰衣草的育种及优良品种的繁殖技术研究开展甚少。尤其在新疆受经济条件的制约,育种及优质种苗生产严重滞后,极大地限制了精油生产的深层次发展。针对目前新疆薰衣草产业亟待解决的种质混杂问题,通过生物技术手段-组培快繁技术,快速进行种质的提纯和优化,为优质种苗的大量生产提供可靠的技术支撑。【本研究切入点】目前对新疆薰衣草C-197进行优选优株的选择并进行快繁体系的建立研究未见报道。针对目前新疆薰衣草产业亟待解决的种质混杂问题,通过先进的生物技术手段-组培快繁技术,快速进行种质的提纯和优化,为优质种苗的大量生产提供可靠的技术支撑。【拟解决的关键问题】通过优选优株的组培快繁,提纯薰衣草品种的种质,在良好的种质基础上,通过诱导多倍体进行种质创新,拟解决目前新疆薰衣草产业中栽培品种严重退化混杂,生产量及质量在逐年下降的问题。
1材料与方法
1.1 材 料
以新疆薰衣草主栽品种C-197为试材,选取优选优株的茎段或茎尖做外植体。
1.2 方 法
1.2.1取C-197优选优株当年新发枝条的嫩茎部分,剪取7~10个节位,表面清洗干净后,再进行灭菌处理,消毒时间设5、7、10 min三个处理,将消毒好的材料剪成茎尖和茎段,各接10瓶,每瓶接4个外植体,接种在MS+BA 1.0 mg/L诱导培养基中,每天光照12 h,光照强度为1 600~2 000 lx,培养温度24~28℃,接种15 d后统计污染率。
1.2.2将外植体诱导出的无菌苗,剪切成3 cm的茎段,接种于MS培养基,添加不同水平的BA(0、0.5、1.0、1.5、2.0 mg/L)和MS+BA 1.0 mg/L加不同水平的IBA(0、0.1、0.3、0.5、1.0 mg/L)中,共10个处理,每瓶5株,设5个重复。每天光照12 h,光照强度为1 600~2 000 lx,培养温度24~28℃,接种30 d后统计增殖率。
1.2.3将增值后的试管苗,剪切成3 cm茎段,接种于1/2MS培养基,添加不同水平NAA(0、0.1、0.5、1.0、1.5 mg/L)和不同水平IAA(0、0.1、0.5、1.0、1.5 mg/L)及CCC(0、0.1、0.5、1.0、1.5 mg/L)组合,共15个处理,每瓶5株,设5个重复。每天光照12 h,光照强度为3 000~5 000 lx,培养温度24~28℃,接种25 d后统计生根率。
1.2.4将生根小植株洗去根部附着的残留培养基,移栽到4种不同基质(泥炭、泥炭与珍珠岩1∶1混合、蛭石、珍珠岩)中,每处理100株,待20~25 d后逐渐撤去薄膜,种苗正常管理并统计成活率。
2 结果与分析
2.1 外植体的灭菌效果
外植体无菌苗诱导15 d后,调查污染率。研究表明,不同灭菌时间对不同部位的灭菌效果有差异,茎尖灭菌7 min与灭菌10 min比较差异极显著,与灭菌5 min比较差异显著,茎尖灭菌7 min,污染率为17.5%;而茎段灭菌时间10 min与5 min比较差异极显著,与灭菌7 min比较差异显著,茎段灭菌10 min,污染率仅为5%。茎尖灭菌时间为7 min、茎段灭菌时间为10 min为宜。表1
表1不同时间对不同部位外植体灭菌效果
Table 1Effect of sterilizing on different parts of the explants
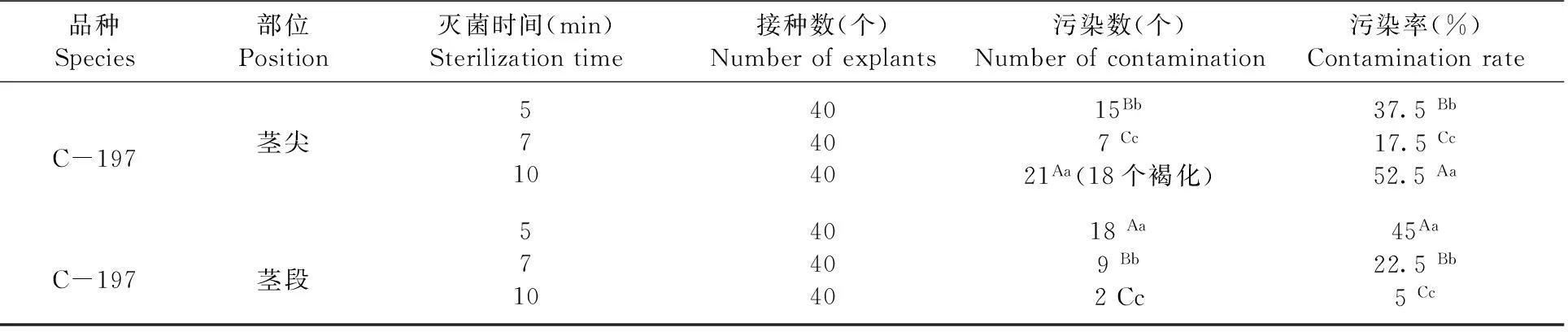
品种Species部位Position灭菌时间(min)Sterilizationtime接种数(个)Numberofexplants污染数(个)Numberofcontamination污染率(%)ContaminationrateC-197茎尖571040404015Bb7Cc21Aa(18个褐化)37.5Bb17.5Cc52.5AaC-197茎段571040404018Aa9Bb2Cc45Aa22.5Bb5Cc
2.2 不同激素种类和浓度梯度配比对不定芽增殖的影响
将无菌苗的茎段,接种于附加有不同激素种类和浓度梯度的MS培养基中,培养30 d后统计分化总芽数、新稍平均长度、茎平均粗度、愈伤平均直径、增值率。
研究表明,增殖培养基中添加的BA与IBA水平不同,芽的增殖率与长势存在着差异。在单因子试验中与对照比较,不定芽增殖率以添加BA 1.0、1.5 mg/L差异极显著;在多因子试验中与对照比较,BA 1.0 mg/L+IBA 0.3 mg/L差异极显著;对这三种配方的其它指标综合,以BA 1.0 mg/L+IBA 0.3 mg/L配方为最优,与单因子配方比较,其愈伤平均直径及新稍平均长度差异不显著,茎平均粗度差异显著,说明该配方愈伤组织小,丛芽壮,增殖效果更好。表2
表2不同激素浓度梯度配比下C-197不定芽增殖变化
Table 2Effect of C-197′s proliferation of adventitious on the different concentrations of hormones

培养基(mg/L)Medium接种数Numberofexplants(个)分化芽总数Budsdifferentiatednumber(个)不定芽的增殖率Theincrementrateofadventitiousbud(%)新梢平均长度Averagelengthofnewshoots(cm)茎平均粗度Averagethicknesofstems(cm)愈伤平均直径AverageDiameterofcallus(cm)MS(CK)MS+BA0.5MS+BA1.0MS+BA1.5MS+BA2.05555510Cc17Bb28Aa28Aa27Aa100Dd240Cc460Aa460Aa440Bb28.698Cd35.191ABb33.064Bc36.378Aa34.567Bbc0.515Dd0.526Cc0.542Bb0.515Dd0.611Aa2.667Dd1.798Cc3.350Bb4.884Aa3.130BbMS+BA1.0(CK)MS+BA1.0+IBA0.1MS+BA1.0+IBA0.3MS+BA1.0+IBA0.5MS+BA1.0+IBA1.05555528Cc36Bb42Aa25Cc21Dd460Cc620Bb740Aa400Dd320Ee33.064Aa27.116Bc21.678Cd29.023Bb22.760Cd0.542Bc0.611Aa0.570Bb0.510Cd0.484Cd3.350Aa2.856Cc1.964Dd3.104Bb1.902Dd
2.3 不同激素浓度梯度对试管苗生根的影响
将增值后的试管苗,剪切成3 cm的茎段,接种于附加有不同激素浓度梯度的1/2MS培养基中,接种20 d后统计生根总数、新稍长度、茎粗及根长度。
研究表明,在1/2MS培养基中添加不同浓度的NAA对生根质量有一定的差异。添加NAA 1.0 mg/L时,除了新梢平均长度与对照相比差异不显著外,其它几项指标均为极显著。实际工作中,根太粗、太长都不利于移栽,因而以添加NAA 0.5 mg/L较适宜。单独添加CCC也能生根,但除添加CCC 1.5 mg/L时差异显著外,其他处理差异均不显著。添加IAA 0.5~1.0 mg/L虽对薰衣草的枝条生长差异显著,但不能诱导生根。因此,在薰衣草不定根诱导培养中,1/2MS培养基中添加NAA 0.5~1.0 mg/L生根效果好。表3
表3不同激素浓度梯度下C-197试管苗生根变化
Table 3Effect of C-197′s rooting on different concentrations of hormones.

培养基(mg/L)Medium接种数Numberofexplants(个)生根总数Roottotal(条)新梢平均长度Averagelengthofnewshoots(cm)茎平均粗度Averagethicknesofstems(cm)根平均数Averagenumberofroot(条)根平均长度Averagelengthofroot(cm)1/2MS(CK)1/2MS+NAA0.11/2MS+NAA0.51/2MS+NAA1.01/2MS+NAA1.5555558Dd14Cc19Bb27Aa17Bb28.698Dd35.852Cc43.164Bb34.312Cc49.061Aa0.515De0.779Bb0.716Cc0.920Aa0.634Cd2.70Dd3.50Cc6.30Bb6.75Aa3.40Cc1.410Cd2.291Bc2.717Ab2.847Aa2.917Aa1/2MS+CCC0.11/2MS+CCC0.51/2MS+CCC1.01/2MS+CCC1.555555Bb1Cc2BCc11Aa42.066Cc38.998Cd62.805Aa52.143Bb0.619Bb0.705Aa0.595Bb0.685Aa1.0Bb0.2Cc0.4Cc2.2Aa0.94Cd1.20Bc1.50Aa1.31Bb1/2MS+IAA0.11/2MS+IAA0.51/2MS+IAA1.01/2MS+IAA1.55555无无无无31.621Bb38.476Aa39.058Aa40.635Aa0.498Bb0.649Aa0.650Aa0.438Bc无无无无无无无无
2.4 不同基质对薰衣草C-197移栽成活率的影响
将生根的小植株洗去根部附着的残留培养基,移栽在不同的基质(泥炭、泥炭与珍珠岩1∶1混合、蛭石、珍珠岩)中,移栽30 d后统计成活率。
在园土中试管苗移栽成活率较低,虽然能正常生长,但苗黄;在山土中试管苗移栽成活率较高,生长正常,但速度较慢;在进口草炭土中试管苗移栽成活率为100%;在草炭土+珍珠岩中试管苗移栽成活率高,苗生长速度快,比纯草炭土中要快。用草炭土+珍珠岩移栽是最理想的。表4
表4不同基质下C-197试管苗移栽成活率变化
Table 4 Effect of C-197′s transplanting plantlets from culture vessel on different base materials
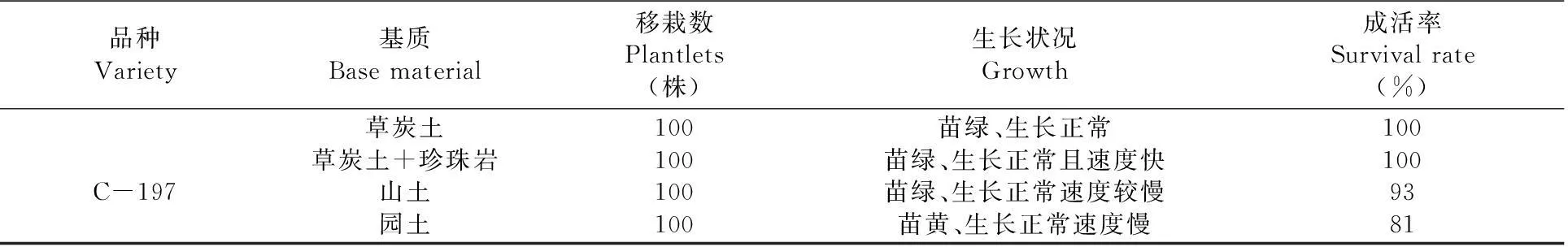
品种Variety基质Basematerial移栽数Plantlets(株)生长状况Growth成活率Survivalrate(%)C-197草炭土草炭土+珍珠岩山土园土100100100100苗绿、生长正常苗绿、生长正常且速度快苗绿、生长正常速度较慢苗黄、生长正常速度慢1001009381
3讨 论
3.1在选择外植体诱导时,取植株的什么部位进行诱导是诱导快慢、成否的决定因素之一,通过对薰衣草C-197不同部位的外植体诱导试验,发现不同部位灭菌效果有一定的差异:茎尖诱导不定芽速度最快,但灭菌时间不好掌握,时间短消毒不彻底,时间稍长又会使幼嫩的组织被破坏产生褐化,对茎尖灭菌时间为7 min效果较好,污染率为17.5%,灭菌时间到10 min左右,易将幼嫩的组织破坏产生褐化而死亡,污染率高达52.5%;而对茎段灭菌时间为10 min效果较好,污染率最低为5%,灭菌5 min,消毒不彻底,污染率37.5%以上。用幼嫩的茎段作外植体诱导比较好。
3.2在增殖培养中,培养基中添加的BA与IBA水平不同,芽的增殖率与长势存在显著差异。增殖率与BA浓度密切相关,在试验浓度范围内,增殖率先随BA浓度的升高呈升高趋势,但BA浓度过高时,增殖率有所下降,且芽的长势减弱。后续试验表明,BA浓度大于2.0 mg/L时,随继代次数增加,不定芽易出现玻璃化现象,不利于后期成苗。当BA浓度为1.5 mg/L时虽然分化率、生长高度比BA浓度为1.0 mg/L时高或相当,但其茎的粗度较小、愈伤较大,BA浓度为1.0 mg/L时增殖效果为最优;增殖率与IBA浓度亦表现出一定的相关性,同时添加BA 1.0 mg/L和IBA的梯度试验中,试验浓度范围内,当IBA浓度为0.3 mg/L时增殖率最高,且愈伤小,丛芽壮。因此,薰衣草不定芽增殖培养中,在MS培养基中同时添加BA 1.0 mg/L和IBA 0.3 mg/L增殖效果好。
3.3不同激素及浓度梯度对试管苗生根的影响是不同的,在不添加激素时,C-197也可以生根,但根的质量差,添加NAA有利于根的诱导,随着添加NAA的浓度升高,试管苗分化出的根条数也随之增多、增长,但NAA浓度过高时,生根率有所下降,且根的长势减弱,虽然在添加NAA 1.0 mg/L时,比起添加NAA 0.5 mg/L的各项根生长指标更优,但根粗易断,根长影响移栽,添加NAA 0.5 mg/L更好一些;只添加CCC虽也能生根,在试验浓度范围内生根率比添加NAA的低;只添加IAA是不能诱导薰衣草生根的。因此,在薰衣草不定根诱导培养中,1/2MS培养基中添加NAA 0.5~1.0 mg/L生根效果好。另外,在薰衣草生根试验中,发现单枝不如3~5枝一丛的生根容易,这可能与枝条的幼嫩程度有关。
3.4在园土中试管苗移栽成活率较低,虽然能正常生长,但苗黄,可能与土的粘重有关,也有可能是缺素的原因或有机质含量低的问题,需进一步研究;在山土中试管苗移栽成活率较高,生长正常,但速度较慢;在草炭土中试管苗移栽成活率为100%;在草炭土+珍珠岩中试管苗移栽成活率高,苗生长速度快,比纯草炭土中要快。用草炭土+珍珠岩移栽是比较理想的,但由于进口草炭土价格昂贵,因而,在考虑生产成本时,用山土最为适宜。
4结 论
新疆薰衣草C-197的优选优株快繁体系的建立,提纯了薰衣草C-197的品种,从而可大量快繁出C-197的优质种苗,通过该方法可解决目前新疆薰衣草产业中栽培品种严重退化混杂,生产量及质量在逐年下降的问题。选用优选优株的茎段作外植体进行无菌苗诱导时,茎尖灭菌时间为7 min、茎段灭菌时间为10 min为宜;诱导培养基为:MS+BA 1.0 mg/L;继代培养基为:MS+BA 1.0 mg/L+IBA 0.3 mg/L;生根培养基为:1/2MS+NAA 0.5~1.0 mg/L。
参考文献(References)
[1]孙会兵,孙永竹,刘心力.矮壮素对孟士德薰衣草组培苗的影响[J].山西农业科学,2011,39(11):1 141-1 142,1 145.
SUN Hui- bing, SUN Yong- zhu, LIU Xin-li. (2011). Effect of CCC on Tissue Culture Seedling of L. angustifolia Munstead [J].JournalofShanxiAgriculturalSciences, 39(11): 1,141- 1,142 ,1,145. (in Chinese)
[2]戴丽娜,于志鹏,吕国华,等.薰衣草玻璃化组培苗逆转技术研究[J].新疆农业科学,2012,49(11):2 054-2 061
DAI Li-na, YU Zhi-peng, LV Guo-hua, et al. (2012).The Study on Reversal Technique of Vitreous Tissue culturing Plantlets of Lavender [J].XinjiangAgriculturalSciences, 49(11): 2,054-2,061. (in Chinese)
[3]苏琛.薰衣草离体培养技术研究[J].湖北农业科学,2012,51(3):623-625.
SU Chen. (2012). Study on in vitro Cultivation of Lavandula angustifolia [J].HubeiAgricuhuralSciences, 51(3): 623-625. (in Chinese)
[4]江明,夏凯国,易清元.薰衣草的育种研究进展[J].香料香精化妆品,2009,8(4):30-32.
JIANG Ming, XIAKai-guo, YI Qing-yuan. (2009). The Study on Development of Breeding of Lavender [J].FlavourFragranceCosmetics, 8(4): 30-32. (in Chinese)
[5] Urwin, N. A. R., Horsnell, J., & Moon, T. (2007). Generation and characterisation of colchicine-induced autotetraploid lavandula angustifolia.Euphytica, 156(1-2):257-266.
[6] Tsuro, M., Koda, M., & Inoue, M. (1999). Comparative effect of different types of cytokinin for shoot formation and plant regeneration in leaf-derived callus of lavender (lavandula vera dc).ScientiaHorticulturae,81(3): 331-336.
[7] Sudria CPinol, M. T., Palazon, J., Cusido, R. M., Vila, R., Morales, C., & Bonfill, M., et al. (1999). Influence of plant growth regulators on the growth and essential oil content of cultured lavandula dentata plantlets..PlantCellTissue&OrganCulture, 58(3):177-184.
[8]刘珊,陈全家,苏秀娟,等.英国薰衣草愈伤再生体系的建立[J].新疆农业科学,2010,47(1):73-77.
LIU Shan, CHEN Quan-jia, SU Xiu-juan, et al.(2010). Establishment of Callus Regeneration System of English Lavender [J].XinjiangAgriculturalSciences,47(1): 73-77. (in Chinese)
[9] Tsuro, M., Koda, M., & Inoue, M. (2000). Efficient plant regeneration from multiple shoots formed in the leaf-derived callus of lavandula vera, using the "open culture system".ScientiaHorticulturae, 86(1):81-88.
[10]谢翠苹,倪孟羽,胡千云,等.薰衣草繁殖技术研究[J].北方园艺,2012,(18):110-111.
XIE Cui-ping, NI Meng-yu, HU Qian-yun, et al. (2012). Research on Breeding Technology of Lavandula angustifol [J].NorthernHorticulture, (18):110-111. (in Chinese)
[11] Andrade, L. B., Echeverrigaray, S., Fracaro, F., Pauletti, G. F., & Rota, L. (1999). The effect of growth regulators on shoot propagation and rooting of common lavender (lavandula vera dc).PlantCellTissue&OrganCulture, 56(2):79-83.
[12]王佳佳,郑凤英,王康,等.新西兰薰衣草快速繁殖技术的研究[J].北方园艺,2010,(12):161-163.
WANG Jia-jia, ZHENG Feng-ying, WANG Kang, et al. (2010).The Technology of Rapid Propagation of New Zealand Lavender [J].NorthernHorticulture, (12): 161-163. (in Chinese)
[13]路结,王朴 ,蒋新明,等.新疆不同品种的薰衣草精油成分及含量研究[J].安徽农业科学,2013,41(4):1 736-1 737,1 739.
LU Zhe, WANG Pu, JIANG xin-ming, et al.(2013). Study on Composition and Content of Essential oil from Three Lavender Varieties in Xinjiang [J].JournalofAnhuiAgriculturalScience, 41(4):1,736-1,737 ,1,739. (in Chinese)
[14]王婵,陈丽娟,程明华,等.狭叶薰衣草离体培养技术研究[J].海南师范大学学报(自然科学版),2012,25(4):435-437,469.
WANG Chan, CHEN Li-juan, CHENG Ming-hua, et al.(2012). Study on in Vitro Cultivation of Lavandula angustifol [J].JournalofHainanNormalUniversity(NaturalScienceEdition), 25(4):435-437 ,469.(in Chinese)
[15] Teuscher, E., Bauermann, U., Werner, M., Brinckmann, J. A., Lindenmaier, M. P., & Duke, J. A. (2005). Medicinal spices : a handbook of culinary herbs, spices, spice mixtures and their essential oils.Medpharm, CRC Press.
Fund project:Supported the Basic Science and Technology Research Support Funds of Non-profit Research Institutions of Xinjiang Uygur Autonomous Region (KY2014033)
The Establishment of the Fast Propagation System and Rapid
Propagation for the Optimal Strains of C-197 Xinjiang Lavender
LIAO Qing1, GONG Song-wang2, Marbaha Wsman1, SHA Hong1, GAO Yan1
(1.ResearchInstituteofHorticulturalCrops,XinjiangacademyofAgriculturalSciences,Urumgi830091,China: 2.HuochengCountyAgriculturalTechnologyExtensionStation,HuochengXinjiang835200,China)
Abstract:【Objective】 To explore the effective way to purify Xinjiang lavender germplasm resources and establish rapid propagation system in the hope of providing reliable technical support to improve the quality of Xinjiang lavender production through choosing optimal strain of C-197, a major cultivation variety in Xinjiang. 【Method】 The optimal strain of C-197 was used as primal explant, then buds and roots were induced into different medium with different hormones and different concentrations were applied to establish rapid propagation system. A large number of high-quality C -197 plants were quickly got using the rapid propagation system. 【Result】 During selecting lavender explant induction, stem segments and stem tip of optimal plant as explant, adventitious buds induction medium was: MS+BA 1.0 mg/L; subculture medium was: MS + BA 1.0 mg/L + IBA 0.3 mg/L; root induction medium was: 1/2MS+NAA 0.5-1.0 mg/L. 【Conclusion】 Through the establishment of rapid propagation system, C -197 variety was purified and a large number of high-quality C-197 plants were got.
Key words:Xinjiang lavender; induction; hormones; rapid propagation
作者简介:廖晴(1962-),女,四川安岳人,副研究员,研究方向为花卉引、种、繁及植物组培快繁,(E-mail)lq08270029@sina.com
基金项目:新疆维吾尔自治区公益性科研项目(KY2014033)
收稿日期:2015-09-04
中图分类号:S68
文献标识码:A
文章编号:1001-4330(2016)02-0289-06
doi:10.6048/j.issn.1001-4330.2016.02.014
