增温对不同生育期棉花叶片中抗氧化酶活性及根系吸收能力的影响
2016-03-17孟阿静王治国付彦博冯耀祖饶晓娟
孟阿静, 王治国,付彦博,冯耀祖,饶晓娟,3
(1.新疆农业科学院拜城农业试验站,新疆拜城,842301;2.新疆农业科学院土壤肥料与农业节水研究所/绿洲养分与水
土资源高效利用重点实验室,乌鲁木齐,830091;3.新疆农业职业技术学院,新疆昌吉831100)
增温对不同生育期棉花叶片中抗氧化酶活性及根系吸收能力的影响
孟阿静1,2, 王治国2,付彦博2,冯耀祖2,饶晓娟2,3
(1.新疆农业科学院拜城农业试验站,新疆拜城,842301;2.新疆农业科学院土壤肥料与农业节水研究所/绿洲养分与水
土资源高效利用重点实验室,乌鲁木齐,830091;3.新疆农业职业技术学院,新疆昌吉831100)
摘要:【目的】增加棉花根际培养温度,研究增温对各时期叶片抗氧化酶活性及根系活力的影响。【方法】水培条件下,在棉花苗期、蕾期、初花期、花铃期4个时期,设置恒温30℃和常规水培培养2个水平3个重复,各时期培养10 d,研究不同时期叶片抗氧化酶活性及根系活力对温度的响应。【结果】初花期时,增温处理可以有效增加超氧化物歧酶(SOD)、过氧化氢酶(CAT)活性和过氧化物酶(POD)活性,降低丙二醛(MDA)含量,根系活跃吸收面积亦显著增大;苗期和蕾期增温处理与常规比较,SOD、POD酶活性及MDA含量差异不大,但苗期时根系活跃吸收面积显著增加,蕾期时CAT酶活性显著增强;花铃期增温对叶片抗氧化酶和根系活力有明显抑制作用。【结论】棉花初花期时增加培养温度有助于棉花生长发育,而花铃期增温会对棉花生长造成胁迫。
关键词:棉花;增温;抗氧化酶活性;根系吸收面积
0 引 言
【研究意义】棉花属于温度敏感型作物[1],温度过高会导致棉株呼吸强度增加,光合速率下降,从而引起光合产物缺失,棉株生理性早衰,最终导致减产[2-4],温度过低亦会引起棉花活性氧积累而引起氧化胁迫,导致棉花生长发育失调,品质下降等[5]。不同生育时期,控制适宜的生长温度,对棉花生长具有实际意义。【前人研究进展】适宜的生长条件可以使作物维持较高的叶片生理活性和根系生长活性[6],温度是调控作物生长发育的关键措施[1],研究表明:出苗期、现蕾期、开花期温度适宜度相对较高,对棉花生长有利。白旭等[7]研究表明,棉花种子最适萌发温度为30℃,从孙啸震等[8]研究可知花铃期日均温33.5~35.2℃,叶片POD、CAT活性大幅下降,MDA含量显著升高。说明花铃期温度过高不利于光合产物的积累,对棉花生长造成胁迫。逯明辉等[9]研究表明低温胁迫下,黄瓜叶片的SOD、POD、CAT活性均显著降低,由此可知作物在不同温度下氧化酶活性表现不一致,过高或过低温度均会对作物生长造成胁迫。国外有学者采用人工控温设施研究根温对植物生长的影响,认为植物生长对根温有较敏感的反应[10]。任志雨等[11]研究温度对黄瓜生长和生理代谢的影响,试验设置了15、20和25℃三个根区温度,结果表明随着黄瓜根区温度的升高,黄瓜的生理代谢能力及产量都显著增加。王克安等[12]研究发现温度对黄瓜幼苗影响很大,当昼夜温度降到20℃/10℃,根系活力将明显受到抑制。【本研究切入点】 棉花为喜温作物,不同生育时期适当增加培养温度可以增加棉花抗氧化酶活性,降低MDA含量,增强根系活力,从而提升棉花的种植效率。目前研究多关注于当作物受到逆境胁迫时(比如低温、盐分、干旱、重金属胁迫等)抗氧化酶活性的变化情况,而对有益于作物生长的环境下抗氧化酶活性的变化情况报道较少。【拟解决的关键问题】通过水培试验,增加根区温度,检测不同生育时期内棉花叶片氧化酶活性、MDA含量及根系吸收面积,确定棉花最佳增温时期。
1 材料与方法
1.1 材 料
水培试验于2014年7月在新疆农科院灰漠土基地网室中进行。网室日光照基本维持12 h,室内昼夜温度18~30℃。棉花供试品种为新陆早41号。水培盆规格:长×宽×高=50 cm×35 cm×20 cm;所用水源统一为井水。营养液配方参照霍格兰营养液[13]。
1.2 方 法
1.2.1 试验设计
种子沙培育苗:先用5%次氯酸钠浸泡5 min,蒸馏水洗净,在55℃温水浸泡30 min后备用。石英砂洗净晾干,装入盆中,每盆6 kg。将处理过的种子置于石英砂中,覆盖深度约2 cm,种子间间隔为2 cm,覆膜后于光照培养箱中光照12 h,30℃;黑暗12 h,25℃培养。当幼苗长出第一片真叶时移入水培中培养。
幼苗水培培养:制作泡沫隔板,规格为长49 cm,宽33 cm,隔板上均匀打15个洞,将泡沫板放入水培盆中,将长势一致的幼苗移入水培盆中,每洞一株幼苗,用海绵固定培养,每隔7 d换一次营养液,每隔4 h冲一次氧,每次冲氧时间30 min,培养至根长为8~10 cm时进行处理。
处理:分增温处理(ZW)和常规处理(CK)。增温处理在盆底部放置恒温加热棒,将温度调控在30℃[14]培养。两处理中均放置U盘温度计,测定水中实时温度。处理分四个时期,每时期处理时间为10 d,每处理3次重复。
1.2.2取 样
用冰盒在08:00~09:00 进行取样,回实验室进行检测。取样时间分别为:7月24日(苗期),8月14日(蕾期),9月4日(初花期),9月24日(花铃期)。摘取棉花主茎功能叶(倒3 或4 最大展开叶)。
将需测根系植株取出,留下根部,用自来水冲洗干净,放在滤纸上吸去多余水分后备用(测试地点同上)。
1.2.3 测定项目
酶液的提取及活性测定:称取鲜叶样品0.5 g于预冷的研钵中,加1 mL 0.05 moL/L pH 7.0磷酸缓冲液在冰浴上研磨成浆,加缓冲液使终体积为5 mL。将提取液于10 000 r/min分冷冻离心20 min,于0℃冰水中放置备用。采用氮蓝四唑(NBT)法测定SOD 活性[13],高锰酸钾滴定法测定CAT 活性[13],愈创木酚法测定POD 活性[13],硫代巴比妥酸比色法测定MDA 含量[13]。
根系吸收面积测定采用甲烯蓝法[13]。根干重:105℃杀青30 min,80℃烘干至恒重后称重。
1.3 数据统计
采用Microsoft Excel软件进行数据处理,用DPS 3.01软件进行数据统计分析和差异显著性检验。
2结果与分析
2.1 不同时期根际温度日变化
4个时期中增温处理下营养液温度日变化控制在29~31℃,对照温度变化为20~30℃。增温处理温度趋向于平稳,对照处理温度变化趋势为先降低后升高,每天08:00温度最低20~24℃,16:00~20:00温度最高,约26~30℃。图1
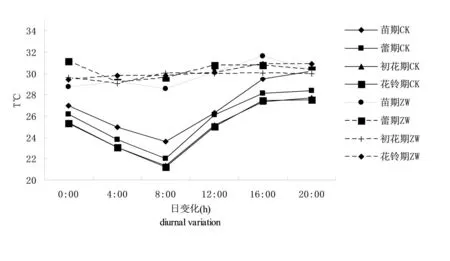
图1 不同生育时期根际温度日变化
Fig. 1 The diurnal variation of root-zone temperature during different growth stages
2.2 根际持续增温条件下,棉花主茎叶片抗氧化酶活性变化
2.2.1 SOD活性变化
4个生育时期,增温处理中随着棉花生长,叶片SOD活性不断增强,其中苗期至蕾期,SOD活性增长幅度较大,达到极显著性差异(P<0.01),这一变化趋势与对照处理基本一致。各时期增温处理下的SOD活性均略高于对照,但差异不显著(P>0.05),由此说明,增加培养温度可以适当增加叶片中SOD活性。图2
注:数值后不同大、小写字母分别表示差异达P<0.01 和P<0.05 显著性水平,下同
Note:Values followed by different capital and lowercase letters are significantly different atP<0.01 andP<0.05, respectively,the same as below
图2根际增温下棉花不同生育时期叶片SOD酶活性变化
Fig. 2 The effect of temperature increment on SOD of cotton leaves during different growth stages
2.2.2 POD活性变化
4个生育时期,POD的变化趋势为先升高后降低,即苗期到蕾期,POD活性趋于稳定,初花期活性明显升高,花铃期又显著降低;各生育时期增温处理与对照相比可以看出:苗期、蕾期、花铃期增温处理的POD活性均低于对照但差异不显著(P>0.05),而初花期增温处理POD活性明显高于对照,达极显著差异(P<0.01)。由此说明:苗期、蕾期、花铃期增加温度对叶片POD活性影响不大,初花期增加温度可以有效增加POD活性。图3

图3 根际增温下棉花不同生育时期叶片POD活性变化
Fig. 3The effect of temperature increment on POD of cotton leaves during different growth stages
2.2.3 CAT活性变化
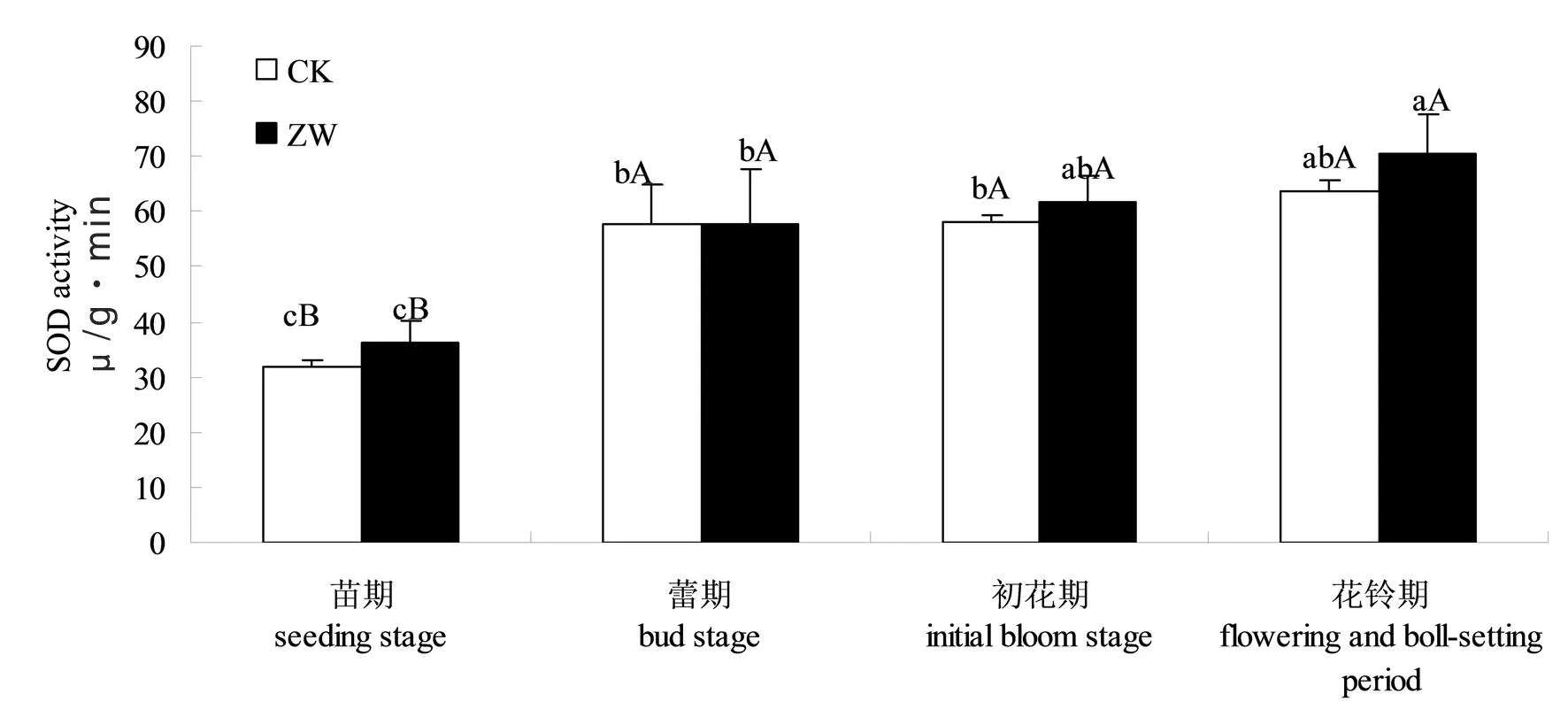
4个生育期,叶片CAT活性变化趋势为先升高后降低。各时期增温处理与对照相比:苗期时增温处理叶片CAT活性略低于对照,但未达到显著性差异(P>0.05),其余时期增温处理下CAT活性均高于对照处理,其中蕾期增温处理酶活性为18.82 μ/g,对照为9.62 μ/g,增温处理较对照酶活性增加9.20 μ/g,增幅达75.62%,达极显著性差异(P<0.01);初花期增温处理酶活性为20.66 μ/g,较对照增加8.49 μ/g,酶活性增加了69.76%,达极显著性差异(P<0.01)。这表明,棉花蕾期和初花期,增加培养温度可以有效增强棉花叶片清除过氧化氢的能力。图4
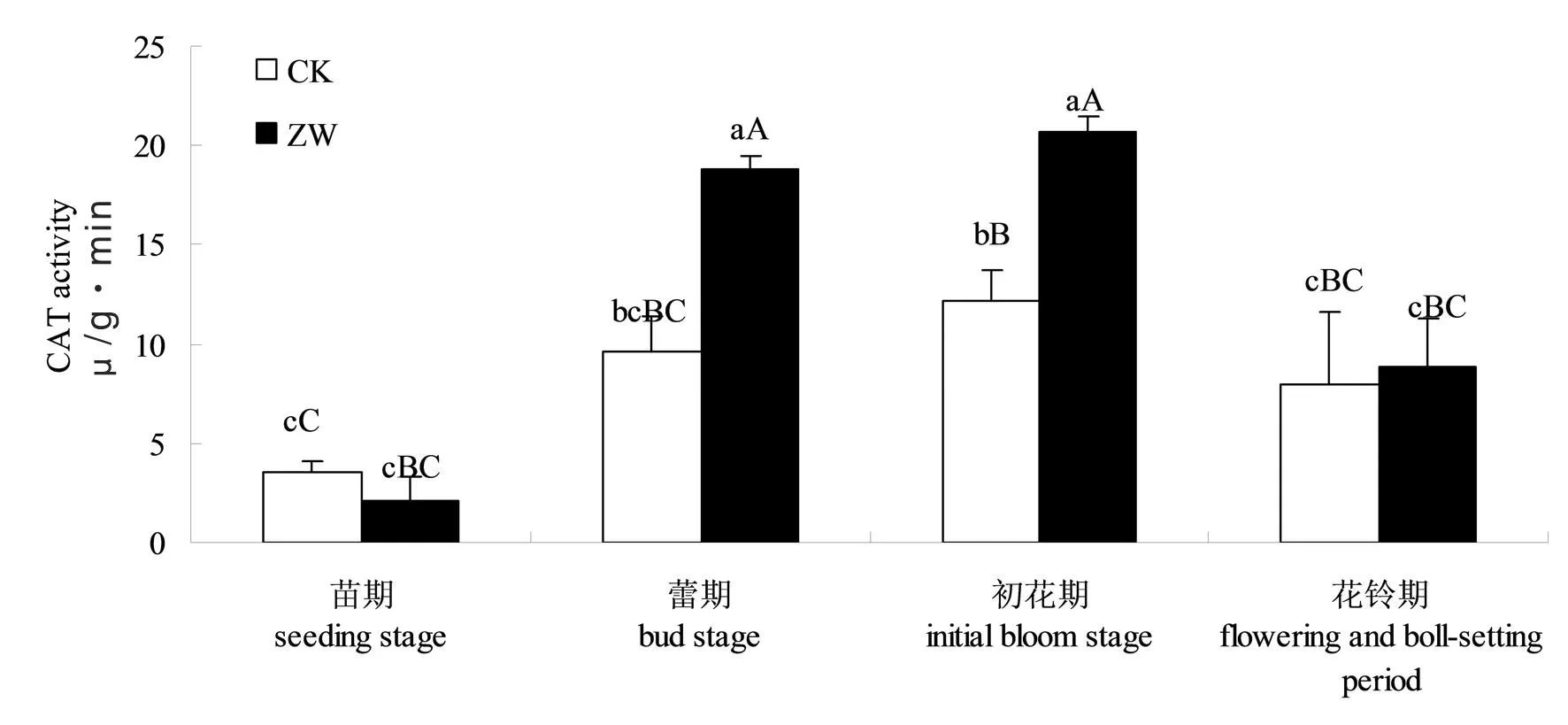
图4 根际增温下棉花不同生育时期叶片CAT活性变化
Fig. 4 The effect of temperature increment on CAT of cotton leaves during different growth stages
2.2.4 MDA含量变化
4个生育时期里MDA含量表现为先降低后增加。各生育时期内增温处理与对照相比较结果如下:苗期、蕾期、初花期增温处理较对照MDA含量有所降低,其中初花期常规处理MDA含量为7.25 nmol/g,增温处理为4.27 nmol/g,相比降幅达41.09%,但未达到显著性差异(P>0.05);花铃期时,增温处理下MDA含量达到24.10 nmol/g,对照为10.00 nmol/g,相比下处理间差异极显著(P<0.01),这说明,初花期时增加温度可以抑制膜脂过氧化作用,减少MDA对叶片的伤害,而花铃期时,增加培养温度将大大增加MDA含量,使叶片生长发育受到抑制。图5
2.3 根际增温对根干重及根系吸收面积的影响
2.3.1 根际持续增温对棉花根干重的影响
苗期增温处理根干重为0.861 g,相比于对照干物质增加0.3 g,增幅为53.52%,但并未达到显著性差异(P>0.05),蕾期增温处理干物质量为1.546 g,较对照增加了35.5%,亦未达到显著性差异(P>0.05),初花期增温处理干物质量为3.088 g,与对照相比增幅达41.97%,差异极显著(P<0.01),花铃期增温处理干重略高于CK,但二者差异很小。说明苗期、蕾期、初花期增加培养温度有利于根干物质积累。图6

图5根际增温下棉花不同生育时期叶片MDA含量变化
Fig. 5 The effect of temperature increment during the MDA content of cotton leaves at different growth stages
2.3.2 根际持续增温对根系吸收面积的影响
苗期增温处理下根体积、总吸收面积、活跃吸收面积分别较对照高出2.05、0.80、0.93倍;其中根体积与对照相比达到极显著水平(P<0.01),活跃吸收面积与对照相比达到显著性水平(P<0.05);蕾期时增温处理下的根系总吸收面积及活跃吸收面积均低于对照,但差异不显著(P>0.05);初花期时根体积、总吸收面积、活跃吸收面积分别是对照的1.07、1.14、2.78倍,均达到极显著性差异(P<0.01);花铃期根系吸收面积略高于对照面积,但活跃吸收面积显著高于对照,差异显著,苗期和初花期增温可以有效增加棉花总吸收面积和活跃吸收面积,促进根系的发育,而蕾期增温会抑制根系生长,花铃期增温对根系的活跃吸收面积具有积极作用。表1
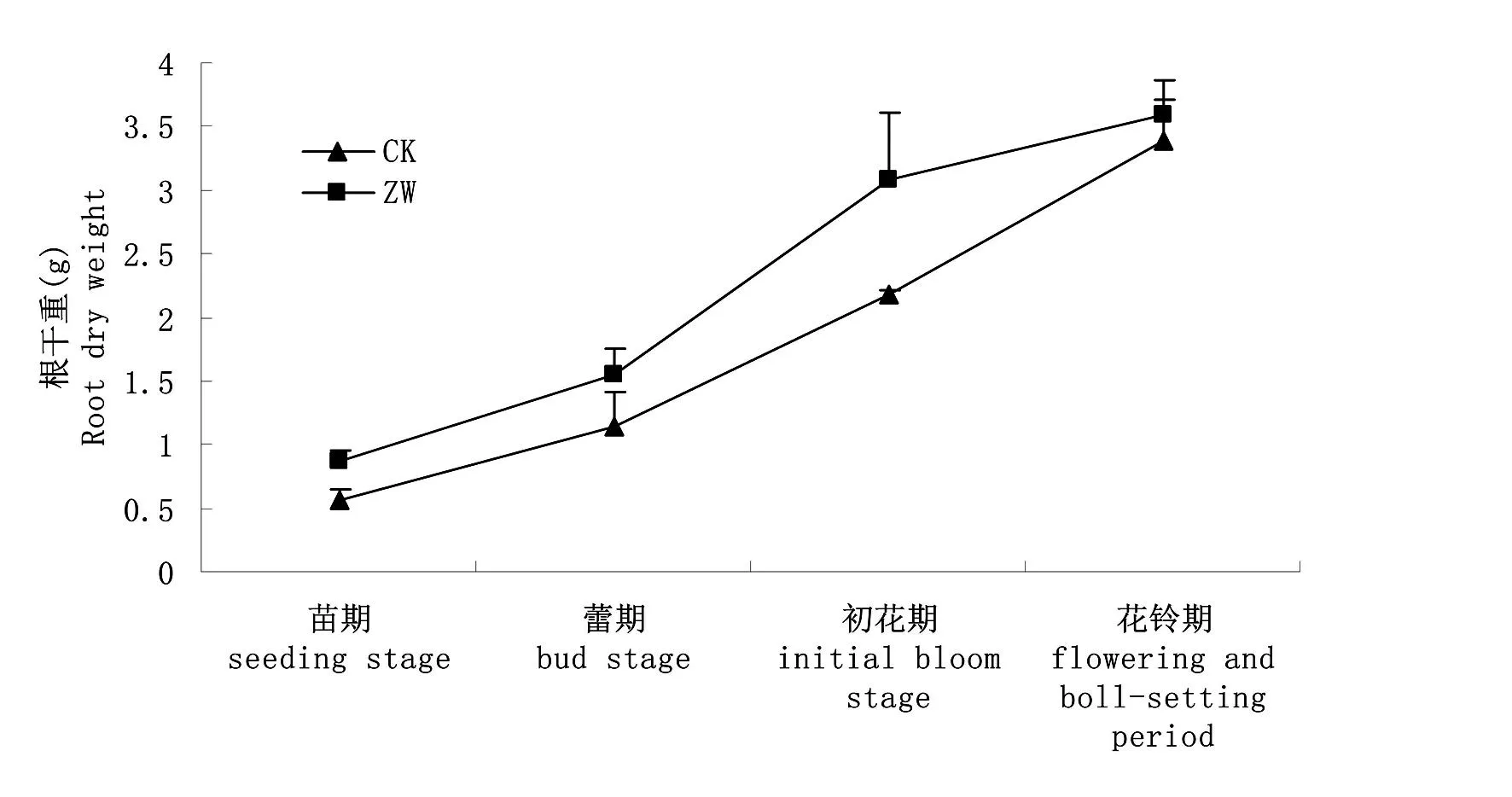
图6增温培养下棉花不同生育时期根系干物质量变化
Fig.6 The effect of temperature increment on the root dry weight of cotton leaves during different growth stages表1 根际增温下棉花不同生育时期根系生长变化
Table 1 The effect of root-zone temperature increment on the growth of cotton during different growth stages
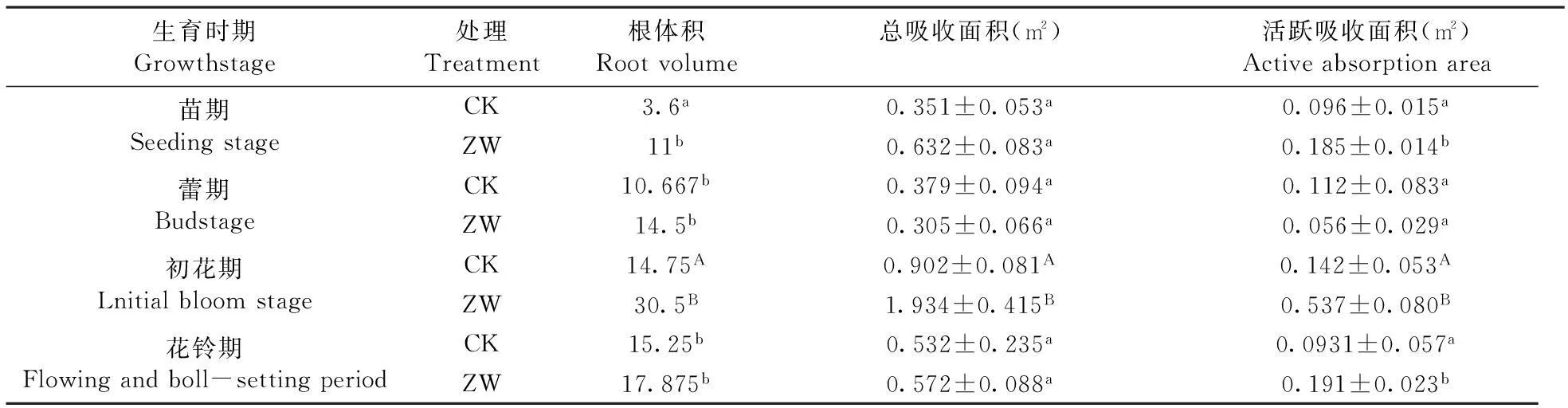
生育时期Growthstage处理Treatment根体积Rootvolume总吸收面积( )活跃吸收面积( )Activeabsorptionarea苗期SeedingstageCK3.6a0.351±0.053a0.096±0.015aZW11b0.632±0.083a0.185±0.014b蕾期BudstageCK10.667b0.379±0.094a0.112±0.083aZW14.5b0.305±0.066a0.056±0.029a初花期LnitialbloomstageCK14.75A0.902±0.081A0.142±0.053AZW30.5B1.934±0.415B0.537±0.080B花铃期Flowingandboll-settingperiodCK15.25b0.532±0.235a0.0931±0.057aZW17.875b0.572±0.088a0.191±0.023b
3 讨 论
作物体内的抗氧化酶可以有效清除活性氧自由基,避免活性氧积累对作物造成氧化伤害,其中 SOD 是膜脂过氧化防御系统的主要保护酶,它能催化活性氧发生歧化反应生成无毒分子氧和过氧化氢,从而避免植物遭受伤害[15]。POD是活性较高的一类含血红素的氧化酶,它催化H2O2放出新生态氧,从而能氧化某些酚类、芳香胺和抗坏血酸等还原性物质[15]。CAT是植物机体在抗逆中的保护性酶类蛋白之一,可以将H2O2分解成H2O和O2,从而减小活性氧对有机体的毒害,其活性高低是机体自我解毒能力的标志[16]。MDA是细胞膜脂过氧化产物, 其含量越多表明叶片受毒害作用越强,通常利用MDA含量作为脂质过氧化指标,表示细胞膜脂过氧化程度[17]。
影响作物抗氧化酶活性的因素很多,已有很多报道关于干旱、水分、高温、低温、盐分、重金属等外界因素胁迫对抗氧化酶活性的影响,其中孙啸震等[8]在研究花铃期高温对叶片酶活影响时发现叶片POD、CAT 活性大幅下降、MDA 含量显著上升,研究结论与以上结论基本一致,说明花铃期增温棉花生长将受到抑制。除了外界环境外,抗氧化酶活性还受到自身新陈代谢活动的影响。不同生育期酶活变化有所不同,有学者研究发现[18]:棉花功能叶片中SOD酶活性随生长时间的增长而增加,直到吐絮期酶活性开始下降;CAT活性从三叶期→盛花期逐渐上升,结铃期时开始下降;MDA含量在整个生育期内始终呈上升趋势,研究的4个生育时期内酶活性变化情况基本同以上研究结果一致。棉花从蕾期至花铃期时,即有根、茎、叶的营养生长又有现蕾、开花、结铃的生殖生长,需要更强的光合和呼吸作用,因此SOD、CAT、POD含量显著高于苗期;但随着功能叶的衰老,SOD、CAT活开始下降。在蕾期→盛花期,增温处理下CAT、SOD酶活均高于对照,说明这几个时期增温对酶活有促进作用。整个生育期内MDA含量逐渐上升,花铃期时显著上升,而此时期增温处理相比对照含量亦增加明显,说明花铃期叶片逐渐老化,叶老化时出现了活性氧的毒害作用, 叶片基本木质,而增温处理下加剧了叶片的老化,因此不建议在此时期对棉花进行增温灌溉。
根系是作物吸收水分和养分的主要器官,根的生长情况、代谢水平和根系活力直接影响地上部分的生长和营养状况[19],可见根系对于作物的健康生长尤为重要。根系活跃吸收面积表示了根系把吸附在表面的物质转移到细胞内部的情况,可反映养分的吸收转运能力,是衡定根系活力的主要指标之一,根系活跃吸收面积高,说明单位体积根系的养分吸收转运能力强[20],根系活力高。作物根系的吸收能力受许多因素影响 , 张宁等[14]研究发现钾高效型水稻与钾低效型水稻相比,可以显著增加根系干物质量和活跃吸收面积。有学者[22]通过研究根区温度对黄瓜生长发育和生理代谢的影响时发现温度是影响根系生长的重要因素,作物对根区温度比对地上部温度更敏感,根区温度低时根系总吸收面积和活跃吸收面积均显著下降。研究中将根际温度控制在30℃时发现,苗期和初花期根系总吸收面积和活跃吸收面积显著增加,说明在这两个时期内增加根区温度有助于增强棉花的根系吸收能力,促进棉花生长发育。
4结 论
4.1棉花不同生育时期,增温处理与常规相比抗氧化酶活性变化情况不同。增温处理下SOD活性较CK均略有增加(P>0.05),POD活性在初花期时增加显著(P<0.01),CAT活性在蕾期和初花期时分别较CK增加75.62%,69.76%,差异极显著(P<0.01),MDA含量除盛铃期外,其余时期较CK有所降低(P>0.05)。
4.2增温处理下,各生育时期根干重较CK均有所增加,其中初花期时根重增加显著(P<0.01)。苗期和初花期增温处理可以有效增加棉花总吸收面积和活跃吸收面积。
4.3初花期增加培养温度有助于增强叶片抗氧化酶活及根系吸收能力从而促进棉花生长发育。
参考文献(References)
[1]刘清春,千怀遂,任玉玉,等. 河南省棉花的温度适宜性及其变化趋势分析[J]. 资源科学,2006,26(4):51-56.
LIU Qing-chun, QIAN Huai-sui, REN Yu-yu, et al. (2006). Temperature Suitability of Cotton and Its Changes in Henan Province [J].ResourcesScience, 26(4): 51-56 (in Chinese)
[2] Singh, R. P., Prasad, P. V. V., Sunita, K., Giri, S. N., & Reddy, K. R. (2007). Influence of high temperature and breeding for heat tolerance in cotton: a review.AdvancesinAgronomy, 93:313-385.
[3] 王鹤龄,王润元,赵鸿雁,等.中国西北冬小麦和棉花生长对气候变暖的响应[J].干旱地区农业研究,2009,27(1):258-264.
WANG He-ling,WANG Run-yuan, ZHAO Hong-yan (2009).Response of Winter Wheat and Cott-on to Climate Warming in Northwest China [J].AgriculturalResearchintheAridAreas, 27(1): 258-263. (in Chinese)
[4] Bhatt, J. G. (1977). Growth and flowering of cotton ( gossypium hirsutum l.) as affected by daylength and temperature.JournalofAgriculturalScience, 89(3), 583-587.
[5] 武 辉,张巨松,石俊毅,等.棉花幼苗对不同程度低温逆境的生理响应[J]. 西北植物学报,2013,33(1):74-82.
WU Hui, ZHANG Ju-song, SHI Jun-yi, et al. (2013)Physiological Responses of Cotton Seedings under Low Temperature Stress [J].ActaBot.Boreal.-Occident.Sin, 33(1):74-82 .(in Chinese)
[6] 李友军,郅娟娟,牛凯丽,等.不同水分和氮素形态对郑麦9023花后旗叶衰老及产量的影响[J].水土保持学报,2010,24(4):251-256.
Li You- jun, Zhi Juan- juan,Niu Kai-li, et al. (2010). Effect of Different Irrigati-on Tim-es and Nitrogen Forms on Flag Leaf Senescence and Yield of Winter Wheat Zhengmai 9023[J].JournalofSoilandWaterConservation, 24(4):25I-256. (in Chinese)
[7] 白旭,田长彦,胡明芳,等.盐分和温度以及光照对陆地棉种子萌发的影响[J].棉花学报,2006, 18(4):238-241.
BAI Xu, TIAN Chang-yan, HU Ming-fang. (2006). Influence of Light, Temperature and Salinity on the Seed Germination ofGossypiumhirsutumL.[J].CottonScience, 18(4):238-241. (in Chinese)
[8] 孙啸震,张黎妮,戴艳娇,等.花铃期增温对棉花干物重累积的影响及其生理机制[J].作物学报,2012,38(4): 683-690.
SUN Xiao-zhen, ZHANG Li-ni, DAI Yan-jiao, et al. (2012). Effect of Increased Canopy Temperature on Cotton Plant Dry Matter Accumulation and Its Physiological Mechanism [J].ActaAgronomicaSinica, 38(4): 683-690. (in Chinese)
[9] 逯明辉,宋慧,李晓明,等.冷害过程中黄瓜叶片SOD、CAT和POD活性的变化[J].西北植物学报, 2005, 25(8): 1 570-1 573.
LU Ming-hui, SONG Hui, LI Xiao-ming, et al. (2005). Changes of SOD, CAT and POD Activities inCucumberLeavesDuring Cold Damage [J].ActaBot.Boreal.-Occident.Sin, 25( 8): 1,570-1,573. (in Chinese)
[10] Hetherington, S. E., quist, G. (1988). Monitoring chilling injury: a comparison of chlorophyll fluorescence measurements, post-chilling growth and visible symptoms of injury in zea mays.PhysiologiaPlantarum, 72(2), 241-247.
[11] 任志雨,卢兴霞,周富林.根区温度对黄瓜生长和生理代谢的影响[J].天津农业科学, 2006, 12(4): 35-37.
REN Zhi-yu, LU Xing-xia, ZHOU Fu- lin.(2006) Effects of Root Zone Temperature on Growth and Physiological Metabolism of Cucumber [J].TianjinAgriculturalSciences, 12(4): 35-37. (in Chinese)
[12] 王克安,何启伟, 陈运起,等. 低温对黄瓜幼苗根系活力及生物学产量影响的研究[J]. 山东农业科学, 2000,(4):17-19.
Wang Ke-an, He Qi-wei,Chen Yun-qi, et al. (2000). Effect of Low Temperature on Root Activity and Biological Yield in Cucumber Seedlings [J].ShandongAgriculturalSciences, (4): 17-19. (in Chinese)
[13] 李合生.植物生理生化实验原理和技术[M].北京: 高等教育出版社,2000.
LI He-sheng. (2000).TheEexperimentPrincipleandThniqueforPlantphysiology[M].Beijing: Higher Education Press. (in Chinese)
[14] 张朝勇,蔡焕杰.膜下滴灌棉花土壤温度的动态变化规律[J].干旱地区农业研究,2005,23(2):11-15.
[15] 孟亚利,王瑛,王立国,等.麦棉套作复合根系群体对棉花根系生长的影响[J].中国农业学,2006,39(11):2 228-2 236.
MENG Ya-li,WANG Ying,WANG Li-guo, et al. (2006). Effect of the Composite Root Population of Wheat-Cotton Intercropping System on Cotton Root Growth [J]. Scientia Agricultura Sinica, 39(11):2,228-2,236. (in Chinese)
[16] Chance, B., & Maehly, A. C. (1955). Assay of catalases and peroxidases.MethodsinEnzymology, 2(55):764-775.
[17] 陈贵,胡文玉. 提取植物体内MDA的溶剂及MDA作为衰老指标的探讨[J]. 植物生理学通讯,1991,27(1):44-46.
CHEN Gui, HU Wen-yu. (1991) Solvent for Extracting Malondialdehyde in Plant Asindex of Senescence [J].PlantPhysiologyCommunication, 27(1): 44-46. (in Chinese)
[18] 王新望,王惠萍,李俊尧,等.陆地棉功能叶不同生育时期酶活性及脂质过氧化作用的研究[J].作物学报,1995,21(2):216-220.
WANG Xin-wang,WANG Hui-ping, LI Jun-yao, et al. (1995) The Enzyme Activities and the Levels of Lipid Peroxidation upland Cotton (G,hirsutumL.) at Different Development stages [J].ActaAgronomicaSinica, 21(2): 215-222. (in Chinese)
[19] 刘宁,于海秋,王晓磊,等. 不同耐性玉米自交系苗期根系对低钾胁迫的生物学响应[J]. 玉米科学,2012,(6):85-88,93.
LIU Ning, YU Hai- qiu, WANG Xiao- lei, et al. (2012). Biological Response to Potass-ium Deficiency on Root of Different Tolerance Maize Inbred Lines at Seedling Stage [J].MaizeScience,20(6):85-88, 93. (in Chinese)
[20] 宋海星,王学立.玉米根系活力及吸收面积的空间分布变化[J].西北农业学报,2005,14(1): 137-141.
SONG Hai-xing,WANG Xue-li. (2005) The Space Distribution of the Maize RootActivity and Its Absorbing Area [J].ActaAgriculturaeBoreali-occidentalisSinica, 14(1): 137-141. (in Chinese)
[21] 张宁, 郭荣发. 不同钾效率水稻品种苗期的根系形态与生理指标[J]. 江苏农业学报, 2014, (4):716-720.
Fund project:Supported by NSFC "Research on the Effects of Drip Irrigation Water Temperature on Xinjiang Grey Desert Soil Environment and Cotton Growth Mechanism, (51169025)
ZHANG Ning, GUORong-fa.(2014).Root Morphological and Physiological Characteristics in Rice Varieties with Different Potassium Utilization Efficiencies [J].JiangsuJ.ofAgr.Sci, 30(4): 716-720. (in Chinese)
Effect of Temperature Increment on Antioxidant Enzymes and Root
Activities of Cotton Leaves at Different Growth Stages
MENG A-jing1,2, WANG Zhi-guo2, FU Yan-bo2, FENG Yao-zu2, RAO Xiao-juan2,3
(1.BaichengAgriculturalExperimentStation,BaichengXinjiang842301,China; 2.ResearchInstituteofSoil,FertilizerandAgriculturalWaterConservation,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China; 3.XinjiangVocationalCollegeofAgriculture,ChangjiXinjiang831100,China)
Abstract:【Objective】 In this project, the effect of increased temperature on antioxidant enzymes activities of cotton leaves and root activity at each growth stages,and also the sensitive temperature period of cotton root growth were investigated by increasing the cotton root culture temperature in the hope of providing a theoretical basis for the reasonable warming irrigation in cotton fields.【Method】All of the four stages of seeding stage, bud stage, initial bloom stage, flowering and boll-setting stage were under hydroponic conditions. Constant temperature of 30℃ and a normal temperature were set to culture for 10 days, and at each stage, there were 2 levels and 3 repeats used to research the effect of temperature on antioxidant enzymes activities of leaves and root activity of cotton.【Result】The result showed that, at the initial bloom stage, temperature enhancement could increase superoxide dismutase (SOD) activity,catalase (CAT) activity and peroxidase (POD) activity, while it could decrease malondialdehyde (MDA) content effectively so that the photosynthetic capacity of the leaves was enhanced, and the active absorption area of root system also increased significantly. AT the seeding stage and the bud stage, there were little difference in enzyme activity between warming treatment and normal treatment, but the active absorption area of root system was increased significantly at the seeding stage and the CAT activity was increased significantly at the bud stage. However, the antioxidant enzymes activities of cotton leaves and its root activity were inhibited significantly by temperature increase at the flowering and boll-setting stage【Conclusion】 Increasing the culture temperature at the initial bloom stage could contribute a lot to the cotton growth, while the same treatment cotton inhibited the growth at the boll-setting stage.
Key words:cotton; temperature increment;antioxidant enzymes activities;root absorption area
通讯作者:冯耀祖( 1973-) ,男,甘肃武威人,研究员,研究方向为植物营养,(E-mail)fengyaozu@sina.com
作者简介:孟阿静(1989-),女,河南商丘人,助理研究员,研究方向为植物生理生化,(E-mail)19890917@163.com
基金项目:国家自然基金项目“滴灌灌溉水温对新疆灰漠土环境及棉花生长影响机制研究”(51169025)
收稿日期:2015-07-01
中图分类号:S562;S332
文献标识码:A
文章编号:1001-4330(2016)02-0270-07
doi:10.6048/j.issn.1001-4330.2016.02.011
