阻塞性睡眠呼吸暂停患者外周血内皮祖细胞及促血管生成因子水平研究
2016-03-15薛艳超孙蓓王新冯靖曹洁
薛艳超,孙蓓,王新,冯靖△,曹洁△
阻塞性睡眠呼吸暂停患者外周血内皮祖细胞及促血管生成因子水平研究
薛艳超1,孙蓓2,王新1,冯靖1△,曹洁1△
摘要:目的观察阻塞性睡眠呼吸暂停(OSA)患者外周血内皮祖细胞(EPC)不同亚族和促血管生成因子水平的变化,探讨不同程度OSA患者外周血EPC对血管修复的可能性。方法选取90例OSA患者和30例健康志愿者(对照组),根据睡眠呼吸暂停低通气指数(AHI)将90例OSA患者均分为轻、中、重度OSA组。密度梯度离心法提取单个核细胞,依据乙醛脱氢酶(ALDH)活性对EPC进行分选,流式细胞仪联合CD133、CD34、含激酶域插入片段受体(PE-KDR)相应细胞表面标志物测定CD133+KDR+EPC及CD133+CD34+EPC、CD34+KDR+EPC、ALDHloCD34+KDR+EPC的水平。酶联免疫吸附试验(ELISA)测定患者外周血低氧诱导因子-1α(HIF-1α),血管内皮生长因子(VEGF)及基质细胞衍生因子-1α(SDF-1α)的水平。结果对于外周血CD133+KDR+EPC、CD133+CD34+EPC、CD34+KDR+EPC水平,重度OSA组>中度OSA组>轻度OSA组>对照组(均P < 0.05);轻、中度OSA组的外周血ALDHloCD34+KDR+EPC水平高于对照组,重度OSA组低于其他3组(均P < 0.05);血清HIF-1α、VEGF均是重度OSA组>中度OSA组>轻度OSA组>对照组,SDF-1α水平为重度OSA组<中度OSA组<轻度OSA组<对照组(均P < 0.05)。结论OSA患者可能都会诱导动员并招募大量无效EPC,其数量庞大,但直接参与修复内皮的ALDHloCD34+KDR+EPC并未增加,尤其对于重度OSA患者甚至有可能减少,OSA减弱了修复内皮的可能性,加重了内皮损伤,从而增加心血管事件的发生风险。
关键词:阻塞性睡眠呼吸暂停;低氧诱导因子-1α;基质细胞衍生因子-1α;血管内皮细胞生长因子;间歇低氧;内皮祖细胞;乙醛脱氢酶
间歇低氧(IH)是阻塞性睡眠呼吸暂停(OSA)的2个病理生理特征之一。OSA是众多心血管疾病的独立危险因素,OSA并发心血管疾病的主要病理生理机制是内皮损伤和功能障碍[1]。研究表明IH激活低氧诱导因子-1α(HIF-1α),诱导血管内皮细胞生长因子(VEGF)、基质细胞衍生因子-1α (SDF-1α)等血管活性物质合成的增加,进而动员并招募内皮祖细胞(EPC)参与受损血管的修复及重建[2]。最近研究发现,依据乙醛脱氢酶(ALDH)的活性可有效分选出功能性EPC,即直接参与修复内皮的EPC为低ALDH活性内皮祖细胞(ALDHloCD34+KDR+EPC)[3]。OSA患者内皮功能的维持与稳定取决于内皮损伤与EPC修复能力间的动态平衡。目前以OSA患者作为研究对象,通过测定AL⁃DHloCD34+KDR+EPC数量的变化来探讨受损血管修复能力的相关研究甚少。因此,本研究通过测定OSA患者外周血HIF-1α、SDF-1α、VEGF和EPC不同亚族的水平,探讨不同程度OSA患者外周血EPC对血管修复的可能性。
1 对象与方法
1.1研究对象纳入2013年12月—2014年12月于我科睡眠呼吸诊疗中心经多导睡眠监测仪(PSG)诊断为OSA的患者90例,年龄40~79岁。根据呼吸暂停低通气指数(apneahypopnea index, AHI)分为轻度OSA组(5次/h≤AHI<15次/h) 30例,男25例,女5例,年龄(54.3±11.1)岁;中度OSA组(15 次/h≤AHI<30次/h)30例,男25例,女5例,年龄(52.3±12.0)岁;重度OSA组(AHI≥30次/h)30例,男26例,女4例,年龄(52.9±11.6)岁。同期纳入年龄、性别相匹配的30名健康志愿者(AHI<5次/h)作为对照组,其中男24例,女6例,年龄(51.5±8.9)岁。4组性别(χ2=0.480,P=0.923)、年龄(F=0.343, P=0.794)差异均无统计学意义。OSA诊断标准参考阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版)[4],排除伴有包括高血压病、糖尿病、进行药物治疗的高脂血症、动脉粥样硬化性血管疾病和其他慢性疾病者。本研究获得本院伦理委员会批准,研究对象均签署知情同意书。
1.2主要试剂及仪器APC-CD133抗体(Miltenyi公司),PE-cy7-CD34抗体、含激酶域插入片段受体(PE-KDR)抗体(BD公司),人外周血淋巴细胞分离液(Solarbio公司),Aldefluor试剂、人类造血祖细胞富集试剂盒(Stemcell公司),胎牛血清(Gibco公司);酶联免疫吸附试验(ELISA)试剂盒(南京建成生物科技公司),流式细胞计数仪(BD公司),多导睡眠监测仪(美国飞利浦公司)。
1.3方法
1.3.1PSG监测所有受试者均使用PSG连续进行7h以上的睡眠呼吸监测,包括心电图、脑电图、眼电图、下颌肌电图、口鼻气流、胸腹运动及血氧饱和度。监测指标包括嗜睡分数、AHI、最低血氧饱和度(LSpO2)等。
1.3.2血标本的留取所有患者均于PSG监测结束后,空腹抽取肘正中静脉血14mL,其中10mL置于含EDTA的真空采血管中,4℃冰箱中保存,24h内用于单个核细胞(mononu⁃clear cells,MNC)的提取及流式细胞仪检测;另4mL置于非抗凝管中,室温静置30min后,4℃3 000 r/min离心10min,留取血清,标记后于-80℃冰箱中保存。
1.3.3MNC的分离和流式细胞仪检测向10mL新鲜血液中加入0.5mL人类造血祖细胞富集因子抗体,混匀,静置20min后,将血液按1∶1稀释于磷酸盐缓冲液(PBS),采用密度梯度离心法提取MNC,加入红细胞裂解液,按照ALDH厂家手册对MNC进行染色,然后将PE-KDR、PE-cy7-CD34和APC-CD133加入ALDH染色的MNC中,避光孵育,ALDH assay buffer洗涤,用250µL的ALDH assay buffer重悬细胞,上流式细胞仪检测,测定CD133+KDR+EPC、CD133+CD34+EPC、CD34+KDR+EPC及ALDHloCD34+KDR+EPC的细胞比例,结果以每微升全血中高乙醛脱氢酶活性/低乙醛脱氢酶活性(ALDHhi/ALDHlo)所占外周血单个核细胞(PBMC)的百分比× EPC百分比表示。
1.3.4HIF-1α、SDF-1α及VEGF水平检测按照ELISA试剂盒厂家手册,测定患者血清HIF-1α、SDF-1α及VEGF的水平。
1.4统计学方法采用SPSS 17.0软件进行数据分析,计量资料采用±s表示。多组间比较采用单因素方差分析(One-Way ANOVA),组间多重比较采用Bonferroni法,计数资料采用χ2检验,P < 0.05为差异有统计学意义。
2 结果
Tab.1 Comparison of general data in four groups表1 各组患者一般情况比较 (n=30,±s)
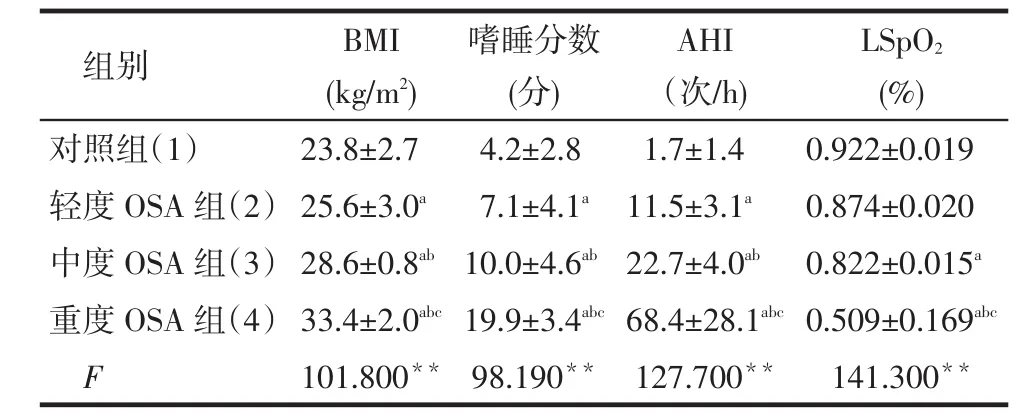
Tab.1 Comparison of general data in four groups表1 各组患者一般情况比较 (n=30,±s)
**P<0.01;a与(1)比,b与(2)比,c与(3)比,P < 0.05
组别对照组(1)轻度OSA组(2)中度OSA组(3)重度OSA组(4)F BMI (kg/m2) 23.8±2.7 25.6±3.0a28.6±0.8ab33.4±2.0abc101.800**嗜睡分数(分) 4.2±2.8 7.1±4.1a10.0±4.6ab19.9±3.4abc98.190**AHI(次/h) 1.7±1.4 11.5±3.1a22.7±4.0ab68.4±28.1abc127.700**LSpO2(%) 0.922±0.019 0.874±0.020 0.822±0.015a0.509±0.169abc141.300**
2.1各组患者一般情况比较见表1。对于体质指数(BMI)、嗜睡分数、AHI,均是重度OSA组>中度OSA组>轻度OSA组>对照组;重度OSA组的LSpO2低于对照组、轻度OSA组、中度OSA组,中度OSA组低于对照组(均P < 0.05)。
2.2各组患者外周血EPC不同亚族的水平比较对于CD133+KDR+EPC、CD133+CD34+EPC、CD34+KDR+EPC水平,均是重度OSA组>中度OSA组>轻度OSA组>对照组,而轻、中度OSA组的ALDHloCD34+KDR+EPC水平高于对照组,重度OSA组低于其余3组(均P < 0.05),见表2。
Tab.2 Comparison of CD133+KDR+EPC, CD133+CD34+EPC, CD34+KDR+EPC, ALDHloCD34+KDR+EPC levels in peripheral blood between four groups表2 各组患者外周血CD133+KDR+EPC、CD133+CD34+EPC, CD34+KDR+EPC及ALDHloCD34+KDR+EPC水平比较 (n=30,±s)
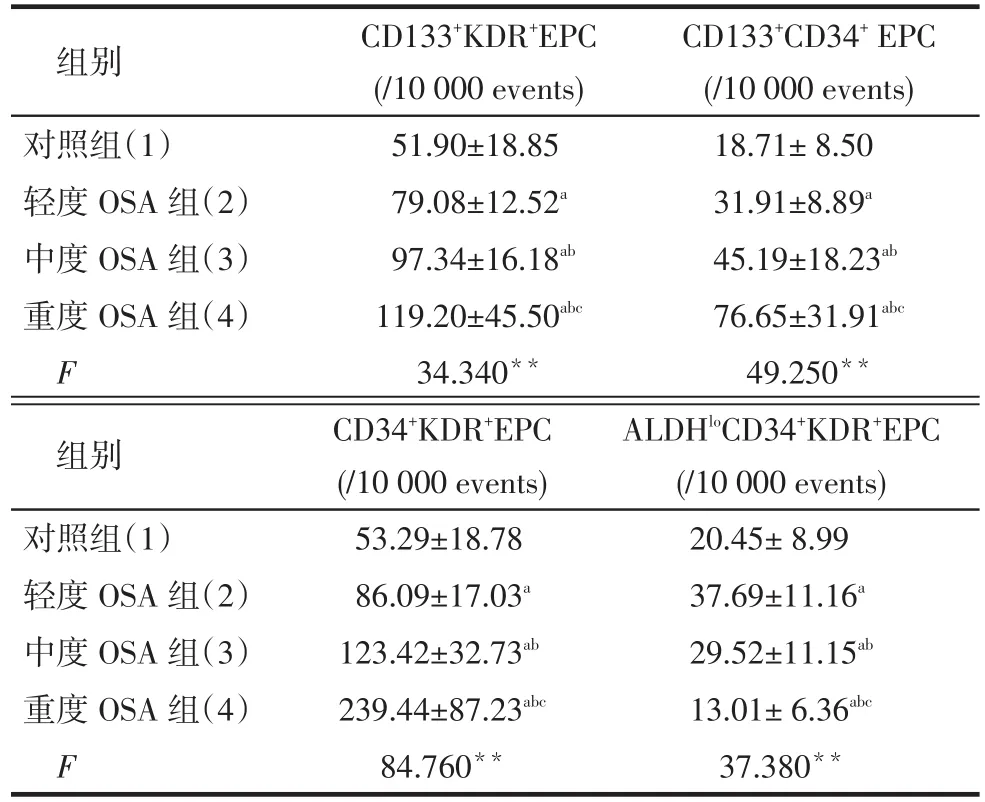
Tab.2 Comparison of CD133+KDR+EPC, CD133+CD34+EPC, CD34+KDR+EPC, ALDHloCD34+KDR+EPC levels in peripheral blood between four groups表2 各组患者外周血CD133+KDR+EPC、CD133+CD34+EPC, CD34+KDR+EPC及ALDHloCD34+KDR+EPC水平比较 (n=30,±s)
**P<0.01;a与(1)比,b与(2)比,c与(3)比,P<0.05
组别对照组(1)轻度OSA组(2)中度OSA组(3)重度OSA组(4)F CD133+KDR+EPC (/10 000 events) 51.90±18.85 79.08±12.52a97.34±16.18ab119.20±45.50abc34.340**CD133+CD34+EPC (/10 000 events) 18.71±8.50 31.91±8.89a45.19±18.23ab76.65±31.91abc49.250**组别对照组(1)轻度OSA组(2)中度OSA组(3)重度OSA组(4)F CD34+KDR+EPC (/10 000 events) 53.29±18.78 86.09±17.03a123.42±32.73ab239.44±87.23abc84.760**ALDHloCD34+KDR+EPC (/10 000 events) 20.45±8.99 37.69±11.16a29.52±11.15ab13.01±6.36abc37.380**
2.3各组血清HIF-1α、SDF-1α及VEGF水平比较HIF-1α和VEGF水平均为重度OSA组>中度OSA组>轻度OSA组>对照组;而SDF-1α水平为重度OSA组<中度OSA组<轻度OSA组<对照组(均P < 0.05),见表3。
Tab.3 Comparison of serum levels ofhIF-1α, SDF-1α and VEGF between four groups表3 各组血清HIF-1α、SDF-1α、VEGF水平比较(n=30,±s)

Tab.3 Comparison of serum levels ofhIF-1α, SDF-1α and VEGF between four groups表3 各组血清HIF-1α、SDF-1α、VEGF水平比较(n=30,±s)
**P<0.01;a与(1)比,b与(2)比,c与(3)比,P<0.05
组别对照组(1)轻度OSA组(2)中度OSA组(3)重度OSA组(4) FhIF-1α(μg/L) 1.30±0.21 1.70±0.15a1.87±0.35ab2.56±0.26abc129.500**SDF-1α(ng/L) 2 173.00±316.50 1 971.00±275.50a1 587.00±241.70ab1 180.00±313.20abc69.450**VEGF(ng/L) 36.79±5.59 53.29±6.57a98.00±7.00ab155.60±12.80abc1183.000**
3 讨论
OSA是临床上一种常见的睡眠紊乱性疾病,其特征为上气道的反复塌陷导致复发性低氧血症、睡眠片段化和日间嗜睡。OSA并发血管损伤的主要机制是OSA模式IH造成内皮损伤[1]。IH诱导动员并招募EPC归巢于受损血管区域,从而修复血管内皮的完整性和功能[5],且主要参与受损血管修复的EPC 为ALDHloCD34+KDR+EPC[3]。内皮损伤最终表现为IH激活的内皮损伤过程与EPC修复过程之间的动态平衡,从而促进心血管事件的发生[6]。
本研究结果显示,轻、中、重度OSA组患者的BMI均高于对照组,表明BMI越高,OSA患者AHI的次数增加越明显,这与Viswanath等[7]认为BMI可增加OSA的发生率的结论一致。
目前关于OSA与EPC数量关系的文献报道很多,但研究结果并不一致。本研究结果显示,重度OSA组患者外周血CD133+KDR+EPC、CD133+CD34+EPC、CD34+KDR+EPC水平最高,对照组最低;Berger 等[8]通过对急性心肌梗死(AMI)合并睡眠呼吸紊乱(SDB)患者研究发现,AMI合并SDB患者的EPC水平明显高于单独AMI患者,并认为是IH导致了EPC水平的增加,与本研究结果一致。Lui等[9]研究发现,与空白对照组相比,OSA患者的CD133+KDR+EPC水平降低,其认为与晚期糖基化终产物的增加有关。Murri等[10]发现OSA患者CD133+CD34+EPC水平低于对照组,与本研究结果是相反的,他们认为EPC水平与OSA严重程度、氧化应激标志物水平呈负相关。而Yun等[11]通过检测内皮集落形成单位来测定EPC,结果发现OSA组与对照组的EPC水平并无明显差异。本研究结果表明,OSA患者程度越重,外周血中CD133+KDR+EPC、CD133+CD34+EPC、CD34+KDR+EPC水平增加越明显,提示EPC水平与OSA严重程度呈正相关。形成这种差异的原因可能与受试者的数量、男女比例、EPC的表型及EPC评价方法的不同[5]等因素有关。
ALDH是一种对细胞间乙醛起氧化作用的酶[12]。尽管ALDH是一种细胞质基质蛋白,但其表达水平可利用乙醛即丹磺酰氨基乙醛的荧光,通过流式细胞仪检测[13]。最近,有研究根据ALDH的活性分选两群EPC,并检测其表面标志物及其作用,结果发现,ALDHloCD34+KDR+EPC具有较强的修复能力[3]。因此,对于区分所谓的“功能性EPC”来说,ALDH是一种有效的标志物。更有研究表明,ALDHloCD34+KDR+EPC对局部缺血组织有重要的再生能力[14]。本研究依据ALDH活性联合EPC表面标志物分选EPC,结果发现重度OSA组患者ALDHloCD34+KDR+EPC水平最低,轻度OSA组ALDHloCD34+KDR+EPC水平最高,提示OSA患者动员招募EPC大量增加,但在重度OSA患者中,真正参与修复内皮的ALDHloCD34+KDR+EPC却降低,减弱了对受损血管的修复能力,加重了内皮损伤,从而增加了心血管疾病发生的可能性,符合OSA是众多心血管疾病独立危险因素的结论。
OSA的主要病理生理基础是睡眠过程中反复发生的IH,诱导相关基因表达及相应活性物质的合成,进而导致心血管疾病的发生,HIF-1α是其中的关键调控因子之一。OSA模式的IH激活HIF-1α,诱导SDF-1α及VEGF的表达增加,动员和招募EPC,最终参与新血管的形成[2]。本课题组以往通过建立不同的动物低氧模型,发现HIF-1α的蛋白及mRNA表达水平随着间歇低氧频率及程度的增加而升高,且低氧程度越重,HIF-1α的表达水平越高[15]。而本研究进一步对OSA患者研究发现,随着OSA严重程度的加重,血清HIF-1α的蛋白水平增加,这与国内外的研究结果一致,并且符合HIF-1α对低氧具有适应性反应的调控机制。
VEGF是缺血缺氧过程中一种重要的基因产物。缺氧情况下,VEGF的活性增强,动员与招募EPC进入外周血循环,并归巢至受损血管处,参与血管的修复。本研究结果表明重度OSA组患者血清VEGF增加明显,其EPC水平也是增加的,与VEGF 对EPC的动员作用是一致的。然而,有报道认为OSA患者血清VEGF水平增加,但EPC水平是减少的,原因可能与EPC在OSA血管内皮损伤中的消耗有关[5]。
SDF-1α是细胞膜半胱氨酸-X-半胱氨酸(CXC)趋化因子家族一员,通过SDF-1α/半胱氨酸-X-半胱氨酸趋化因子受体(CXCR)4轴,进而动员EPC进入外周血循环,并迁移至受损血管部位。SDF-1α在缺血组织的过度表达能促使EPC从外周血聚集并诱导新生血管形成[5]。目前OSA患者的血清与EPC数量及功能之间的关系存在争议。本研究结果表明,SDF-1α随着OSA程度的加重逐渐降低,这与Berger等[8]研究一致。笔者认为可能机制为随着OSA患者严重程度的加重,EPC水平增加,SDF-1α 与EPC的表面受体CXCR4结合增加,使得其血浆浓度降低。
参考文献
[1] Feng J, Zhang D, Chen BY.Endothelialmechanisms of endothelial dysfunction in patients with obstructive sleep apnea[J].Sleep Breath,2012,16(2):283-294.doi:10.1007/s11325-011-0519-8 .
[2] Akita T,murohara T, Ikedah, et al.Hypoxic preconditioning aug⁃ments efficacy ofhuman endothelial progenitor cells for therapeutic neovascularization[J].Lab Invest,2003,83(1):65- 73.doi: 10.1097/01.Lab.0000050761.67879.E4 .
[3] Naganom, Yamashita T,hamadah, et al.Identification of function⁃al endothelial progenitor cells suitable for the treatment of ischemic tissue usinghuman umbilical cord blood[J].Blood,2007,110(1):151-160.doi: 10.1182/blood-2006-10-047092.
[4] The Chinesemedical association respiratory neurology, the sleep ap⁃nea group.Guide of diagnosis and treatment of obstructive sleep ap⁃neahypopnea syndrom (2011 revision)[J].Chin J Tuberc Respir Dis, 2012,35(1):9-12.[中华医学会呼吸病学分会睡眠呼吸障碍学组.阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版) [J].中华结核和呼吸杂志,2012,35(1):9-12].
[5] Wang Q, Wu Q, Feng J, et al.Obstructive sleep apnea and endothe⁃lial progenitor cells[J].Patient Prefer Adher, 2013,7:1077- 1090.doi: 10.2147/Ppa.S51562.
[6] Kheirandish-Gozal L, Bhattacharjee R, Kim J, et al.Endothelial progenitor cells and vascular dysfunction in children with obstruc⁃tive sleep apnea[J].Am J Resp Crit Care,2010,182(1):92-97.doi: 10.1164/rccm.200912-1845OC.
[7] Viswanath A, Ramamurthy J, Dinesh SP, et al.Obstructive sleep ap⁃nea: Awakening thehidden truth [J].Niger J ClinPract,2015,18 (1): 1-7.doi: 10.4103/1119-3077.146964.
[8] Berger S, Aronson D, Lavie P, et al.Endothelial progenitor cells in acutemyocardial infarction and sleep-disordered breathing[J].Am J Respir Crit Caremed,2013,187(1):90-98.doi: 10.1164/rccm.201206-1144OC.
[9] LuimMS, TsehF,mak JCW, et al.Altered profile of circulating en⁃dothelial progenitor cells in obstructive sleep apnea[J].Sleep Breath,2013,17(3):937-942.doi: 10.1007/s11325-012-0781-4.
[10]murrim, Garcia-Delgado R, Alcazar-Ramirez J, et al.Effect of CPAP on oxidative stress and circulating progenitor cell levels in sleep patients with apnea-hypopnea syndrome[J].Resp Care,2011, 56(11):1830-1836.doi: 10.4187/respcare.01081.
[11] Yun CH, Jung KH, Chu K, et al.Increased circulating endothelialmicroparticles and carotid atherosclerosis in obstructive sleep apnea [J].J Clin Neurol,2010,6(2):89-98.doi: 10.3988/jcn.2010.6.2.89.
[12] Storms RW, Trujillo AP, Springer JB, et al.Isolation of primitivehu⁃manhematopoietic progenitors on the basis of aldehyde dehydroge⁃nase activity[J].P Natl Acad Sci USA,1999,96(16):9118- 9123.doi: 10.1073/pnas.96.16.9118.
[13] Jones RJ, Barber JP, ValamS, et al.Assessment of aldehyde dehy⁃drogenase in viable cells[J].Blood,1995,85:2742-2746.
[14] Fukuda S, Naganom, Yamashita T, et al.Functional endothelial progenitor cells selectively recruit neurovascular protectivemonocytederived F4/80(+)/Ly6c(+)macrophages in amousemodel of retinal degeneration[J].Stem Cells,2013,31(10):2149-2161.doi: 10.1002/stem.1469.
[15] Yang QC, Zhou Q, Wang Y, et al.Effects of different degrees of in⁃termittenthypoxia on inflammatory cytokines and adipokines in3T3-L1A dipocytes[J].Tianjinmed J,2013,41(12):1142-1146.[杨庆婵,周芹,王彦,等.不同程度间歇低氧对3T3-L1脂肪细胞炎性细胞因子和脂肪因子的影响[J].天津医药,2013,41(12):1142-1146].doi:10.3969/j.issn.0253-9896.2013.12.002.
(2015-09-15收稿2015-10-08修回)
(本文编辑闫娟)
T Endothelial progenitor cells (EPCs) and promote angiogenesis factor levels in peripheral blood in patients with obstructive sleep apnea
XUE Yanchao1, SUN Bei2, WANG Xin1, FENG Jing1△, CAO Jie1△
1 Generalhospital of Tianjinmedical University, Tianjin 300052, China; 2 Institute of Endocrinology of Tianjinmedical University
Abstract:Objective To explore the repair possibilities of endothelial progenitor cells (EPCs)in peripheral blood in patients with different extents of obstructive sleep apnea (OSA) throughmeasuring the levels of pro-angiogenic factors and different subgroups EPCs in peripheral blood in patients with OSA.Methods Ninety adult patients with OSA, 30healthy controls withmatched age and gender were enrolled for this study.The subjects performed Polysomnography, were divided in⁃to four group based on Apneahypopnea Index (AHI).The serum levels ofhIF-1α, SDF-1α and VEGF were assessed by ELISA.Mononuclear cells were isolated from peripheral blood with density gradient centrifugation, and flow cytometry was used to detect levels of CD133+KDR+EPC, CD133+CD34+EPC, CD34+KDR+EPC and ALDHloCD34+KDR+EPC based on AL⁃DH activity, and CD133, CD34, PE-KDR related cell surfacemarkers.Results The levels of CD133+KDR+EPC, CD133+CD34+EPC, CD34+KDR+EPC werehigher in OSA groups than those of control group, both of which werehigher in severe OSA group than those of inmild andmoderate OSA groups.The levels of ALDHloCD34+KDR+EPC werehigher inmild andmoderate OSA groups than that of the control groups, and the levels of ALDHloCD34+KDR+EPC were significantly lower in se⁃vere OSA group than those of control,mild andmoderate OSA groups.Serum levels ofhIF-1α.VEGF were significantlyhigh⁃er in OSA groups compared to those in control groups, both of which werehigher in severe OSA group than those ofmild andmoderate OSA groups.Serum levels of SDF-1α were significantly lower in severe OSA groups than those ofmild,moderate OSA and control groups (P < 0.05).Conclusion Themobilization and recruitment of different subtypes of EPCs are obvious⁃ly increased in patients with OSA, but ALDHloCD34+KDR+EPC with vascular repair capacity keeps to invariability, even de⁃book=20,ebook=25creases in patients with severe OSA, which results in endothelial damage, and increases the risk of cardiovascular disease.
Key words:obstructive sleep apnea;hypoxia-inducible factor-1α; stromal cell derived factor-1α; vascular endothelial growth factor; intermittenthypoxia; endothelial progenitor cells; acetaldehyde dehydrogenase
Corresponding Author△E-mail: zyyhxkfj@126.com; tjcaojie@sina.com
通讯作者△E-mail:zyyhxkfj@126.com; tjcaojie@sina.com
作者简介:薛艳超(1988),女,硕士在读,主要从事睡眠低氧性疾病研究
基金项目:国家自然科学基金资助项目(81270144,30800507,81570084,2015BAI12B00,2012BAI05B02)
中图分类号:R56
文献标志码:A
DOI:10.11958/20150161
作者单位:1天津医科大学总医院呼吸科(邮编300052);2天津医科大学代谢病医院内分泌研究所
