间歇低氧-肺气肿大鼠的炎症及免疫反应特点研究
2016-03-15韩双羽李彩丽冯靖王玉宝
韩双羽,李彩丽,冯靖△,王玉宝△
间歇低氧-肺气肿大鼠的炎症及免疫反应特点研究
韩双羽1,李彩丽2,冯靖2△,王玉宝1△
摘要:目的建立间歇低氧(IH)-肺气肿大鼠模型,探讨其引起炎症和免疫反应的特点。方法60只Wistar大鼠随机分成对照组、肺气肿组、IH组和重叠组(肺气肿合并IH组)。每组15只。造模成功后使用流式细胞仪测定各组外周血中性粒细胞(PMN)、CD3+CD8+T细胞、CD3+CD4+T细胞凋亡率水平。酶联免疫吸附试验(ELISA)法测定血浆中肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6水平。取大鼠肺泡灌洗液(BALF),在光镜下计算巨噬细胞、外周血PMN和淋巴细胞比例。采集肺、肝脏、胰腺组织和右颈动脉并进行病理评分。结果重叠组中PMN、CD3+CD8+T细胞凋亡率与其他3组相比较低,CD3+CD4+T细胞凋亡率、TNF-α、IL-6表达水平最高(均P < 0.05)。BALF中,肺气肿组巨噬细胞和PMN百分比高于其余3组(均P < 0.05)。重叠组中肺、肝脏、胰腺、右颈动脉内中膜厚度的病理评分高于其他3组(均P < 0.05)。结论肺气肿合并IH可产生更严重的系统性多器官炎症和免疫反应。
关键词:肺气肿;炎症;免疫;间歇低氧;重叠综合征
慢性阻塞性肺疾病(COPD)与阻塞性睡眠呼吸暂停综合征(OSA)在呼吸系统疾病中往往共存,被称为重叠综合征(OS),由Flenley于1985年首先提出。OS可以使系统性炎症反应和心血管疾病的风险增加[1],在年龄>40岁的人群中发病率为0.5%~1.0%[2]。与单纯OSA或COPD患者相比,OS患者低氧程度、高碳酸血症程度更为严重,发展为肺动脉高压、慢性肺源性心脏病的概率增加[3-4]。本研究通过建立间歇低氧(IH)-肺气肿大鼠模型,观察大鼠系统性炎症及免疫反应的发生情况,旨在探讨OSA与COPD的共同作用与相互影响,深入理解OS的内在特征与可能的发病机制。
1 资料与方法
1.1一般资料60只4周龄健康SPF级Wistar大鼠,雄性,体质量120~150 g,购自中国医学科学院放射医学研究所动物模型中心。光学显微镜(日本OLYMPUS BX4.0);数码相机(日本佳能公司);多功能彩色病理图像分析系统(北京航空航天大学);气体氧浓度监测器(瑞士夏美顿公司);低流量流速表(余姚工业自动化仪表厂);氧气减压器(天津减压器厂);熏箱为玻璃箱改制(85 cm×70 cm×55 cm),低氧舱为大号密封盒改制;混合气体(天津六方气体公司);酶标仪(美国Model550microplate Reader,Bio-Rad);台式冷冻离心机(德国Heraeus公司);倒置显微镜(德国Zeiss,Axiorert200);肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6,酶联免疫吸附试验(ELISA)试剂盒(美国Invitrogen公司);大前门烤烟型香烟(上海卷烟厂生产);台盼蓝染色液(上海地申生物科技有限公司);AnnexinV-PE凋亡试剂盒(美国eBioscince公司);流式细胞仪、细胞分离液Histopaque1119、Histopaque1083、大鼠粒细胞标记物FITC、大鼠淋巴细胞标记物(美国BD公司);吉姆萨染液、瑞氏染液(南京建成生物有限公司)。
1.2方法
1.2.1分组与模型制作60只大鼠随机分成4组,每组15只,暴露方法及模型建立标准均参照课题组既往研究[5-6]。对照组:假熏烟暴露和间歇正常氧暴露。IH组:假熏烟暴露和IH暴露。肺气肿组:熏烟暴露和间歇正常氧暴露。重叠组:熏烟暴露和IH暴露。模型均建立成功。
1.2.2外周血中性粒细胞(PMN)、CD3+CD4+、CD3+CD8+T细胞凋亡率测定使用AnnexinV-PE凋亡率检测试剂盒,按照操作说明书使用密度梯度离心法分离外周血单核细胞和PMN,重悬后分别加入粒细胞标志物、CD3-Ab和CD4-Ab、CD3-Ab和CD8-Ab,孵育清洗后,先后加入AnnexinV和7-AA,通过流式细胞仪检测细胞凋亡,每份标本收集细胞数20 000个,计算凋亡细胞的百分率。
1.2.3TNF-α、IL-6表达水平检测取大鼠外周血,使用Quantakine®试剂盒,根据试剂盒手册进行ELISA测定。
1.2.4大鼠肺泡灌洗液(BALF)中各炎症细胞百分比检测将大鼠麻醉后行开胸术,于气管分叉上方结扎右主支气管,左肺行气管灌洗,回收灌洗液,一份灌洗液使用血细胞计数仪测定细胞总数及白细胞总数。另一份灌洗液经500×g离心5min后,制片,改良Wright-Giemsa染色后,使用光学显微镜(×100)测定巨噬细胞、PMN和淋巴细胞的百分比,分类计数检测判断标准均参照美国胸科协会官方指南进行[7]。
1.2.5肺、肝、胰腺及颈动脉炎症病理学评价使用10%福尔马林浸润右肺,切取肺组织,行剖腹手术和颈部切开术,提取肝脏、胰腺和右颈动脉组织块,置于4%甲醛溶液中固定,于24h内行石蜡包埋,行4 μm切片后,常规苏木精-伊红(HE)染色,在光学显微镜下观察组织形态。为了客观度量,本研究进行了随机分层病理切片,采用文献[8]方法对病理结果进行量化评分,包括平均线性截距(MLI),平均肺泡数(MAN)和肺部、肝脏(近肝门区)、胰腺炎症病理得分,使用病理图像分析系统测量大鼠右颈动脉内中膜厚度占整个血管壁厚百分比(内中膜厚度百分比)。
1.3统计学方法采用SPSS 11.5统计软件进行数据分析。符合正态分布的计量资料用±s表示,多组间均数比较采用单因素方差分析,组间多重比较采用Bonferroni检验,以P < 0.05为差异有统计学意义。
2 结果
2.1外周血PMN、CD3+CD4+T及CD3+CD8+T细胞凋亡率重叠组PMN及CD3+CD8+T细胞凋亡率最低,对照组最高;重叠组CD3+CD4+T细胞凋亡率最高,对照组最低(均P < 0.05),见表1、图1~3。
Tab.1 The apoptotic rates of PMN, CD3+CD4+T cells and CD3+CD8+T cells in peripheral blood in four groups of rats表1 各组大鼠外周血PMN、CD3+CD4+T细胞、CD3+CD8+T细胞凋亡率 (n=15,%,±s)

Tab.1 The apoptotic rates of PMN, CD3+CD4+T cells and CD3+CD8+T cells in peripheral blood in four groups of rats表1 各组大鼠外周血PMN、CD3+CD4+T细胞、CD3+CD8+T细胞凋亡率 (n=15,%,±s)
**P<0.01;a与对照组比较,b与IH组比较,c与肺气肿组比较,均P<0.05
组别对照组IH组肺气肿组重叠组F PMN 30.87±1.65 22.71±1.47a19.45±1.61ab8.54±2.55abc244.23**CD3+CD4+T 13.02±1.18 20.65±1.31a18.49±1.67ab22.62±1.55abc87.18**CD3+CD8+T 31.75±1.53 23.65±1.29a28.42±1.45ab18.42±1.16abc166.35**
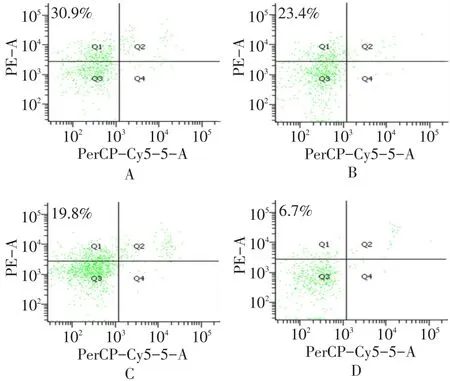
A~D分别为对照组、IH组、肺气肿组及重叠组Fig.1 Flow cytometric analysis for early-stage apoptotic neutrophils from rat PMNs in four groups图1 各组大鼠外周血PMN凋亡流式细胞分析结果
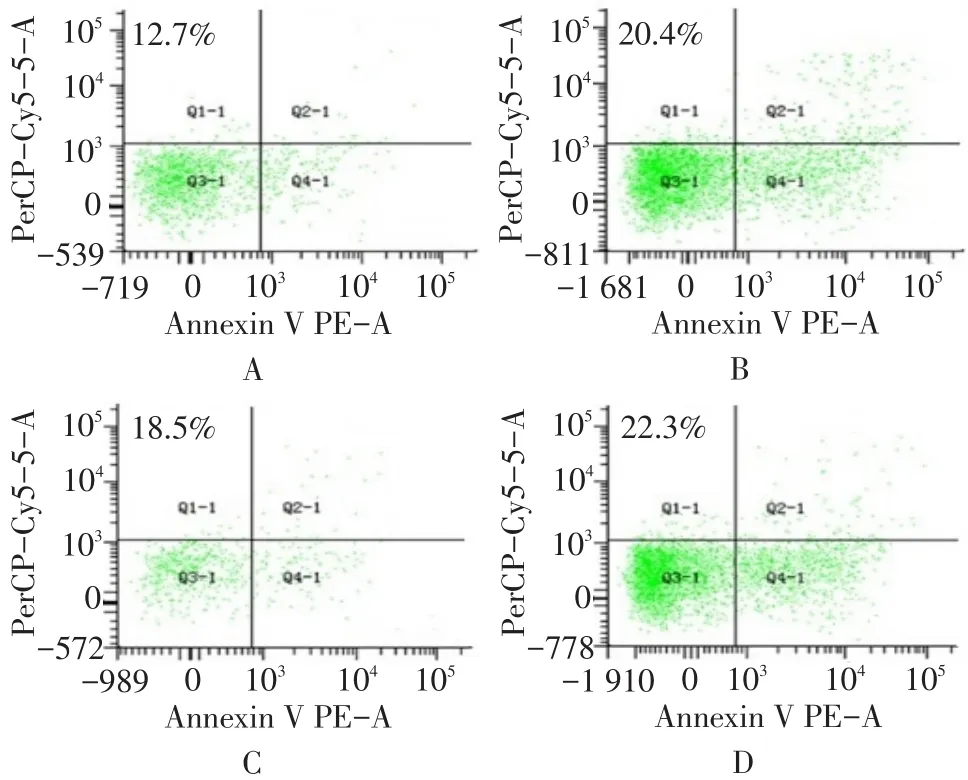
A~D分别为对照组、IH组、肺气肿组及重叠组Fig.2 Flow cytometric analysis for early-stage apoptotic CD3+CD4+T lymphocytes from rat PBMC in four groups图2 各组大鼠CD3+CD4+T淋巴细胞凋亡流式细胞分析结果

A~D分别为对照组、IH组、肺气肿组及重叠组Fig.3 Flow cytometric analysis for early-stage apoptotic CD3+CD8+T lymphocytes from rat PBMCs in four groups图3 各组大鼠CD3+CD8+T淋巴细胞凋亡流式细胞分析结果
2.2各组大鼠TNF-α、IL-6表达水平比较TNF-α 和IL-6的表达水平为重叠组>肺气肿组>IH组>对照组(均P < 0.05),见表2。
2.3各组大鼠BALF中炎症细胞百分比比较肺气肿组巨噬细胞和PMN百分比高于其余3组(均P < 0.05)。重叠组淋巴细胞百分比与IH组差异无统计学意义,与其他2组间比较差异均有统计学意义(均P < 0.05),见表3。
2.4肺、肝脏、胰腺、右颈动脉炎症病理学评价肺气肿组和重叠组大鼠的病理学特征明显,表现为肺组织间质增厚和薄壁组织炎症,MAN减少,MLI增加,大量炎症细胞浸润;对照组肝脏病理基本正常,IH组表现为轻微炎症,肺气肿组、重叠组肝细胞呈气球样变且伴有炎性细胞浸润,见图4。肺、肝脏、胰腺、内中膜厚度的病理评分中,重叠组均高于其他3组,对照组各项评分在4组之中最低,IH组低于肺气肿组(均P < 0.05),见表4。
Tab.2 Comparison of blood levels of TNF-α and IL-6 in four groups of rats表2 各组TNF-α、IL-6表达水平比较(n=15,ng/L,±s)

Tab.2 Comparison of blood levels of TNF-α and IL-6 in four groups of rats表2 各组TNF-α、IL-6表达水平比较(n=15,ng/L,±s)
**P<0.01;a与对照组比较,b与IH组比较,c与肺气肿组比较,均P<0.05
组别对照组IH组肺气肿组重叠组F TNF-α 16.47±2.25 48.59±3.20a62.58±4.80ab76.89±7.77abc270.51**IL-6 109.71±7.84 264.57±16.69a478.60±12.23ab683.52±20.23abc2792.10**
Tab.3 Cellular profiles of BALF in four groups of rats表3 各组大鼠BALF各炎症细胞比例(n=15,%,±s)

Tab.3 Cellular profiles of BALF in four groups of rats表3 各组大鼠BALF各炎症细胞比例(n=15,%,±s)
**P<0.01;a与对照组比较,b与IH组比较,c与肺气肿组比较,均P<0.05
组别对照组IH组肺气肿组重叠组F巨噬细胞73.55±9.85 45.45±4.37a75.25±2.53ab36.75±6.86abc90.34**PMN 1.60±1.17 1.30±1.90 14.90±3.06ab2.75±1.92c94.69**淋巴细胞24.85±10.50 53.25±5.51a9.85±2.36ab60.50±7.94ac108.31**
3 讨论
PMN凋亡延迟可使PMN生存期延长,是导致慢性炎症和器官、组织损伤非常重要的机制[9-11]。缺氧和促炎症细胞因子等均可以使PMN凋亡延迟,但会生产更多数量的活性氧,造成器官和组织的慢性损伤[12]。PMN凋亡延迟引发的肺和气管持久性炎症是COPD发病机制的关键阶段,而IH反复发作患者出现心血管并发症亦与PMN凋亡延迟引起的活性氧累积增加密切相关[13]。本研究显示,COPD组和IH组的PMN凋亡率均比对照组低,而重叠组最低,表明COPD和IH均可导致明显的PMN凋亡延迟,而COPD与IH共同存在则进一步抑制了PMN的凋亡,可能会造成更为严重的器官和组织损伤,这对于全身炎症反应较为严重的OS患者具有重要的病理生理意义。
CD3+CD4+T细胞和CD3+CD8+T细胞是异常免疫反应的关键,它们的分化或功能的破坏会导致自身免疫疾病和炎症。近期研究表明,当CD3+CD8+T细胞凋亡减少时,CD3+CD4+T细胞凋亡水平增加,并且这种免疫异常与COPD患者气道病理过程有关[14]。OSA患者扁桃腺CD3+CD8+T细胞的增殖与促炎细胞因子的较高表达和释放相关,可以促进局部炎症的发展[15]。以上证据表明COPD和OSA患者均可能具有免疫异常。本研究显示,与对照组相比,重叠组CD3+CD8+T细胞凋亡明显减少,而CD3+CD4+T细胞凋亡明显增多,肺气肿组和IH组CD3+CD4+T细胞居中,提示OS患者存在更为严重的免疫异常。
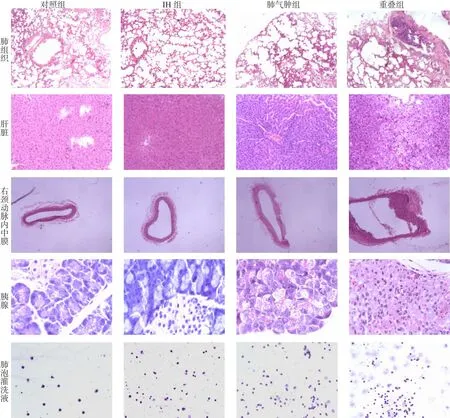
肺(HE,×40)、肝(HE,×100)、右颈总动脉(HE,×40)、胰腺(HE,×400)及支气管肺泡灌洗液细胞组织(改良Wright-Giemsa染色,×100)Fig.4 Histological photographs of tissues in different groups图4 各组大鼠不同组织部位病理扫描结果
Tab.4 Comparison of pathological scores in lung, liver, pancreas and carotid artery in four groups of rats表4 各组大鼠病理评测结果比较 (n=15,±s)
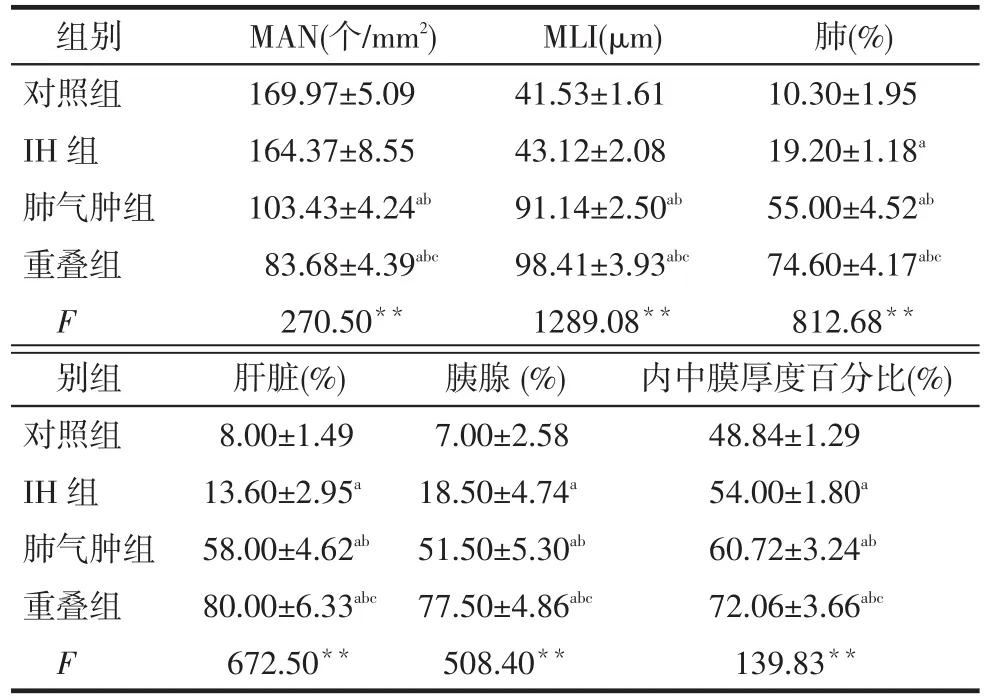
Tab.4 Comparison of pathological scores in lung, liver, pancreas and carotid artery in four groups of rats表4 各组大鼠病理评测结果比较 (n=15,±s)
**P<0.01;a与对照组比较,b与IH组比较,c与肺气肿组比较,均P<0.05
组别对照组IH组肺气肿组重叠组FmAN(个/mm2) 169.97±5.09 164.37±8.55 103.43±4.24ab83.68±4.39abc270.50**MLI(μm) 41.53±1.61 43.12±2.08 91.14±2.50ab98.41±3.93abc1289.08**肺(%) 10.30±1.95 19.20±1.18a55.00±4.52ab74.60±4.17abc812.68**别组对照组IH组肺气肿组重叠组F肝脏(%) 8.00±1.49 13.60±2.95a58.00±4.62ab80.00±6.33abc672.50**胰腺(%) 7.00±2.58 18.50±4.74a51.50±5.30ab77.50±4.86abc508.40**内中膜厚度百分比(%) 48.84±1.29 54.00±1.80a60.72±3.24ab72.06±3.66abc139.83**
TNF-α和IL-6等促炎细胞因子在宿主防御和心血管疾病中都有着极其重要的作用,其在血浆中水平升高通常是全身炎症反应的重要标志。研究显示,COPD患者的肺和血浆中TNF-α或IL-6水平均增加,证实了全身性炎症是COPD发病机制的重要组成部分[16]。本研究显示,肺气肿组和IH组血浆TNF-α和IL-6水平较对照组均升高,表明2组大鼠均出现了明显的全身炎症反应,而重叠组的这两项指标水平最高,提示吸烟暴露和IH两种因素的叠加使全身炎症反应较单一因素更为严重。
临床研究发现,COPD患者BALF中PMN的数量较正常人群增加[17]。与之相近,本研究亦发现肺气肿组BALF中的PMN比例高于其他组;IH组和重叠组BALF中PMN的比例较低,其原因可能是IH引起淋巴细胞持续增多所致。笔者既往研究已经证实,IH暴露主要可引起淋巴细胞水平明显上升,并与后续的炎症过程相关[18]。
本研究病理结果显示,COPD组和IH组都具有相似的血管病理改变,即右颈动脉内中膜厚度较对照组明显增加,这与对临床患者的观察结果是相同的[19-20]。值得强调的是,与其他3组相比,重叠组肺、肝脏、胰腺、内中膜厚度的病理评分最高,考虑这可能与PMN凋亡延迟、CD3+CD8+T细胞异常增加以及血浆中TNF-α和IL-6水平明显升高有关,再一次证实COPD和IH两种因素叠加会导致更为严重的全身炎症反应和器官损伤,提示OS患者与单纯患一种疾病相比预后可能更差。
综上所述,本研究成功地建立了COPD、IH和OS的动物模型,明确地呈现出COPD和IH的炎症、免疫、病理等特征,并且发现OS产生了更严重的系统性多器官炎症和免疫反应,为开展更为深入的研究奠定了良好的基础。
参考文献
[1]mcNicholas WT.Chronic obstructive pulmonary disease and ob⁃structive sleep apnea: overlaps in pathophysiology, systemic inflam⁃mation, and cardiovascular disease [J].Am J Respir Crit Caremed, 2009,180(8):692-700.doi:10.1164/rccm.200903-0347PP.
[2] Weitzenblum E, Chaouat A, Kessler R,et al.Overlap syndrome: ob⁃structive sleep apnea in patients with chronic obstructive pulmo⁃nary disease[J].Proc Am ThoracSoc,2008,5(2): 237- 241.doi:10.1513/pats.200706-077MG.
[3] Lopez-AcevedomN, Torres-Palacios A, Elena Ocasio-Tasconm, et al.Overlap syndrome: an indication for sleep studies [J].Sleep Breath, 2009, 13(4): 409-413.doi:10.1007/s11325-009-0263-5.
[4]marin JM, Soriano JB, Carrizo SJ, et al.Outcomes in patients with chronic obstructive pulmonary disease and obstructive sleep apnea: the overlap syndrome[J].Am J Respir Crit Caremed, 2010, 182(3): 325-331.doi: 10.1164/rccm.200912-1869OC.
[5] Wang Y, Cao J, Yang QC, et al.Systematic and endothelial inflam⁃mation status and endothelial progenitor cell levels in peripheral blood in intermittenthypoxia and emphysema ratmodel[J].Tianjinmed J , 2014,42(5): 427-431.[王彦,曹洁,杨庆婵,等.间歇低氧合并肺气肿大鼠系统与内皮炎症状态及外周血内皮祖细胞水平研究[J].天津医药,2014,42(5):427-431].doi:10.3969/j.issn.0253-9896.2014.05.008.
[6]ma YJ,he Q,hu Z, et al.Hepatic oxidative stress and coagulation status in ratmodel of pulmonary emphysema combined with inter⁃mittenthypoxia[J].Tianjinmed J ,2015,43(2):177-120.[马懿江,何庆,胡志,等.间歇低氧合并肺气肿大鼠模型肝脏氧化应激及凝血功能的研究[J].天津医药,2015,43(2):177-120].doi:10.11958/j.issn.0253-9896.2015.02.002.
[7]meyer KC,Raghu G,Baughman RP,et al.An official american thorac⁃ic society clinical practice guideline: the clinical utility of bron⁃choalveolar lavage cellular analysis in interstitial lung disease[J].Am J Respir Crit Caremed,2012, 185(9):1004-1014.doi:10.1164/rccm.201202-0320ST.
[8] Thurlbeck WM.Internal surface area and othermeasurements in emphysema [J].Thorax,1967,22: 483-496.
[9] Casey KR, Cantillo KO, Brown LK.Sleep-relatedhypoventilation/hypoxemic syndromes [J].Chest,2007,131(6):1936-1948.
[10] Imai K,mercer BA, Schulman LL, et al.Correlation of lung surface area to Apoptosis and proliferation inhuman emphysema[J].Eur⁃Respir J, 2005,25(2):250-258.
[11] Kobayashi SD, Voyich JM, Somerville GA, et al.An apoptosis-dif⁃ferentiation program inhuman polymorphonuclear leukocytes facilitates resolution of inflammation [J].Leukoc Biol, 2003, 73(2): 315-322.
[12] Leuenroth SJ, Grutkoski PS, Ayala A, et al.Suppression of PMN apoptosis byhypoxia is dependent onmcl-1 andmAPK activity [J].Surgery, 2000, 128(2): 171-177.
[13] Kinh, Wang NP,halkosmE, et al.Neutrophil depletion reducesmyocardial apoptosis and attenuates NF-kappa B activation/TNF al⁃pha release after ischemia and reperfusion[J].J Surg Res , 2006, 135: 170-178.
[14] Freeman CM,hanmK,martinez FJ,et al.Cytotoxic potential of lung CD8+T cells increaseswith chronic obstructive pulmonary disease severity and with invitro stimulation by IL-18 or IL-15[J].J Immunol, 2010,184(11):6504-6513.doi: 10.4049/jimmunol.1000006.
[15] Dyugovskaya L, Lavie P, Lavie L.Phenotypic and functional charac⁃terization of blood gamma delta T cells in sleep apnea [J].Am J Respir Crit Caremed,2003,168(2): 242-249.
[16] Lumeng JC, Chervin RD.Epidemiology of pediatric obstructive sleep apnea [J].Proc Am Thorac Soc, 2008, 5(2): 242- 252.doi: 10.1513/pats.200708-135MG.
[17]hansson GK.Inflammation, atherosclerosis, and coronary artery dis⁃ease [J].N Engl Jmed, 352(16): 1685-1695, 2005.
[18] Jones CP, Rankin SM.Bonemarrow-derived stem cells and respiratory disease [J].Chest,2011,140(1): 205-211.doi: 10.1378/chest.10-2348.
[19] Nadeem R,havveym, Singhm,et al.Patients with obstructive sleep apnea display increased carotid intimamedia: Ameta-Analysis [J].Int J Vascmed,2013,2013:839582.doi:10.1155/2013/839582.
[20] OzgenAlpaydin A, KonyarArslan I, Serter S, et al.Metabolic syn⁃drome and carotid intima-media thickness in chronic obstructive pulmonary disase [J].Multidiscip Respirmed, 2013, 8(1):61.doi: 10.1186/2049-6958-8-61.
(2015-06-24收稿2015-07-17修回)
(本文编辑陆荣展)
Inflammatory and immune responses in a ratmodel of intermittenthypoxia - emphysema
HAN Shuangyu1, LI Caili2, FENG Jing2△, WANG Yubao1△
1 Infective Disease Institute, The Second Affiliatedhospital of Tianjinmedical University, Tianjin 300211, China;
2 Department of Pneumology, Generalhospital of Tianjinmedical University
△Corresponding Author E-mail:wyb2046@163.com; zyyhxkfj@126.com
Abstract:Objective To develop an "overlap syndrome (OS)" ratmodel by intermittenthypoxia (IH) exposure on the base of pre-existing emphysema, and to explore its characters of severe systemic inflammation and immune responses.Methods Sixty Wistar rats were put into four groups: control group, IH group, emphysema group and overlap (emphysema+ IH) group.The peripheral blood samples were collected for detecting apoptosis of CD3+CD4+,CD3+CD8+T lymphocytes and neutrophils (PMN).Tumor necrosis factor (TNF)-α and interleukin (IL)-6 were evaluated by ELISA.The bronchoalveolar la⁃vage fluid (BALF) was taken to calculate the ratio ofmacrophages, neutrophils and lymphocytes under lightmicroscope.Tis⁃sue blocks of lung, liver, pancreas, and right carotid artery were taken for pathologic scoring.Results The apoptotic rates of PMN and CD3+CD8+T cells were significantly lower in overlap group than those of other three groups (P < 0.05).Pro-in⁃flammatory factor IL-6, TNF-α and peripheral blood CD3+CD4+T cell apoptosis were thehighest in overlap group com⁃pared to those of other three groups (P < 0.05).The ratio of PMN andmacrophages in BALF were significantlyhigher in em⁃physema group than those of other three groups (P < 0.05) and the pathology scores of lung, liver, pancreas, the ratio of carot⁃id artery intima-media thickness of whole thickness of vascular were significantlyhigher in overlap group than those of other three groups (P < 0.05).ConclusionIn ratmodel of intermittenthypoxia-emphysema there aremore serious systemicmulti-organ inflammation and immune responses.
Key words:emphysema; inflammation; immune; intermittenthypoxia; overlap syndrome
通讯作者△E-mail:wyb2046@163.com;zyyhxkfj@126.com
作者简介:韩双羽(1990),女,硕士在读,主要从事感染性炎症疾病研究
基金项目:国家自然科学基金资助项目(81270144,30800507,81170071)
中图分类号:R563.3
文献标志码:A
DOI:10.11958/59031
作者单位:1天津医科大学第二医院感染性疾病研究所(邮编300211);2天津医科大学总医院呼吸科
