rTMS对脑梗死大鼠记忆功能及海马IL-1的影响研究
2016-03-14张靖慧方莹莹李娜
张靖慧,方莹莹,李娜
重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)是一种新型的无痛无创脑刺激技术,临床研究发现磁刺激可改善正常受试者及脑卒中患者学习记忆功能[1],提高恢复期脑卒中患者的运动学习技能,但其机制尚不明确。近年来大量研究表明白细胞介素1(interleukin-1,IL-1)在低浓度条件下具有一定脑保护作用,参与海马依赖的学习记忆过程[2],长时程增强(long-term potentiation,LTP)刺激可促进海马内IL-1β表达[3]。本研究应用脑梗死大鼠模型,观察rTMS对脑梗死后空间记忆功能以及海马区IL-1β mRNA表达的影响。
1 材料与方法
1.1 材料 ①实验动物:健康成年雄性SPF级SD大鼠45只,体质量220.2g,购自南方医科大学实验动物中心。②试剂:Trizol:15596-018,Invitrogen;cDNA第一链合成试剂盒:#K1622,Fermentas;SYBR Green/Flourescein qPCR Master Mix(2X):#K0242,Fermentas;Ex TaqTM:DRR100A,TAKARA;DL2000 DNA Marker:D501A,TAKARA;DL15000 DNA Marker:D502A,TAKARA;引物合成:南京金斯瑞。③仪器:磁刺激治疗采用YRDCCY-Ⅰ型磁刺激仪(武汉依瑞德医疗设备新技术有限公司生产) ;Morris水迷宫实验采用水迷宫实验系统(中国医学科学院生产);qRT-PCR使用illumina eco Real-Time PCR System测定。
1.2 方法 ①分组:将45只大鼠随机分为假手术组、对照组和rTMS组,每组15只。②造模:将对照组和rTMS组大鼠参照改良的Longa线栓法制作右侧大脑中动脉阻塞再灌注(transient middle cerebral artery occlusion,tMCAO)模型[4-5],脑缺血后90min将线栓拔出,完成造模。采用Bederson评分法观察大鼠清醒后行为学改变[6]。将1、2、3分动物纳入本实验。共29只大鼠制模成功并纳入本研究,实验过程中有3只死亡,最终对照组有12只、rTMS组有14只大鼠完成实验。假手术组线栓从颈总动脉分叉处进入颈内动脉约5mm,无病理行为学改变。③rTMS治疗:rTMS组大鼠从术后1d开始给予患侧大脑磁刺激治疗,采用YRDCCY-Ⅰ型磁刺激仪。将清醒状态下的大鼠固定在自制透明固定器中。8字形线圈(8字中心最大磁场强度1.8T),隔着固定器(厚0.2mm)紧贴大鼠头皮,线圈中心位于大鼠梗死侧大脑上方[7],刺激强度为120% 静息运动阈值(50%最大磁场强度),刺激频率为10Hz,总刺激量为300脉冲,单序列30脉冲,共10个序列,中间间隔50s[8],每次治疗8min。每天1次,连续5d。
1.3 评定标准 ①行为学检测:采用Morris水迷宫试验。模型制作的第3天开始,3组大鼠进行水迷宫实验,共5次,4d内完成,第1天训练2次。圆形平台固定放置于第三象限中心,放入适量水使平台低于水平面3cm。前4次为训练,每次分别从3个象限(除平台所在象限)的中点将大鼠逐一面向池壁放入水中,设定大鼠在平台上停留3s为找到平台,记录大鼠在水中寻找并爬上平台的时间,即逃避潜伏期。如果大鼠在60s内未找到平台,则将其引导至平台,停留20s以熟悉环境,此时逃避潜伏期记为60s。最后一次为检测,撤去平台,于第1象限入水点处将大鼠面向池壁放入水中,记录大鼠60s内第一次穿过平台的搜索时间(逃避潜伏期)。将最后一次成绩进行统计分析,以此来评价大鼠的空间学习记忆能力。②实时定量聚合酶链式反应(Quantitative Real-time polymerase chain reaction,qRT-PCR)检测大鼠海马IL-1β mRNA表达情况:术后6d使用ABI StepOne Plus测定。并观察梗死灶(皮层、纹状体)IL-1βmRNA表达情况。同时检测炎症相关因子:诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)。qRT-PCR内参为:肌动蛋白(β-Actin)。
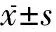
2 结果
2.1 Morris水迷宫测试 与假手术组相比,对照组及rTMS 组大鼠的逃避潜伏期均显著延长(P<0.01),而rTMS组较对照组的逃避潜伏期则明显缩短(P<0.05),见表1。
2.2 qRT-PCR结果 对照组、rTMS组IL-1β mRNA在患侧海马及皮层的表达量均较假手术组增高(P<0.01),rTMS组在患侧海马的IL-1β mRNA表达较对照组显著增高(P<0.01),在患侧皮层中rTMS组IL-1β mRNA表达较对照组无明显变化。检测患侧海马iNOS、TNFβ mRNA以明确炎症反应水平,结果提示对照组、rTMS组iNOS、TNFβ mRNA表达量均较假手术组增高(P<0.01),rTMS组较对照组有所下降,但无显著差异。见表2。
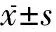
表1 rTMS对脑梗死大鼠空间学习记忆功能的影响 分,
与假手术组比较,aP<0.05;与对照组比较,bP<0.05
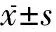

组别nIL⁃1βmRNA患侧海马患侧皮层患侧海马区iNOSTNF⁃α假手术组151111对照组 121.82±0.48a3.34±0.51a3.15±0.27a1.59±0.18arTMS组146.14±1.05ab4.61±0.93a2.66±0.37a1.46±0.07a
与假手术组比较,aP<0.05;与对照组比较,bP<0.05
3 讨论
本研究通过Morris水迷宫实验观察rTMS对空间学习记忆功能的影响,结果发现,对照组大鼠逃避潜伏期较假手术组明显延长,rTMS组大鼠逃避潜伏期较对照组明显缩短,说明rTMS一定程度上改善脑梗死大鼠空间学习记忆功能。
IL-1是一种经典炎性细胞因子,存在α、β两种异构体,主要合成部位是海马,生理情况下,IL-1及IL-1mRNA在脑内含量很低,并且以IL-1β为主。正常生理状态下,IL-1β对记忆固化起重要作用,参与海马依赖的学习记忆过程。生理状态下低浓度IL-1β可协同IL-6,促进神经生长因子释放、新血管形成、胶质增生,从而增强神经细胞抗缺血能力和促进修复作用[9]。条件性恐惧实验或者LTP刺激后大鼠海马区IL-1βmRNA表达增加[3,10],腹腔注射小剂量IL-1β可促进大鼠躲避记忆和条件性恐惧记忆能力[11]。急性脑梗死引起IL-1β浓度病理性增高,成为一种内源性致热源,在炎症和急性期反应中发挥作用,参与神经损伤,促进炎症反应,扩大脑梗死面积。脑梗死后IL-1β表达具有一定时间依赖性,动物研究表明, IL-1β mRNA在脑梗死后6h开始增高,12h~3d达到高峰,随后逐渐下降至正常水平[12],本研究中脑梗死后6d梗死灶与患侧海马区IL-1βmRNA表达水平仍高于假手术组,与文献报道基本一致[12]。本研究于脑梗死急性期(MCAO术后1d)给予rTMS治疗,结果显示rTMS促进患侧海马区IL-1β mRNA表达增加,对梗死灶IL-1β mRNA表达无明显改变,提示其具有部位特异性,而且rTMS不影响其它炎症因子(iNOS、TNF-α)表达,提示rTMS对炎症反应无增强作用。其具体机制尚不明确,但初步提示了海马区IL-1β浓度改变在脑梗死后学习记忆功能恢复过程中可能起到重要作用。此外rTMS为脉冲样刺激模式,一般认为其作用机制与突触可塑性相关。rTMS对神经的调控作用有明显的频率依赖性,高频(>1Hz)rTMS对神经兴奋性的调控表现为类似LTP作用。LTP刺激可促进大鼠海马区IL-1βmRNA表达增加[3,10],根据本研究结果推测rTMS可能通过影响海马区IL-1β以改善脑梗死后空间记忆功能。
本研究使用的磁刺激线圈刺激面积较大,无法实现精确靶向刺激患侧海马区。研究表明空间学习记忆功能需要完整的神经网路参与,在空间导航过程中,海马是主要参与部位,而在回忆过程中,除了海马,还需要海马旁皮层的参与,海马旁皮层包括内外侧前额叶、楔前叶、后扣带回、压后皮层以及内外侧颞叶区[13]。最新研究发现皮层下内侧隔/斜角带核的GABA能神经元的突触与海马神经元形成链接[14],从细胞层面上证实了海马与皮层间存在神经网络。本研究结果提示患侧大脑在磁刺激后海马区IL-1βmRNA表达增高,可能是海马神经元受到磁刺激直接作用的结果,亦可能是磁刺激促进整个学习记忆神经网络重建的结果,其具体机制需进一步研究证实。
综上所述,本研究表明急性期脑梗死行rTMS治疗可促进空间学习记忆功能恢复,其作用机制可能与rTMS增加患侧海马区IL-1βmRNA表达相关,为进一步探索rTMS治疗脑卒中最佳治疗方案提供有力基础依据。
[1] Di Pino G,Pellegrino G,Assenza G,et al. Modulation of brain plasticity in stroke: a novel model for neurorehabilitation[J]. Nat Rev Neurol,2014,10(10):597-608.
[2] Labrousse VF,Costes L,Aubert A,et al. Impaired interleukin-1beta and c-Fos expression in the hippocampus is associated with a spatial memory deficit in P2X(7) receptor-deficient mice[J]. PLoS One,2009,4(6):e6006-6006.
[3] Schneider H,Pitossi F,Balschun D,et al. A neuromodulatory role of interleukin-1beta in the hippocampus[J]. Proc Natl Acad Sci USA,1998,95(13):7778-7783.
[4] Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[5] Shen CC,Yang YC,Chiao MT,et al. Characterization of endogenous neural progenitor cells after experimental ischemic stroke[J]. Curr Neurovasc Res,2010 Feb;7(1):6-14.
[6] Bederson JB,Pitts LH,Tsuji M,et al. Rat middle cerebral artery occlusion: evaluation of the model and development of a neurologic examination[J]. Stroke,1986,17(3):472-6.
[7] 赵秀秀,韩肖华,郭风,等. 高频重复经颅磁刺激对脑缺血后海马BDNF、VEGF和Nestin表达的影响[J]. 神经损伤与功能重建, 2013,8(6):431-434.
[8] 张靖慧,韩肖华,赵秀秀,等. 重复经颅磁刺激对脑缺血后神经干细胞增殖以及miR-9表达的影响[J]. 中华物理医学与康复杂志, 2012,34(10):725-728.
[9] Hewett SJ,Jackman NA,Claycomb RJ. Interleukin-1beta in Central Nervous System Injury and Repair[J]. Eur J Neurodegener Dis, 2012,1(2):195-211.
[10] Goshen I,Kreisel T,Ounallah-Saad H,et al. A dual role for interleukin-1 in hippocampal-dependent memory processes[J]. Psychoneuroendocrinology, 2007,32(8-10):1106-1115.
[11] Yirmiya R,Goshen I. Immune modulation of learning,memory,neural plasticity and neurogenesis[J]. Brain Behav Immun, 2011,25(2):181-213.
[12] Song C,Zhang Y,Dong Y. Acute and subacute IL-1beta administrations differentially modulate neuroimmune and neurotrophic systems: possible implications for neuroprotection and neurodegeneration[J]. J Neuroinflammation, 2013,10:59-59.
[13] Mullally SL,Maguire EA. Memory,Imagination,and Predicting the Future: A Common Brain Mechanism[J]? Neuroscientist, 2013,20(3):220-234.
[14] Unal G,Joshi A,Viney TJ,et al. Synaptic Targets of Medial Septal Projections in the Hippocampus and Extrahippocampal Cortices of the Mouse[J]. J Neurosci,2015,35(48):15812-15826.
