构树叶中一个新内酯*
2016-03-13李红伟郑晓珂冯卫生
李红伟,郑晓珂,冯卫生**
(1.河南中医学院药学院 郑州 450046;2.呼吸疾病诊疗与新药研发河南省协同创新中心 郑州 450046)
构树叶中一个新内酯*
李红伟1,2,郑晓珂1,2,冯卫生1,2**
(1.河南中医学院药学院 郑州 450046;2.呼吸疾病诊疗与新药研发河南省协同创新中心 郑州 450046)
目的:对构树叶治疗慢性前列腺炎的药效物质基础进行研究。方法:利用柱色谱方法对构树叶进行分离,根据其理化性质和波谱数据鉴定化合物结构。结果:分离得到1个新内酯类成分构树内酯A{(4R,5S,10S)-8,9,10-trihydroxy-4-[3′-methoxy-4′-hydroxyphenyl]-1,6-dioxaspi ro[4,5]decan-2-one),同时分离得到8个已知化合物(2-9):β-谷甾醇(2)、2′-尿嘧啶脱氧核苷(3)、胸腺嘧啶脱氧核苷(4)、2′-脱氧腺苷(2′-deoxyuridine,5)、落叶松脂素-9-O-β-D-吡喃葡萄糖苷(6)、左旋丁香树脂酚-4-O-β-D-吡喃葡萄 糖苷(7)、对羟基苯乙酮(8)、十七烷酸(9)。结论:构树内酯A(1)为新内酯类成分;上述化合物除化合物2外均为首次从构树中分离得到。
构树 构树内酯A 化学成分 慢性前列腺炎
构树[Broussonetia papyrifera(L.)Vent.]为桑科构树属植物,分布于中国绝大部分地区(东北北部、西北北部除外),亚洲其他国家,如日本等国亦有分布,资源丰富。构树叶又称为楮叶,性凉味甘,无毒,能清热利湿、凉血止血、杀虫解毒,多用于治疗内外出血症、水肿、疝气、痢疾、癣疮等[1]。研究表明,构树叶中含有黄酮、甾体、木脂素、生物碱、香豆素、氨基酸和萜类,这些成分具有抗血小板聚集、抑制芳香化酶、抗氧化、抗菌、抗炎、抗细胞毒等活性[1]。本课题组前期在大鼠前列腺炎模型上的研究发现,构树叶不同提取部位给药组的白细胞数均比模型组低,表明构树叶有治疗前列腺炎的作用,并以乙醇部位的作用更好[2]。体外抗真菌实验表明,构树叶不同溶剂提取物对10种致病真菌具有抑制作用,抑菌浓度(Minimal Inhibitory Concentration,MIC)为50-400 mg·mL-1,以乙酸乙酯和正丁醇部位最好[3]。基于以上药理作用研究,本课题组对构树叶的石油醚部位、乙酸乙酯部位、正丁醇部位化学成分进行系统分离。大量的黄酮类与紫罗兰型单萜类成分被发现[4,5]。在进一步的研究中,一个新的内酯类成分(4R,5S,10S)-8,9,10-trihydroxy-4-[3′-methoxy-4′-hydroxyphenyl]-1,6-dioxaspiro[4,5]decan-2-one (broussolactone A,1)被发现,同时包含8个已知化合物(2-9)。本文将对其分离和结构鉴定进行详细论述。
1 仪器与试药
DPX-400核磁共振仪测定,TMS为内标。Sephadex LH-20为 Parmacia Bioteck产 品,MCI Gel CHP-20、Toyopearl HW-40C、Diaion HP-20系日本三菱公司生产,柱层析硅胶H由青岛海洋化工厂生产(颗粒范围80-200目),薄层色谱法(Thin Liquid Chromatography,TLC)吸附剂为青岛海洋化工厂生产硅胶G(颗粒范围10-40 μm)。红外分光光度计Shimadzu FTIR-8201 PC;Zabspec Tofspec Platform-ESI质谱仪。SHB-B95 A型循环水式多用真空泵(郑州长城科工贸有限公司),Kofler显微测熔仪测定熔点。N-1000型旋转蒸发仪(上海爱朗仪器有限公司),DFZ-3型真空干燥箱(上海医用恒温设备厂生产)。
实验所用构树叶,采自河南省西峡县,经河南中医学院陈随清教授鉴定为桑科构树属植物构树(Broussonetia papyrifera L.Vent)的叶。标本存于生药研究室(编号为20030810)。
2 提取与分离
取干燥的构树叶8.5 kg,50%含水丙酮破碎组织提取两次,合并提取液,低温减压浓缩,得稠膏1 606.5 g。加适量水稀释后,依次用极性不同的溶剂反复萃取,分别得到乙醚70 g、乙酸乙酯60 g、正丁醇75.5 g和水部位4个部位。
乙醚部位(70.0 g)利用硅胶柱色谱分离,石油醚-乙酸乙酯(petroleum ether-EtOAc)为流动相,进行梯度洗脱得到不同流份Fraction A-J。Fraction A(8.6 g)和Fraction B(4.2 g)进一步利用硅胶柱色谱分离,流动相为石油醚-乙酸乙酯(3:1),分别得到化合物2(23 mg)和9(20 mg)。乙酸乙酯部位(60.0 g)利用硅胶柱色谱分离,CHCl3-MeOH为流动相,得到不同流份Fraction A-D。Fraction A(9.5 g)进一步利用硅胶柱色谱分离,流动相为EtOAc-EtOH-H2O(15:2:1),得到化合物7(25 mg)和4(20.0 mg)。Fraction B(8.5 g)利用凝胶柱色谱Toyopearl HW-40C进行分离,流动相为MeOH:H2O,得到化合物5(20 mg);Fraction C(6.2 g)利用硅胶柱色谱分离,流动相为EtOAc-EtOH-H2O(10:2:1),梯度洗脱,得到4组流份Fractions C1-C4,Fraction C2利用凝胶柱色谱Toyopearl HW-40C进行分离,流动相为MeOH:H2O,梯度洗脱,分别得到化合物3(22 mg)和6(24 mg)。正丁醇组分(75.5 g)用适量的水稀释,上大孔吸附树脂Diaion HP-20柱色谱进行分离,流动相为含水甲醇(0%-80%),梯度洗脱,其中20%MeOH洗脱部位(4.2 g),硅胶柱色谱分离,流动相为石油醚-乙酸乙酯(3:1),得到化合物1(23 mg)和8(17 mg)。
3 结构鉴定
化合物1:无色油状物,溶于甲醇、丙酮。茴香醛-硫酸喷雾显紫红色,渐变为灰紫色(105℃)。三氯化铁-铁氰化钾喷雾显蓝色,说明含有酚羟基。[a]eqD=-39.0°(c 0.18,MeOH);UVλmax(MeOH)(logε):209(2.73)、231(1.73)、281(0.72);IR(KBr)υmaxcm-1:3 410、1 774、1 518、1 273、1 198、1 238、1 123、1 047、922,说明其含有苯环和羟基。ESI-MS谱给出的分子量为m/z 349.3[M+Na]+,分子量为326。ESI-MS m/z 327.107 6[M+H]+(calcd.327.108 0),344.134 2[M+NH4]+(calcd.344.134 5),349.088 7 [M+Na]+(calcd.349.089 9)。
1H-NMR(400 MHz,CD3OD)谱中δ6.81(dd,J=8.2,1.9 Hz)、6.75(d,J=8.2 Hz) 和 6.93(d,J= 1.9 Hz)构成了一个ABC耦合系统,表明该化合物结构中存在一个1,3,4-三取代苯环结构。13C-NMR (100 MHz,CD3OD)谱中存在15碳原子信号峰,包括一个甲基、两个亚甲基、7个次甲基和5个季碳原子。对这15个碳原子信号峰进行化学位移归属,表明含有一个羰基信号峰δ177.1、一个苯环6碳信号峰和6个含氧碳信号峰[δ56.4,65.4,70.6,71.6,76.3和110.3]。结合NMR谱图分析和糖检测Molish反应阴性,表明结构中不含糖结构片段。利用1H,13C-NMR,COSY,HMBC和HSQC谱综合分析,结构中存在γ-丁内酯片段[δ4.00/δ46.0(1H,dd,J=12.5,8.4 Hz),两个同碳耦合质子δ3.12/ δ34.3(1H,dd,J=17.2,12.5 Hz),δ2.76/δ34.3(1H,dd,J=17.2,8.4 Hz),δ177.1和110.3],一个三羟基饱和5元环,通过半缩醛结构相连,最终形成了1,6-dioxaspiro[4,5]decan-2-one作为化合物1的母核骨架结构。其1H-NMR、13C-NMR和DEPT-135相关关系见表1。
通过耦合常数分析可知,C-10、C-9和C-8上的3个羟基处于椅式构象平伏键上。在NOESY谱中可以看到H-4(δ4.00)和H-3α(δ3.12),H-9(δ3.57)和H-7b(δ3.53)显著相关,因此,H-4和H-3α位于γ-丁内酯同一平面上,H-9 和H-7b位于三羟基吡喃环的同侧(图1)。同时与已知化合物cyclonoside、sawaranospirolide C、Foveospirolide比较,化合物1含有一个甲氧基片段[6]。通过以上分析,故确定该化合物为(4R,5S,10S)-8,9,10-trihydroxy-4-[3′-methoxy-4′-hydroxyphenyl]-1,6-dioxaspiro[4,5]decan-2-one (broussolactone A,1)。

表1 化合物1的核磁数据
化合物2:白色针状结晶,易溶于氯仿。mp140-142℃,1%茴香醛-硫酸显紫色。1H-NMR(400 MHz,CD3OD):δ5.36(1H,d,J=4.8 Hz,H-6)、3.53(1H,m,H-3)、0.68、0.82、0.84、0.86、0.92、1.01为 6个甲基信号峰。13C-NMR(100 MHz,CD3OD)谱中显示29个碳信号,该化合物可能为甾类化合物,δ140.8及δ121.7为双键上两个碳原子信号,δ71.8处碳为羟基取代的碳信号峰,故确定该化合物为β-谷甾醇(β-sitosterol)[7]。
化合物3:淡黄色油状物,溶于甲醇、丙酮。茴香醛-硫酸喷雾显灰蓝色(105℃)。1H-NMR(400 MHz,CD3OD)和13C-NMR(100 MHz,CD3OD)数据见表2。经与文献比较,确定此化合物为2'-尿嘧啶脱氧核苷(2′-deoxyadenosine)[8]。

图1 化合物1中HMBC和NOESY的结构图

表2 化合物3、4、5核磁数据
化合物4:无色针状结晶,溶于甲醇、丙酮。茴香醛-硫酸喷雾显灰紫色(105℃)。1H-NMR(CDOD3,400 MHz)和13C-NMR(100 MHz,CD3OD)数据见表2。经与文献比较,确定此化合物为胸腺嘧啶脱氧核苷(thymidine)[9]。
化合物5:白色粉末,溶于甲醇、丙酮。茴香醛-硫酸喷雾显紫色。1H-NMR(400 MHz,CD3OD)和13C-NMR(100 MHz,CD3OD)数据见表2,经与文献数据比较,确定此化合物为2′-脱氧腺苷(2′-deoxyuridine)[10]。
化合物6:淡黄色粉末,溶于甲醇、水、丙酮,易溶于甲醇。三氯化铁-铁氰化钾反应显蓝色。茴香醛-硫酸喷雾显紫红色(105℃)。1H-NMR(C DOD3,400 MHz)和13C-NMR(CDOD3,100 MHz)数据见表2。经与文献比较,该化合物为落叶松 脂素-9-O-β-D-吡喃 葡萄糖苷(lariciresinol-9-O-β-D-glucopyranoside)[11]。

表3 化合物6、7核磁数据
化合物7:白色粉末,溶于甲醇、丙酮。三氯化铁-铁氰化钾反应显蓝色。茴香醛-硫酸喷雾显红色,渐变为紫色(105℃)。1H-NMR(CDOD3,400 MHz)和13C-NMR(CDOD3,100 MHz)数据见表3。经与文献比较,该化合物为左旋丁香树脂酚-4-O-β-D-吡喃葡萄糖苷[(-)-syringaresinol-4′-O-β-D-glucopyranoside][12]。
化合物8:无色针状结晶,溶于甲醇、丙酮。三氯化铁-铁氰化钾反应显蓝色。茴香醛-硫酸喷雾显桔黄色。1H-NMR(CDOD3,400 MHz):δ6.82 (2H,d,J=8.8 Hz,H-3,5),7.87(2H,d,J=8.8 Hz,H-2,6),2.51(3H,s,CH3)。13C-NMR(CDOD3,100 MHz):δ 1 9 9.4(C=O),1 1 6.2(C-2,6),1 6 3.9 (C-1),132.1(C-3,5),130.1(C-4)。经与文献比较,确定此化合物为对羟基苯乙酮(p-hydroxyacetophenone)[13]。
化合物9:白色无定形粉末,易溶于氯仿。1%茴香醛-硫酸显紫色,渐变成绿色。EI-MS m/z:270.5。1H-NMR(CDOD3,400 MHz):δ2.34(2H,t,J=7.4 Hz),8-13(1H,br.s),1.25(26H),0.89(3H,t),1.63(2H,m)。13C-NMR(CDOD3,100 MHz):δ179.47、31.93、33.95、29.44、29.60、29.07、29.37、22.70、29.25、24.69、14.12。经与文献数据比较基本一致,与标准品对照展距、显色均一致且混合熔点不下降,确定该化合物为十七烷酸(heptadecanoic acid)[14]。
4 化合物1的生合成途径
化合物1的生合成途径的起始物为维生素C (Vitamin C,Ascorbic Acid),又叫L-抗坏血酸,是一种水溶性维生素,水果和蔬菜中含量丰富[15,16]。C-3位引入酪氨酸片段,C-5构型通过烯二醇离子化,环化反应产生sawaranospirolide C(11)。甲氧基引入苯环3′位,合成broussolactone A(1)(图2)。
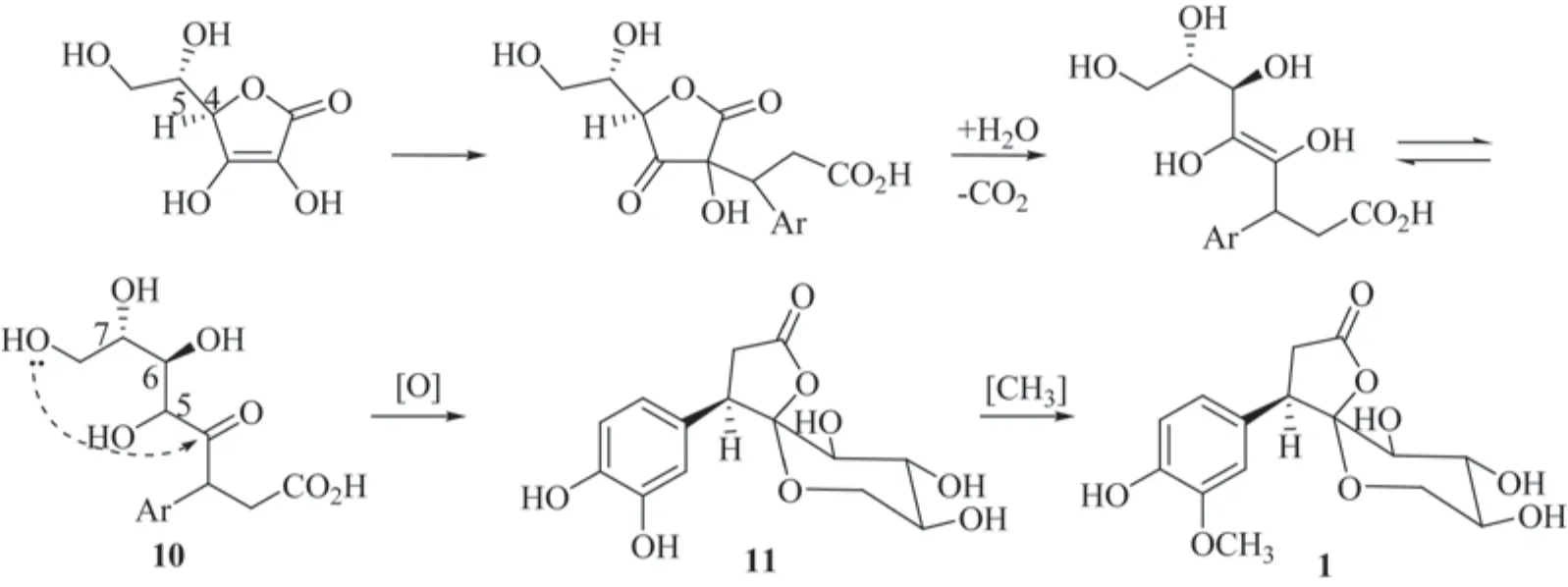
图2 化合物1生合成途径
5 讨论
构树资源丰富,构树叶作为可再生资源,对其开发利用具有重要的意义。构树叶的药 用历史悠久,并且在河南南阳等部分地区,民间有用构树叶治疗慢性前列腺炎的习惯,且具有一定的效果。本课题组在前期体内前列腺炎模型和体外抑菌实验研究的基础上,发现构树叶不同提取部位对前列腺炎均有一定的疗效。在对这些作用部位进行化学成分分离或分析中,我们发现了大量的黄酮、单萜类成分,其中β-谷甾醇具有植物雌激素样作用[17]。体外抗菌实验表明,同科植物桑叶对枯草芽孢杆菌、蜡样芽孢杆菌和金黄色葡萄球菌有较强的抑制作用,二者在化学成分上具有一定的相似性[18]。
对于先前报道的生物碱、三萜、甾体类成分并未分离得到,可能是我们提取溶剂采用含水丙酮,溶剂的极性相对较大,需要进一步地采用不同的溶剂,并结合民间用构树叶的用药方法进行提取,对其中的生物碱、三萜、甾体等成分进行研究,同时对所含有的大量蛋白质、多糖等大分子物质进行研究,并把分离得到的单体成分进行体内和体外治疗慢性前列腺炎研究,为构树叶治疗慢性前列腺炎提供科学依据,最终开发成重大创新中药。
参考文献
1 冯卫生,李红伟,郑晓珂.构树化学成分的研究进展.中国新药杂志, 2008, 17(4): 272-278.
2 陈随清,黄显章,崔瑛,等.构树叶对大鼠前列腺炎模型的影响.中药药理与临床, 2006, 22(3, 4): 110-111.
3 崔璨,陈随清,魏雅磊.构树叶体外抗真菌作用的研究.河南科学, 2009, 27(1): 40-42.
4 Feng W S, Li H W, Zheng X K, et al. Chemical constituents from the leaves of Broussonetia papyrifera. Yao Xue Xue Bao, 2008, 43(2): 173-180.
5 Feng W S, Li H W, Zheng X K, et al. Two new megastigmane O-glucopyrano-sides from the leaves of Broussonetia papyrifera. Chin Che m Lett, 2007, 18(12): 1518-1520.
6 Somwong P, Suttisri R, Buakeaw A. New sesquiterpenes and phenolic compound from Ficus foveolata. Fitoterapia, 2013, 85(1): 1-7.
7 曹新伟,陈四保,陈士林,等.川贝母中非生物碱类成分的研究.世界科学技术-中医药现代化, 2008, 10(2): 83-88.
8 Zou Z R, Yi Y H, Yao X S, et al. Studies on chemical constituents of Acaudina molpadioides semper. Chin J Nat Med, 2004, 2(6): 348-350. 9 He X J, Qiu F, Yao X S. The active constituents research of Gualou Xiebai Baijiu Tang (VI): Nitrogen-containing compounds and others. Nat Pro Res Dev, 2003, 15(1): 9-12.
10 Huang X F, Luo J, Zhang Y, et al. Studies on lignan components of Asparagus officinali. Chin Pharm J, 2007, 42(5): 339-340.
11 张静娇,马跃平,袁久志,等.红松松针中木脂素类成分的分离与鉴定.沈阳药科大学学报, 2010, 27(10): 797-802.
12 赵明,陈城城,杨森桥,等.白桑叶化学成分研究.中成药, 2012, 34(6): 1126-1131.
13 李翼鹏,周玉枝,陈刚,等.徐长卿中酚类成分的分离与鉴定.沈阳药科大学学报, 2014, 31(6): 444-447.
14 周世良,李君丽,王燕,等.阔叶五层龙石油醚部位化学成分研究.中国实验方剂学杂志, 2013, 19(24): 129-132.
15 Hasegawa S, Koyanagi H, Hiros e Y. Decarboxylated ascorbigens in the heartwood of Chamaecyparis pisifer. Phytochemistry, 1990, 29(1):261-266.
16 Robertson J, Chovatia P T, Fowler T G, et al. Oxidative spirocyclisation routes towards the sawaranospirolides. Synthesis of entsawaranospirolides C and D. Org Biomol Chem, 2010, 8(1): 226-233.
17 陶仕英,牛建昭,王继峰,等. b-谷甾醇对T47D细胞增殖和细胞周期的影响及作用机制探讨.世界科学技术-中医药现代化, 2015, 17(2): 362-366.
18 佟天天,黄浩,王义明,等.60味中药提取物抗菌活性的研究.世界科学技术-中医药现代化, 2013, 15(6): 1268-1273.
A New Lactone from Leaves of Broussonetia papyrifera (L.) Vent.
Li Hongwei1,2, Zheng Xiaoke1,2, Feng Weisheng1,2
(1. School of Pharmacy, Henan University of Traditional Chinese Medicine, Zhengzhou 450046, China; 2. Collaborative Innovation Center for Respiratory Disease Diagnosis and Treatment & Chinese Medicine Development of Henan Province, Zhengzhou 450046, China)
This study was aimed to investigate the pharmacodynamic substances of the leaves of Broussonetia papyrifera (L.) Vent in the treatment of chronic prostatitis. Chemical constituents were isolated by column chromatography. Its structure was identified according to its physiochemical characteristics and spectral data. The results showed that a new lactone, broussolactone A {(4R, 5S, 10S)-8, 9, 10-trihydroxy-4-[3′-methoxy-4′-hydroxyphenyl]-1, 6-dioxaspiro [4, 5] decan-2-one), was isolated from the leaves of B. papyrifera (L.) Vent. Meanwhile, 8 known compounds (2-9) were isolated, which contained β-sitosterol (2), 2′-deoxyadenosine (3), thymidine (4), 2′-deoxyuridine (5), lariciresinol-9-O-β-D-glucopyranoside (6), (-)-syringaresinol-4-O-β-D-glucopyranoside (7), p-hydroxyacetophenone (8), and heptadecanoic acid (9). It was concluded that broussolactone A (1) was a new lactone. Compounds 3-8 were obtained from B. papyrifera (L.) Vent for the first time.
Broussonetia papyrifera (L.) Vent, broussolactone A, chemical constituent, chronic prostatitis
10.11842/wst.2016.01.014
R284.1
A
(责任编辑:刘馨雨 张志华,责任译审:王 晶)
2015-07-25
修回日期:2015-10-10
* 教育部国家科学技术研究重大、重点项目(03078):伏牛山区系中药资源分析研究,负责人:冯卫生;河南中医学院博士科研基金项目(BSJJ2012-04):基于中药性味的可拆分性、可组合性研究,负责人:李红伟。
** 通讯作者:冯卫生,本刊编委,教授,博士生导师,主要研究方向:中药药效物质基础研究及新药开发。
