二嗪磷降解菌的分离、鉴定及其降解特性*
2016-03-13李瑞雪武少贤龚玉宝江苑苑王志佳孙乃越王光利
李瑞雪 武少贤 龚玉宝 江苑苑 王志佳 孙乃越 王光利
(淮北师范大学生命科学学院,安徽 淮北 235000)
二嗪磷(C12H21N2O3PS),又名二嗪农、地亚农,化学名称为O,O-二乙基-O-(2-异丙基-6-甲基-4-嘧啶基)硫代磷酸酯[1],是一种广谱有机磷杀虫剂,具有触杀、胃毒和一定的内吸作用,可防治棉蚜、棉红蜘蛛、稻飞虱、稻叶蝉、稻二化螟、三化螟以及玉米、小麦、花生地下害虫。此外,二嗪磷还广泛应用于兽药领域,也可作家庭卫生用杀虫喷雾剂,应用前景广阔[2-4]。该产品自问世以来,经受了毒性、残留、品种更新换代、害虫抗性等多种因素的长期考验,经久不衰,在瑞士、美国、日本、前苏联等国生产能力均在500 t/a以上,世界产量在万吨以上,占有机磷杀虫剂的第二位[5]。二嗪磷在广泛使用的同时,给人类健康和生态环境带来的安全隐患逐渐引起人们的重视。已有大量事实及毒性研究结果表明,二嗪磷是对鸟类具有高毒性和高风险的农药品种,仅仅一粒颗粒剂或用二嗪磷处理过的种子就可以杀死一只小鸟[6-7]。如今,二嗪磷在世界各地被频繁检出,欧美国家在多项水体中杀虫剂浓度水平的调查研究中发现,二嗪磷是水体中常见的农药残留污染物之一。生物毒性实验表明,其对生物体的神经系统有毒害作用并给周围生态环境带来长期的生态风险[8]。因此,二嗪磷降解菌的筛选和分离具有非常重要的理论意义和应用价值。
农药在自然环境中可通过物理、光化学等许多方法被降解消除,但是大多数农药在自然环境中的半衰期较长,由于土壤中微生物数量大、种类多,几乎所有能造成环境污染的有机物都能被微生物所分解、利用,所以微生物对环境污染物的降解起着至关重要的作用[9]。自1973年第一次分离出二嗪磷的降解菌黄杆菌后,又陆续发现假单胞杆菌、沙雷氏菌、粘质沙雷氏菌、石竹伯克霍尔德氏菌、缺陷短波单孢菌和节杆菌均能将二嗪磷作为唯一碳源[10-12]。索氏菌属(Thauerasp.),广泛分布于土壤和水环境中。已报道的索氏菌属中有降解间羟苯甲酸盐、原儿茶酸、甲氧基芳香族化合物等的种类,在环境修复中扮演重要角色[13-15]。本课题组从长期受二嗪磷污染的污泥中分离出一株新的能高效降解二嗪磷的索氏菌,并研究了5种金属离子、3种营养物质以及盐浓度等因素对二嗪磷降解效率的影响。该研究对于修复环境中二嗪磷的污染具有重要的参考价值。
1 材料与方法
1.1 主要仪器与试剂
高效液相色谱仪;聚合酶链反应(PCR)仪;紫外—可见分光光度计;Eppendorf可调移液器(0.1~2.5、0.5~10.0、10~100、100~1 000 mL);恒温空气摇床;BT423S电子天平;恒温培养箱;精密pH计;高速冷冻离心机;二嗪磷(纯度96%);其他化学试剂均为分析纯。
1.2 主要培养基
无机盐(MM)培养基: NaCl 1.00 g/L,K2HPO41.50 g/L,KH2PO40.5 g/L,NH4NO31.00 g/L, MgSO4·7H2O 0.20 g/L,pH 7.0。将添加70 mg/L二嗪磷的MM培养基标记为MM-1培养基。
LB固体培养基:蛋白胨 10.0 g/L,酵母粉 5.0 g/L,NaCl 10.0 g/L,加入1.5%(质量分数)琼脂。
无碳无氮培养基:NaCl 1.00 g,K2HPO41.50 g,KH2PO40.5 g,MgSO4·7H2O 0.20 g,去离子水1 000 mL。将添加70 mg/L二嗪磷的无碳无氮培养基标记为MM-2培养基。
1.3 细菌的富集、分离和培养
取长年生产二嗪磷农药的工厂排污口处污泥10.0 g于100 mL MM-1培养基中,30 ℃、160 r/min摇瓶培养。7 d后从中移取5 mL富集液转接到新鲜的100 mL MM-1培养基中。连续4次传代培养后,使用高效液相色谱仪检测二嗪磷含量。取1 mL有降解二嗪磷能力的富集液,采用梯度稀释涂布平板法涂布于含200 mg/L二嗪磷农药的LB固体培养基上,置于30 ℃恒温培养箱中培养。挑取有透明圈的菌落在含200 mg/L二嗪磷农药的LB固体培养基平板上不断划线并验证其降解能力,直至获得能降解二嗪磷的纯菌YM-3。
1.4 降解菌株的形态特征和生理生化特性
菌株YM-3于LB固体培养基30 ℃培养48 h后,观察菌落颜色及形态。通过革兰氏染色、芽孢染色、鞭毛染色观察其个体形态[16]。降解菌株的生理生化特性鉴定参照《常见细菌系统鉴定手册》[17]。
1.5 降解菌株16S rRNA基因的扩增与测序
细菌基因组DNA的提取采用高盐法,菌株YM-3的16S rRNA基因的PCR扩增采用50 μL反应体系:DNA模板(50 ng/μL)1 μL,dNTP(2.5 mmol/L)4 μL ,引物(1 mmol/L)各1 μL,10×PCR Buffer 5 μL,rTaq酶(5 U/μL)0.5 μL,双蒸水(ddH2O) 37.5 μL,所使用引物为通用引物27F(5’-GAGTTTGATCATGGCTCAG-3’)、1492R(5’-GGTTACCTTGTTACGATC-3’)[18-20]。测序委托上海生工测序公司完成。
1.6 降解菌株系统发育地位的确定
将降解菌株的16S rRNA基因序列在NCBI上进行在线比对并分析,并在EzTaxone (hppt://eztaxon-e.ezbiocloud.net/)上进行同源性比对,选择同源性较近的序列运用MEGA 6.0建立其进化树[21]。
1.7 菌株YM-3降解特性的研究
通过摇床实验研究不同温度、pH、接种量、装液量、底物浓度、盐浓度、金属离子和营养物对底物降解的影响。结果表明,最佳降解温度和pH分别为30 ℃和7.0,以下不作详细叙述。将YM-3的菌液分别做以下处理:(1)按1%(体积分数)的接种量接种于分别装有15、30、45、60、75、90、105 mL MM-2培养基的250 mL的三角瓶中。(2)按1%、2%、5%、8%、10%和20%的接种量分别接入10 mL MM-2培养基中。(3)按1%的接种量分别接种于含5、10、15、20、25、30、35、40、50、100 g/L NaCl的10 mL MM-2培养基中。(4)按1%的接种量分别接入含10、100、1 000、10 000 mg/L 4个浓度梯度的葡萄糖、酵母粉和蛋白胨的10 mL MM-2培养基中。(5)按1%的接种量分别接入含0.1、1.0、2.0 mmol/L 3个摩尔浓度梯度的Cu2+、Ca2+、Ba2+、Li+和Zn2+的10 mL MM-2培养基中。(6)按1%的接种量分别接入含70、90、110 mg/L二嗪磷的10 mL无碳无氮培养基中。摇床培养36 h后通过高效液相色谱仪测二嗪磷的浓度。
1.8 检测方法
二嗪磷的提取在CHEN[22]的方法上稍加改进:向实验组MM-1和MM-2培养基中加入等体积的二氯甲烷,剧烈振荡10 min后,静置至水相与有机相分层。移出有机相,并加入适量无水硫酸钠去除有机相中残留的水分。将有机相移出,氮气吹干后,加入2.0 mL乙醇将其溶解,经0.45 μm有机滤膜过滤后,通过高效液相色谱仪测定二嗪磷的含量。流动相为甲醇∶水(体积比48∶52),流速为1.0 mL/min,进样量为20 μL,波长为244 nm,出峰时间为11 min。

图1 采用邻接法对菌株YM-3及其相关的种的系统发育分析Fig.1 Phylogenetic analysis of strain YM-3 and related species using the neighbor-joining approach
2 结果与分析
2.1 菌种分离与鉴定
从污泥中筛选到能高效降解二嗪磷的菌株YM-3,该菌为革兰氏阳性;最适生长温度为30 ℃;在LB固体培养基平板上单菌落呈淡黄色、圆形、边缘整齐、表面湿润有光泽;经16S rRNA基因序列同源性分析,如图1所示,菌株YM-3与索氏菌属位于同一分支上,与ThaueraaminoaromaticaT(AMXD01000247)序列相似度高达97.52%,所以鉴定其为索氏菌属,GenBank登陆号为KU321686。
2.2 菌株YM-3的降解曲线
按1%的接种量将菌悬液(600 nm处光密度(OD600)值为1.0)接种到MM-1培养基中,每隔12 h取出10 mL培养液按1.8中所述方法测定二嗪磷的含量,得到其降解曲线。结果表明,当底物质量浓度为70 mg/L时,在第一个12 h内二嗪磷的降解速率为3.4 mg/h,72 h时二嗪磷的降解率高达91%。
2.3 菌株YM-3降解特性
2.3.1 接种量对菌株YM-3二嗪磷降解率的影响
如图2所示,接种量对菌株的降解率有很大的影响。接种量在0~5%时,菌株YM-3对二嗪磷的降解率随接种量的增大而迅速增加;在5%~20%时降解率缓慢增加。说明当接种量小于5%时,供菌体生长的营养物质充足,因此二嗪磷的残留量迅速降低。

图2 接种量对菌株YM-3二嗪磷降解的影响Fig.2 Effect of inoculation amount on diazinon degradation by strain YM-3
2.3.2 装液量对菌株YM-3二嗪磷降解率的影响
为考察装液量对二嗪磷降解的影响,将菌株YM-3(OD600=1.0)按1%的接种量接种于分别装有15、30、45、60、75、90、105 mL MM-2培养基的250 mL的三角瓶中,摇床培养36 h。如图3所示,当装液量小于等于75 mL时,二嗪磷残留量随装液量的增加而明显增加。可见,YM-3为好氧菌,减小装液量,即增大通气量有利于提高二嗪磷的降解速率。
2.3.3 底物浓度对菌株YM-3二嗪磷降解率的影响
在无碳无氮培养基中设置3个二嗪磷质量浓度梯度:70、90、110 mg/L,以期研究底物浓度对二嗪磷降解率的影响。如图4所示,当底物质量浓度为70 mg/L时二嗪磷被降解的最彻底,72 h时降解率达到91%;随底物浓度的增加降解率明显下降,并且二嗪磷的降解主要集中在前24 h;当底物质量浓度为110 mg/L、降解72 h时二嗪磷只被降解了59%。可见,在无碳无氮培养基中,菌株能以二嗪磷为唯一碳氮源,因为二嗪磷本身具有毒性,所以二嗪磷超过一定浓度时对菌体的生长起到了抑制的作用。

图3 装液量对菌株YM-3二嗪磷降解的影响Fig.3 Effect of aeration on diazinon degradation by strain YM-3

图4 二嗪磷质量浓度对菌株YM-3二嗪磷降解的影响Fig.4 Effect of diazinon concentration on diazinon degradation by strain YM-3
2.3.4 盐浓度对菌株YM-3二嗪磷降解率的影响
将菌株YM-3分别接种到NaCl质量浓度为5~100 g/L的MM-2培养基中。如图5所示,在5~20 g/L的NaCl质量浓度范围内二嗪磷的残留量逐渐上升;随NaCl浓度继续增大,二嗪磷的残留量在61~71 g/L波动;说明菌株YM-3对NaCl的耐受性有限。
2.3.5 金属离子对菌株YM-3二嗪磷降解率的影响
菌株YM-3接种于MM-2培养基中,分别添加0.1、1.0、2.0 mmol/L 3个摩尔浓度梯度的Cu2+、Ca2+、Ba2+、Li+、Zn2+,摇床培养36 h。如图6所示,5种不同的金属离子均抑制了二嗪磷的降解,且Ba2+对二嗪磷的降解影响与自身浓度的关系不大。
2.3.6 不同营养物对菌株YM-3二嗪磷降解率的影响
对于以共代谢途径降解农药或其他化合物的细菌,需要外界提供其他能源和碳源物质才能降解目标物[23]。将菌株YM-3分别接种到10、100、1 000、10 000 mg/L葡萄糖、酵母粉和蛋白胨的MM-2培养基中。如图7所示,这3种营养物的加入均不同程度地抑制了二嗪磷的降解,说明菌株YM-3不是通过共代谢的途径降解二嗪磷的。
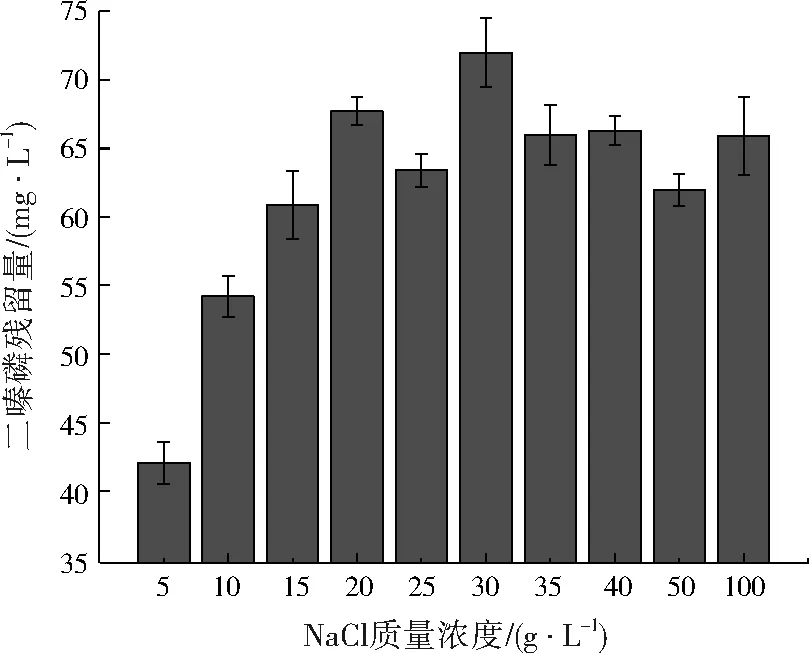
图5 NaCl质量浓度对菌株YM-3二嗪磷降解的影响Fig.5 Effect of NaCl concentration on diazinon degradation by strain YM-3

图6 不同金属离子对菌株YM-3二嗪磷降解的影响Fig.6 Effect of various heavy metal ions on diazinon degradation by strain YM-3

图7 不同营养物对菌株YM-3二嗪磷降解的影响Fig.7 Effect of various nutrients on diazinon degradation by strain YM-3
3 讨 论
有机磷农药在农业上的使用已有40多年,且大部分有机磷农药结构相似,均通过抑制乙酰胆碱酯酶达到杀虫、杀菌的目的[24]。二嗪磷是一种高效有机磷杀虫剂,具有触杀、胃毒和一定的内吸作用[25]。随着二嗪磷产品的广泛使用,其在环境中的残留问题正逐渐暴露,与化学和物理法相比,生物降解具有经济、安全、高效等显著优点,因此,使用微生物技术处理二嗪磷成为污染治理的研究热点[26-27]。索氏菌广泛存在于环境中,是一种多功能降解菌,能降解多种难降解的有机物,如间羟苯甲酸盐、原儿茶酸、甲氧基芳香族化合物。本课题组从长期受二嗪磷污染的污泥中分离出一株新的能高效降解二嗪磷的索氏菌YM-3,并从底物浓度、装液量、接种量、金属离子、营养物和盐浓度等方面对其降解特性做进一步的研究。
降解特性实验选择70 mg/L的二嗪磷作为实验合适的降解浓度,因为当二嗪磷质量浓度高于70 mg/L时,细菌受环境影响,酶活性受到抑制,生长速度减慢导致降解效率低[28]。菌株YM-3对二嗪磷的降解存在快速降解期和缓慢降解期,在前12 h降解速度很快,之后降解缓慢。首先,可能是细菌生长进入衰亡期或二嗪磷浓度迅速降低导致降解缓慢;其次可能是因为在二嗪磷降解过程中,中间产物的积累与二嗪磷形成竞争代谢[29-30]。二嗪磷的微生物降解不仅考虑时间因素,还要考虑菌种特性,在实际应用中,根据长期或短期不同的实际要求选择菌种[31]。例如,对二嗪磷的降解,若在较短期取得较好的降解效果可以选择菌株YM-3,而长期而言,应选择菌株CTN-4[32]。本研究筛选的以二嗪磷为唯一碳氮源的高效降解菌株,不仅丰富了二嗪磷降解菌的种类,并且在修复二嗪磷污染方面有较好的前景。
4 结 论
从长年生产二嗪磷的农药厂的排污口处污泥中分离筛选得到一株二嗪磷的高效降解菌株,初步鉴定为索氏菌属。菌株YM-3是以非共代谢形式降解二嗪磷的细菌,可以将二嗪磷作为唯一碳氮源,对70 mg/L的二嗪磷降解72 h降解率高达91%。从降解特性研究结果得出,菌株YM-3是好氧菌,对NaCl的耐受性有限;降解能力受Cu2+、Ca2+、Ba2+、Li+、Zn2+5种金属离子的影响。
[1] 崔旭.二嗪磷在白术及土壤中的残留行为研究[D].杭州:浙江大学,2014.
[2] 刘卫东,张海滨.二嗪磷生产连续化工艺研究[J].安徽化工,2006,32(5):30-31.
[3] 张为农.二嗪磷在国内能否走出大品种小市场的怪圈[J].农药,2009,48(6):467-467.
[4] 周小琴,季海东,王娟.气相色谱法测定二嗪磷原药[J].江西植保,2010(4):172-175.
[5] 李旭坤,刘军,张晓东,等.二嗪磷合成水法新工艺[J].中国农药,2005(4):35-36.
[6] 李亚.亚太地区面临杀虫剂威胁[J].农药市场信息,2001(14):40.
[7] 韩志华,周军英,程燕,等.不同剂型二嗪磷制剂及原药对鸟类的毒性评价[J].农业环境科学学报,2008,27(5):2033-2038.
[8] 林锦权.二嗪磷的环境效应及修复研究进展[J].广东化工,2012,39(6):165-166.
[9] 李超.噻嗪酮降解菌株 YL-1 的分离鉴定、代谢途径及应用研究[D].南京:南京农业大学,2012.
[10] SETHUNATHAN N,YOSHIDA T.AFlavobacteriumsp.that degrades diazinon and parathion[J].Canadian Journal of Microbiology,1973,19(7):873-875.
[11] ABO AMER A E.Biodegradation of diazinon bySerratiamarcescensDI101 and its use in bioremediation of contaminated environment[J].J. Microbiol. Biotechnol.,2011,21(1):71-80.
[12] MAHIUDDIN M.Degradation of the organophosphorus insecticide diazinon by soil bacterial isolate[J].The Intern. Journal of Biotechn.,2014,3(1):12-23.
[13] GALLUS C.Anaerobic degradation of α-resorcylate by a nitrate-reducing bacterium,Thaueraaromaticastrain AR-1[J].Systematic and Applied Microbiology,1997,20(4):540-544.
[14] PHILIPP B.Anaerobic degradation of protocatechuate (3,4-dihydroxybenzoate) byThaueraaromaticastrain AR-1[J].Fems Microbiology Letters,2002,212(1):139-143.
[15] MECHICHI T,PATEL B K,SAYADI S.Anaerobic degradation of methoxylated aromatic compounds byClostridiummethoxybenzovoransand a nitrate-reducing bacteriumThauerasp.strain Cin3,4[J].International Biodeterioration & Biodegradation,2005,56(4):224-230.
[16] 史秀珍.百菌清降解菌的筛选及其降解特性研究[D].北京:中国农业科学院,2007.
[17] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[18] 王光利.百菌清降解菌株的分离、鉴定,水解脱氯酶的基因克隆、表达及酶的催化机制研究[D].南京:南京农业大学,2010.
[19] MILLER S A,DYKES D D,POLESKY H F.A simple salting out procedure for extracting DNA from human nucleated cells[J].Nucleic Acids Research,1988,16(3):1215.
[20] MARCHES J R.Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16S rRNA[J].Applied and Environmental Microbiology,1998,64(2):795-799.
[21] KIM O S,CHO Y J,LEE K,et al.Introducing EzTaxon-e:a prokaryotic 16S rRNA gene sequence database with phylotypes that represent uncultured species[J].International Journal of Systematic and Evolutionary Microbiology,2012,62:716-721.
[22] CHEN K,LIU X M,LI R,et al.Isolation of a buprofezin co-metabolizing strain ofPseudomonassp. DFS35-4 and identification of the buprofezin transformation pathway[J].Biodegradation,2011,22(6):1135-1142.
[23] 许育新,李晓慧,张明星,等.红球菌 CDT3 降解氯氰菊酯的特性及途径[J].中国环境科学,2005,25(4):399-402.
[25] 李毅.二嗪磷高效液相色谱分析[J].现代农药,2002(5):18-19.
[26] 田家良,余向阳,沈燕,等.生物质炭施用对韭菜和小青菜吸收富集二嗪磷的影响[J].江苏农业学报,2013,29(5):1166-1171.
[27] 张玉秀,蒙小俊,柴团耀.苯酚降解菌红球菌 (Rhodococcussp.) P1 的鉴定及其在焦化废水中的应用[J].微生物学报,2013,53(10):747-754.
[28] 王新.克百威和毒死蜱农药降解菌的筛选与鉴定[J].生态学杂志,2014,33(3):786-790.
[29] 宋玉芳,宋雪英,张薇,等.污染土壤生物修复中存在问题的探讨[J].环境科学,2004,25(2):129-133.
[30] 苏丹,李培军,王鑫,等.3株细菌对土壤中芘和苯并芘的降解及其动力学[J].环境科学,2007,28(4):913-917.
[31] 袁爽,梁成华,李凤梅,等.多环芳烃降解菌的筛选与降解能力测定[J].生态学杂志,2011,30(2):315-319.
[32] 王光利,李新风,张辉,等.CTN-4降解百菌清的条件优化及动力学模型的研究[J].中国环境科学,2013,33(11):1999-2005.
