一株深海反硝化菌的分离鉴定及反硝化特性研究*
2016-03-13冯雅丽李洪珊李浩然
冯雅丽 李洪珊 李浩然
(1.北京科技大学土木与环境工程学院,北京 100083;2.中国科学院过程工程研究所生化国家重点实验室,北京 100080)
一株深海反硝化菌的分离鉴定及反硝化特性研究*
冯雅丽1李洪珊1李浩然2#
(1.北京科技大学土木与环境工程学院,北京 100083;2.中国科学院过程工程研究所生化国家重点实验室,北京 100080)
从深海沉积物中分离获得一株具有较高脱氮效率的反硝化菌YL-1,通过形态观察、生理生化特性及16S rDNA同源性分析,确定该菌株为蒙氏假单胞菌(Pseudomonasmonteilii)。考察了C、N质量比(C/N)、碳源、初始pH、温度及盐度对其反硝化作用的影响。结果表明:菌株YL-1反硝化最佳条件为最适碳源为乙酸钠、C/N不低于6∶1、初始pH为7.0~9.0、温度为25~35 ℃;该菌株具有较强的反硝化性能,盐度在100 g/L以内时对其反硝化特性影响不大。
反硝化菌 蒙氏假单胞菌(Pseudomonasmonteilii) 16S rDNA 硝酸盐氮
随着工农业生产的高速发展和人们生活水平的不断提高,生活污水和企业工业废水直接排入水体,水体质量急剧恶化[1]。对于氮素污染的治理,国内外常见的工程技术有选择性离子交换法、空气吹脱法、折点加氯法、磷酸氨镁沉淀法及生物脱氮法等[2]。其中,生物脱氮以其无污染、脱氮彻底和安全等优点被认为是目前较经济、有效、可行性高的治理技术[3]。生物反硝化即利用反硝化菌的作用,将硝酸盐氮(亚硝酸盐氮)转化为气态产物脱除,被认为是较经济有效的脱氮方式[4-5]。
本研究选用具有特殊生态环境的太平洋海底表面沉积物为菌种分离来源,通过富集、分离等步骤,得到一株具有较强反硝化能力的菌株,对其进行鉴定,并在实验室条件下研究了该菌株的反硝化特性,旨在为生物脱氮技术的实际应用提供有效菌源和技术方法。
1 材料与方法
1.1 菌株来源
实验样品来自中国大洋生物样品馆保藏的太平洋海底表面沉积物。
1.2 培养基
富集培养基[6]:胰化蛋白胨10 g/L、酵母提取物5 g/L、NaCl 10.0 g/L,pH=7.0,121 ℃灭菌20 min。
分离培养基:在富集培养基中加入15~20 g/L琼脂。
硝酸盐培养基:KCl 0.13 g/L、NaH2PO43.31 g/L、Na2HPO410.31 g/L、NaCl 2.9 g/L、KNO30.721 8 g/L。该培养基中硝酸盐氮为100 mg/L,碳源种类及浓度根据实验要求进行调整。
1.3 菌株分离及纯化
在富集培养基中接种海底表面沉积物,放置30 ℃恒温箱中培养3~5 d后,用接种环蘸取菌悬液至分离培养基上划线,30 ℃培养,至平板长出明显菌落。挑取分离平板上菌株单菌落,获得分离菌株,多次在分离培养基上划线,30 ℃培养,至显微镜下观察无其他杂菌即得到纯化菌株。将单菌落接种于硝酸盐培养基,测定其反硝化能力,并选择反硝化能力强的菌株进行进一步研究。
1.4 菌株鉴定
对菌株进行形态观察、生理生化特性鉴定以及16S rDNA序列测定。16S rDNA扩增引物分别为:上游引物为27F(5’-AGAGTTTGATCCTGGCTCAG-3’);下游引物为1492R(5’-GGTTACCTTGTTACGACTT-3’)。
1.5 反硝化条件的优化
将5%(体积分数)的接种量接种于装有高温灭菌的硝酸盐培养基的锥形瓶中,锥形瓶用橡胶塞封口后30 ℃、120 r/min振荡培养,每隔8 h取样测定硝酸盐氮和亚硝酸盐氮含量。为优化菌株的反硝化条件,共设5组实验,每组实验均设3个重复。(1)碳源选择实验:分别以乙酸钠、葡萄糖、酒石酸钾钠、淀粉和蛋白胨作为唯一碳源,C、N质量比(C/N)为8∶1,初始pH为7.0,温度为30 ℃,盐度(以NaCl调节,下同)为50 g/L;(2)C/N影响实验:控制C/N分别为2∶1~10∶1,乙酸钠为碳源,初始pH为7.0,温度为30 ℃,盐度为50 g/L;(3)初始pH影响实验:分别设置初始pH为5.0~9.0,乙酸钠为碳源,C/N为6∶1,温度为30 ℃,盐度为50 g/L;(4)温度影响实验:分别设置摇床温度为20~40 ℃,乙酸钠为碳源,初始pH为7.0,C/N为6∶1,盐度为50 g/L;(5)盐度影响实验:盐度分别为50~200 g/L,乙酸钠为碳源,初始pH为7.0,C/N为6∶1,温度为30 ℃。
1.6 主要分析方法
硝酸盐氮、亚硝酸盐氮浓度测定分别采用紫外分光光度法、N-(1-萘基)-乙二胺光度法[7]。
2 结果和分析
2.1 菌株分离与鉴定
通过初步测定各菌株对硝酸盐氮的降解情况,筛选出硝酸盐氮去除率最高的一株作为实验对象,编号为YL-1。如图1所示,菌株YL-1在分离培养基上培养48 h后,菌落呈圆形,表面光滑,湿润黏稠,菌落呈白色。经测定,菌株YL-1为革兰氏阴性,葡萄糖反应为阳性,能运动,16S rDNA序列结果表明该菌株与蒙氏假单胞菌(Pseudomonasmonteilii)相似性为99%,两者在种水平上具有同源性。结合菌株形态及生理生化特性[8],可基本确定菌株YL-1为蒙氏假单胞菌。
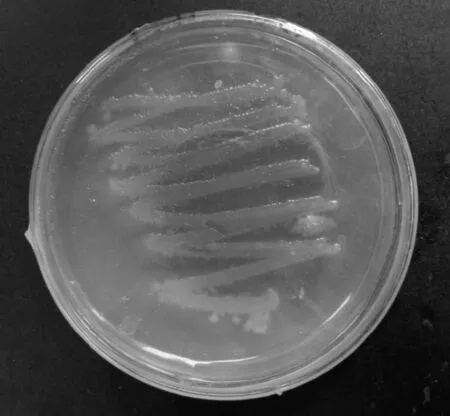
图1 菌株YL-1菌落形态Fig.1 The colony morphology of strain YL-1
2.2 反硝化特性研究
实验中,亚硝酸盐氮测试结果均在0.002 5 mg/L以下,可忽略不计,因此不再讨论分析。
2.2.1 碳源对菌株YL-1反硝化反应的影响
反硝化过程中硝酸盐还原的电子供体及细胞生长都需要有机碳源来提供[9]。由图2可见,40 h时,乙酸钠为碳源时硝酸盐氮浓度最低,葡萄糖次之,酒石酸钾钠和蛋白胨基本不能被菌株利用参与反硝化反应。有研究表明,乙酸钠属于低分子简单化合物,易被微生物利用,降解过程相对简单[10]。因此,宜采用乙酸钠作为菌株YL-1反硝化反应的碳源。
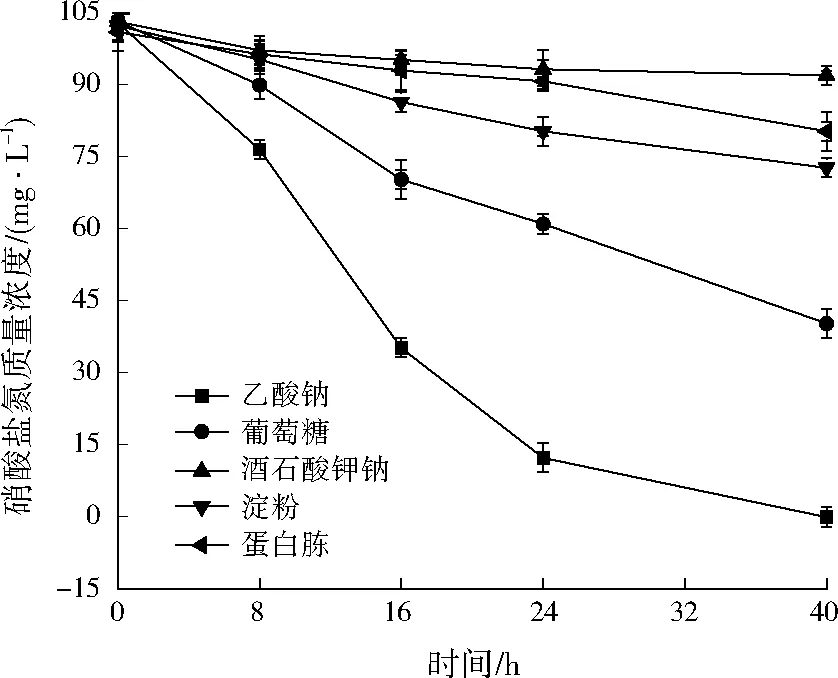
图2 不同碳源条件对菌株YL-1反硝化特性的影响Fig.2 Effects of carbon sources on strain YL-1 denitrification characteristics
2.2.2 C/N对菌株YL-1反硝化反应的影响
由图3可以看出,当C/N为2∶1和4∶1时,菌株YL-1对硝酸盐氮的脱除不理想;当C/N为6∶1及以上时,菌株YL-1对硝酸盐氮的降解基本保持不变,这是由于随着C/N升高,充足的碳源可满足菌体生长和反硝化的能量需求,反硝化活性也处于稳定阶段[11]。因此,从节约成本的角度考虑,C/N宜为6∶1。
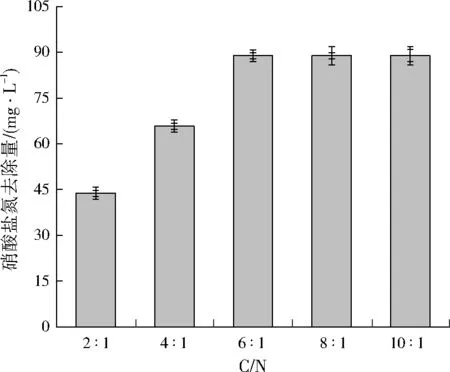
图3 不同C/N对菌株YL-1反硝化特性的影响Fig.3 Effects of C/N on strain YL-1 denitrification characteristics
2.2.3 初始pH对菌株YL-1反硝化反应的影响
如图4所示,初始pH在7.0以上时硝酸盐氮浓度降解相近,初始pH为6.0时反硝化反应情况不佳,初始pH为5.0时短时间内基本不发生反硝化反应;实验后阶段菌株YL-1对硝酸盐氮的去除量减少主要是由于碳源不足引起。张苗等[12]对螯台球菌属(Chelatococcussp.)的研究表明,pH为7.0~9.0时适于细菌生长,反硝化活性稳定。ZHANG等[13]和HIATT等[14]的研究表明,pH为中性或弱碱性时,细菌生长和反硝化酶活性达到最佳,pH过酸或过碱都会影响细菌生长及反硝化活性。以上结论与本研究结果一致。由此可知,初始pH为7.0~9.0时该菌能发挥最佳的反硝化能力。
2.2.4 温度对菌株YL-1反硝化反应的影响
由图5可以看出,当温度为25~35 ℃时,反硝化反应对硝酸盐氮的去除量较高;低于25 ℃或高于35 ℃时均会不同程度地抑制菌株YL-1对硝酸盐氮的降解。这是由于,温度是影响细菌生长及反硝化酶活性的一个重要因素[15-16]。可见,25~35 ℃为菌株YL-1反硝化反应的最佳温度范围。
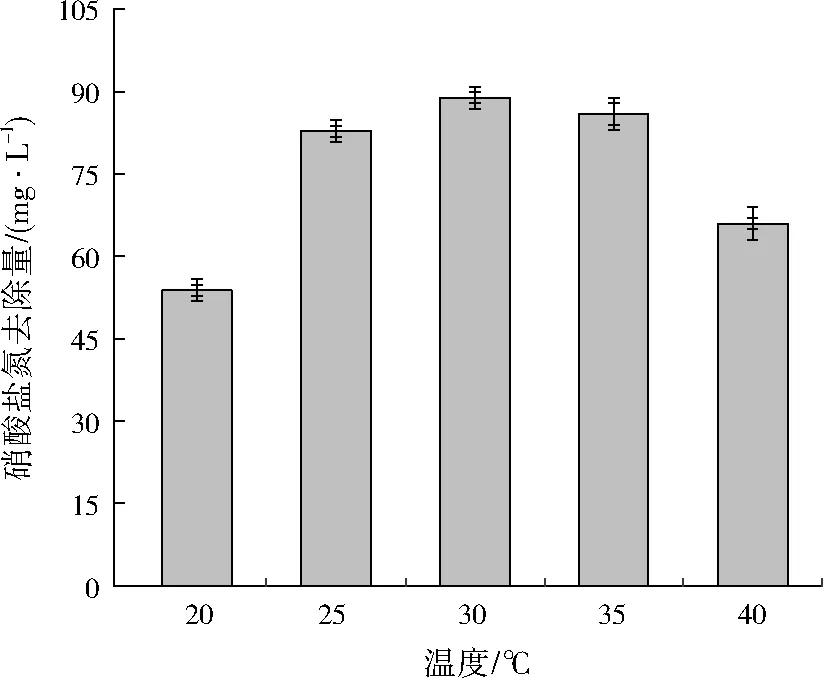
图5 温度对菌株YL-1反硝化特性的影响Fig.5 Effects of temperature on strain YL-1 denitrification characteristics
2.2.5 盐度对菌株YL-1反硝化反应的影响
由图6可以看出,菌株YL-1有一定的耐盐性,当盐度控制在100 g/L以下时,硝酸盐氮浓度降解相近;高于100 g/L时随着盐度的增大,菌株YL-1对硝酸盐氮降解的抑制程度增大。由此可见,菌株YL-1分离自深海沉积物,盐度在100 g/L内时对其反硝化特性影响不大,该菌株可利用的盐度范围较广,适用于不同盐度水平的自然水体的氮素去除,应用前景广阔。
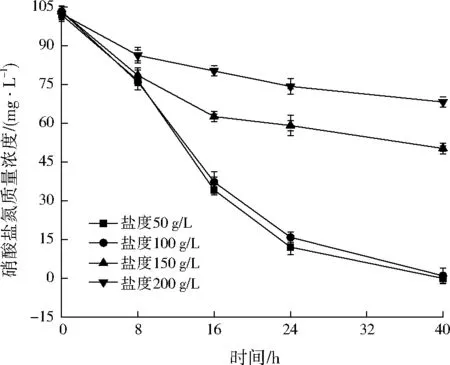
图6 盐度对菌株YL-1反硝化特性的影响Fig.6 Effects of salinity on strain YL-1 denitrification characteristics
3 结 论
(1) 通过富集、分离及硝酸盐培养基分离筛选,从深海沉积物中筛得一株脱氮性能较好的菌株YL-1。对菌株进行形态观察、生理生化特性鉴定及16S rDNA序列测定,可确定菌株YL-1为蒙氏假单胞菌。
(2) 菌株YL-1反硝化最佳条件:最适碳源为乙酸钠,C/N不低于6∶1,初始pH为7.0~9.0,温度为25~35 ℃。该菌株具有较强的反硝化性能,盐度在100 g/L以内时对其反硝化特性影响不大,反硝化的适宜条件范围较广。因此,该菌株具有进一步研究及应用的价值。
[1] 邓时海,李德生,卢阳阳,等.集成模块系统同步硝化反硝化处理低碳氮比污水的试验[J].中国环境科学,2014,34(9):2259-2265.
[2] HAO Bingbing,ZHAN Peirong,WEI Yingying,et al.Identification and characterization of an aerobic denitrifier from MBR on treatment of aquaculture waste water[J].Advanced Materials Research,2013,864/865/866/867:1816-1821.
[3] 汪传新,龚灵潇,彭永臻.低温下MBBR处理低碳氮质量比生活污水的同步硝化反硝化特性[J].中南大学学报(自然科学版),2014,45(8):2920-2927.
[4] 刘欢,骆灵喜,李旭宁,等.膜生物反应器好氧反硝化菌的筛选及鉴定[J].环境污染与防治,2015,37(4):26-29.
[5] TONG Shuang,ZHANG Baogang,FENG Chuanping,et al.Characteristics of heterotrophic/biofilm-electrode autotrophic denitrification for nitrate removal from groundwater[J].Bioresource Technology,2013,148(8):121-127.
[6] 钱存柔,黄仪.微生物学实验教程[M].北京:北京大学出版社,2010.
[7] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[8] 布坎南R E,吉本斯N E.伯杰氏细菌鉴定手册[M].8版.北京:科学出版社,1984.
[9] 罗冠,许德超,李小明,等.碳源对静置/好氧/缺氧SBR脱氮除磷性能的影响[J].环境工程学报,2015,9(4):1727-1734.
[10] 阿拉木斯,蔡碧婧,王峰,等.碳源对污水处理反硝化过程及细菌种群的影响[J].四川环境,2015,34(1):13-18.
[11] 王希睿,余萍,鲁安怀.不同碳源下粪产碱杆菌的生长代谢及碳氮比对其反硝化能力的影响[J].化学通报,2014,77(4):370-374.
[12] 张苗,黄少斌.高温好氧反硝化菌的分离鉴定及其反硝化性能研究[J].环境科学,2011,32(1):259-265.
[13] ZHANG Qingling,LIU Ying,AI Guomin,et al.The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium,bacillus methylotrophicus strain L7[J].Bioresource Technology,2012,108(3):35-44.
[14] HIATT W C,GRADY C P L.Application of the activated-sludge model for nitrogen to elevated nitrogen conditions[J].Water Environment Research,2008,80(11):2134-2144.
[15] 韩永和,章文贤,庄志刚,等.耐盐好氧反硝化菌A-13菌株的分离鉴定及其反硝化特性[J].微生物学报,2013,53(1):47-58.
[16] 王荣昌,司书鹏,杨殿海,等.温度对生物强化除磷工艺反硝化除磷效果的影响[J].环境科学学报,2013,33(6):1535-1544.
Identificationanddenitrificationcharacteristicsofadeepseadenitrifier
FENGYali1,LIHongshan1,LIHaoran2.
(1.CivilandEnvironmentalEngineeringSchool,UniversityofScienceandTechnologyBeijing,Beijing100083;2.StateKeyLaboratoryofBiochemicalEngineering,InstituteofProcessEngineering,ChineseAcademyofScience,Beijing100080)
A denitrifying bacteria YL-1 was isolated from the deep-sea sediments which showed a high nitrogen removal efficiency. YL-1 was finally determined asPseudomonasmonteiliithrough morphological,physiological and biochemical characteristics,and 16S rDNA homology analysis. The effects of carbon source,C/N mass ratio,initial pH value,temperature and salinity on its denitrification characteristics was carried out. The optimum conditions of denitrification for strain YL-1 were as follow: the optimal carbon source was sodium acetate,the ratio of C/N was not less than 6∶1,the initial pH was 7.0-9.0 and the temperature was 25-35 ℃. YL-1 had perfect denitrification performance,the salinity of 100 g/L or less had little effect on its denitrification characteristics.
denitrifiers;Pseudomonasmonteilii; 16S rDNA; nitrate nitrogen
冯雅丽,女,1967年生,博士,教授,主要从事矿物微生物技术方面的研究工作。#
。
*国家水体污染控制与治理科技重大专项(No.2015ZX07205-003);国家自然科学基金资助项目(No.21176026、No.21176242);中国大洋矿产资源研究计划(No.DY125-15-T-08)。
10.15985/j.cnki.1001-3865.2016.12.006
编辑:黄 苇 (
2015-07-02)
