人MUC5AC启动子荧光报告基因的构建与分析
2016-03-13王孝芸蓝楠张沄王星李国平
王孝芸,蓝楠,张沄,王星,李国平
(西南医科大学附属医院炎症与变态反应实验室,四川 泸州 646000)
人MUC5AC启动子荧光报告基因的构建与分析
王孝芸,蓝楠,张沄,王星,李国平
(西南医科大学附属医院炎症与变态反应实验室,四川 泸州 646000)
目的 构建人MUC5AC启动子荧光报告基因并进行分析。方法 PCR技术克隆人MUC5AC启动子[(-1 300)~(+48)bp]长度片段的基因,将纯化的PCR产物与T载体连接,然后将连接产物转化大肠杆菌DH5α感受态细胞,并利用酶切和测序进行重组质粒鉴定;将该重组质粒克隆至pGL3-ehancer荧光报告基因载体上,用脂质体转染法将荧光报告基因转染至人支气管上皮细胞(16HBE细胞),分别用1 ng/mL的重组细胞因子IL-4和IL-13刺激细胞24 h,并设不做任何处理的对照组;用Promega双荧光素酶报告基因检测试剂盒检测相对荧光素酶活性(Rlus1/Rlus2)。结果 人MUC5AC启动子荧光报告基因构建成功,IL-4和IL-13刺激组的相对荧光素酶活性均高于对照组[IL-4(21.666 7±2.081 67),IL-13(26.567 8±1.527 53),对照组(8.33±1.527 53);F=89.815,P= 0.000]。结论 MUC5AC启动子核心区域为(-1 300)~(+48)bp范围,IL-4和IL-13可作用于该区域并促进MUC5AC高表达。
MUC5AC;启动子;荧光报告基因;IL-4;IL-13
气道黏液高分泌是哮喘的一大特征。黏蛋白是黏液中的主要成分,是一种糖基化蛋白,其编码基因为MUC。MUC5AC是气道表达最多的一种蛋白,在气道杯状细胞中高表达,是黏液增生和化生的标志[1-2]。IL-4和IL-13均属于TH2型细胞因子,促进哮喘的发生和发展,对气道黏液高分泌有重要调节作用。气道黏液高分泌存在多种作用机理,如IL-13/IL-4R信号途径和表皮因子受体(EGFR)途径等[3-4],而具体调控机制还有待深入研究。
本研究旨在通过序列分析,构建人MUC5AC启动子[(-1 300)~(+48)bp]长度片段的荧光报告基因,将该基因转染至16HBE细胞,并分别用IL-4和IL-13刺激,然后采用Promega双荧光报告基因检测试剂盒检测相对荧光素酶活性,从而确定MUC5AC启动子核心区域,为今后进一步研究其功能和相关转录因子的结合位点及调控打下基础。
1 材料与方法
1.1 实验材料 限制性内切酶(美国MBI公司);T4DNA连接酶,dNTP,Taq酶及buffer(中国Takra公司);质粒小量提取试剂盒,DNA凝胶回收试剂盒(美国Omega公司);质粒大量提取试剂盒(中国Beyotime公司);动物细胞基因组DNA提取试剂盒,DNA Marker(中国YRBIO公司);人重组细胞因子IL-4、IL-13 (美国Peprotech公司);脂质体2000(美国Invitrogen公司);pMD19-TS载体,pRl-TK质粒,pGL3-enhancer (中国百替公司);双荧光素酶报告基因检测试剂盒(美国Promega公司);16HBE细胞,大肠杆菌DH5α感受态细胞(本实验室保存)。
1.2 方法
1.2.1 hMUC5AC/-1 300/+48启动子序列调取
1.2.1.1 A549细胞基因组DNA提取 收集(1× 106)~(1×107)个A549细胞,使用YRBIO动物细胞基因组DNA提取试剂盒,按照说明书提取基因组DNA。电泳检测提取的基因组DNA质量。
1.2.1.2 PCR扩增MUC5AC基因-1300/+48位启动序列 通过NCBI基因数据库找到MUC5AC基因序列,根据资料确定启动子区域(-1300/+48)[5],并通过UCSC软件找到该启动子区域。用Primer Premier 5.0设计扩增-1 300/+48启动子的引物,并分别在上下游引入Knp和XhoⅠ酶切位点。引物序列如下:hMUC5AC(-1 300/+48)上游:CGGGTACCAGAGCTTGGGACGGGTCC;hMUC5AC(-1300/+48)下游:CCGCTCGAGTGTGTGGACGGCGGGGAAGA。用高保真Taq酶进行PCR扩增。反应体系:10×PCR buffer:5 μL;10 μmol/L dNTP:2 μL;10 μmol/L上游引物:0.5 μL;10 μmol/L下游引物:0.5 μL;基因组DNA:0.5 μL;Taq酶:0.5 μL;ddH2O:41 μL;共计:50 μL。PCR反应程序:94℃预变性:5 min;94℃变性:30 s;58℃退火:30 s;72℃延伸:80 s;变性-退火-延伸三步骤重复循环35次,最后72℃延伸。
1.2.1.3 PCR产物的纯化 将PCR扩增产物进行核酸水平电泳,凝胶浓度为1%。电泳30 min后将胶切下用以回收目的基因条带。
1.2.1.4 PCR产物连接T载体 反应体系:MUC5AC/-1300/+48 PCR产物:7 μL;pMD19-TS载体:1 μL;10×缓冲液:1.5 μL;T4DNA连接酶:1 μL;ddH2O:4.5 μL;共计:15 μL。反应条件:将反应体系于1.5 mL EP管中轻微混匀,再将该EP管置于低温恒温水浴箱,于16℃下进行连接反应,反应时间过夜,次日混合液直接用于转化。连接产物转化大肠杆菌DH5α感受态细胞。
1.2.1.5 重组质粒的鉴定 用KpnⅠ和XhoⅠ做双酶切鉴定,酶切产物凝胶水平电泳,用凝胶成像仪检测DNA片段大小,同时将鉴定的阳性菌种送公司测序。
1.2.2 pGL3-hMUC5AC/-1300/+48克隆
1.2.2.1 双酶切中间载体和克隆载体 酶切反应体系:①pMD19-TS-MUC5AC/-1300/+48:20 μL;10× buffer:4 μL;10×BSA:4 μL;KpnⅠ:1 μL;Xho I:1 μL;ddH2O:10 μL;共计:40 μL。②pGL3-enhancer:20 μL;10×buffer:4 μL;10×BSA:4 μL;KpnⅠ:1 μL;Xho I:1 μL;ddH2O:10 μL;共计:40 μL。酶切产物进行琼脂糖凝胶电泳,检测载体是否切开。酶切反应彻底后,用DNA片段快速纯化/回收试剂盒回收pGL3-enhancer载体及MUC5AC/-1300/+48条带。
1.2.2.2 连接反应 连接反应体系体积15μL:MUC5AC/-1 300/+48酶切产物:7 μL;pGL3-enhancer酶切产物:1 μL;10×buffer:1.5 μL;T4DNA连接酶:1 μL;ddH2O:4.5 μL。反应条件同前述连接反应。连接产物转化大肠杆菌DH5α感受态细胞,操作步骤如前述转化步骤。
1.2.2.3 重组质粒鉴定 重组质粒鉴定的方法同hMUC5AC/-1300/+48启动子序列调取时重组质粒鉴定。
1.2.3 人MUC5AC启动子荧光报告基因检测
1.2.3.1 质粒大提 碧云天质粒大提试剂盒大提pGL3-hMUC5AC/-1300/+48质粒和pRL-TK质粒:用Bio-Tech核酸定量仪测定相应的DNA浓度。
1.2.3.2 pGL3-hMUC5AC/-1300/+48和pRL-TK质粒共转染16HBE细胞 用不含抗生素的高糖DMEM培养基在24孔板内培养16HBE细胞,培养条件为37℃,5%CO2。等细胞融合度为80%~90%时,用Invitrogen脂质体2000试剂盒进行质粒转染,37℃培养。转染4 h后换含血清的新鲜DMEM培养基。
1.2.3.3 IL-4和IL-13刺激16HBE及荧光报告基因检测 将上述转染细胞换不含血清和抗生素的DMEM培养基培养过夜。分别用浓度为1 ng/mL的IL-4和IL-13刺激细胞24 h,每种刺激物各设3个复孔,并设不做任何处理的细胞作为空白对照。24 h后,用Promega双荧光报告基因检测试剂盒检测报告基因的表达,记录相对荧光素酶活性Rlus1/Rlus2。
1.3 统计学方法 应用统计学软件SPSS17.0处理实验数据,计量资料以均数±标准差(±s)表示,采用方差分析法分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 A549细胞基因组DNA提取 电泳检测提取的A549细胞基因组DNA,质量较好,效果如图1。

图1 电泳检测提取的A549细胞基因组DNA注:M,2 kb plusⅡ;1,基因组DNA。
2.2 MUC5AC/-1300/+48启动子扩增 PCR产物经电泳检测,扩增到约1 340 bp的条带,与预期结果相符,见图2。

图2 MUC5AC/-1 300/+48 PCR扩增结果注:M,D2000;1,PCR结果。
2.3 pMD19-TS-MUC5AC/-1 300/+48载体鉴定 将MUC5AC/-1 300/+48片段亚克隆至pMD19-TS载体,阳性克隆经Knp I和Xho I双酶切鉴定,可切出约1 340 bp的MUC5AC/-1 300/+48片段条带和约2.7 kb的载体条带,见图3。

图3 pMD19-TS-MUC5AC/-1300/+48酶切鉴定注:M,2 kb plusⅡ;1,pMD19-TS-MUC5AC/-1 300/+48酶切片段。
2.4 pGL3-MUC5AC/-1 300/+48载体鉴定 将pMD19-TS-MUC5AC/-1300/+48亚克隆pGL3-enhance载体,阳性克隆经KnpⅠ和XhoⅠ双酶切鉴定,可切出约1 340 bp的MUC5AC/-1 300/+48片段条带和约5.0 kb的载体条带,见图4。

图4 pGL3-MUC5AC/-1 300/+48酶切鉴定注:M,2 kb plusⅡ;1,pGL3-MUC5AC/-1 300/+48酶切片段。
2.5 相对荧光素酶活性检测 将构建的重组报告基因转染16HBE细胞,分别用IL-4和IL-13刺激细胞24 h,双荧光素酶报告基因检测结果表明:IL-4和IL-13刺激组的相对荧光素酶活性均高于对照组[IL-4 (21.666 7±2.081 67),IL-13(26.567 8±1.527 53),对照组(8.33±1.527 53);F=89.815,P=0.000<0.05],见图5。
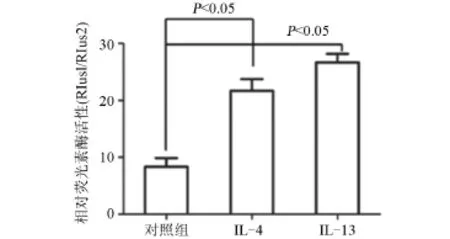
图5 人MUC5AC启动子荧光报告基因检测
3 讨论
哮喘是当前世界面临的重要健康问题。气道黏液高分泌是哮喘的重要特征,在重症哮喘发作时尤其明显。如何抑制气道黏液高分泌成为哮喘防治需解决的关键问题[6]。MUC5AC是一种黏蛋白,编码基因为MUC。已有研究表明,MUC5AC在气道中表达最多,对气道黏液高分泌有重要作用[2],因此对MUC5AC作用机理的研究对于哮喘的防治具有重要意义。
基因表达的调节是研究细胞组织功能的分子基础,尤其是基因转录水平的调控对于基因表达是一种最有效的调节方式[7]。转录水平调控是真核基因表达调控的重要环节。研究表明MUC5AC表达的增加主要依赖于MUC5AC基因的转录实现。MUC5AC的启动子区域有特异性蛋白1(Sp1)和NF-κB等转录因子结合位点[8-9]。这些转录因子蛋白的表达可促进MUC5AC启动子的活化,诱导MUC5AC基因转录,从而促使MUC5AC黏蛋白的高表达。因此在MUC5AC启动子区域做哮喘相关转录因子的进一步探索对于哮喘黏液高分泌的作用机制研究具有重要作用。在本次研究中,笔者首先通过NCBI基因数据库找到MUC5AC基因序列,确定MUC5AC的启动子区域(-1 300/+48),并通过UCSC软件找到该启动子区域。用Premier 5.0设计扩增-1300/+48启动子的引物,通过基因重组及PCR技术,构建了人MUC5AC启动子荧光报告基因,为后续哮喘相关转录因子结合位点的寻找打下基础。
IL-4和IL-13属于Th2细胞因子,对哮喘的发生和发展有促进作用,二者均通过IL-4Rα传递信号。IL-4Rα是一种受体复合物,分为两类:Ⅰ型(IL-4Rα和γc)及Ⅱ型(IL-4Rα和IL-13Rα1)。IL-4和IL-13共享Ⅱ型受体。IL-4R途径与STAT6活化有关。磷酸化的STAT6二聚体向核迁移并与IL-4和IL-13启动子结合,由此影响Th2细胞分化,气道高反应和气道黏液高分泌[10]。Douglas等[11]研究表明,变应原诱导的气道黏液高分泌与Clara细胞中的IL-4Rα信号途径密切相关。当Clara细胞缺失IL-4Rα时,小鼠黏液基因的表达和上皮细胞中黏液的含量都显著减少。关于IL-13,或其相似因子如IL-4等介导的气道黏液高分泌的研究报道很多,但结果都不尽相同。有的研究报道它们对黏液产生没有影响;有的报道这些细胞因子会减少黏液产生和黏蛋白表达[12]。Atherton等[13]研究报道只有在低浓度(1 ng/mL),而不是高浓度(10 ng/mL)时,细胞因子才能增加黏液产生。本研究采用浓度为1 ng/mL的重组人IL-4和IL-13细胞因子,分别刺激转染了人MUC5AC启动子荧光报告基因的16HBE细胞,用双荧光报告基因检测法进行检测,结果显示IL-4和IL-13刺激组的相对荧光素酶活性要高于对照组的相对荧光素酶活性,证明人MUC5AC启动子荧光报告基因构建成功,且表明IL-4和IL-13在MUC5AC启动子区域有作用位点,具体作用机理还有待进一步研究。
本研究通过基因重组技术成功构建了人MUC5AC启动子荧光素酶报告基因,并用细胞因子IL-4和IL-13对其进行活性分析,为以后在MUC5AC启动子区域内研究哮喘相关转录因子奠定基础,对阐明哮喘气道高分泌作用机理具有重要作用。
[1]Thai P,Loukoianov A,Wachi S,et al.Regulation of airway mucin gene expression[J].Annu Rev Physiol,2008,70:405-429.
[2] Reid CJ,Gould S,Harris A.Developmental expression of mucin genes in the human respiratory tract[J].Am J Respir Cell Mol Biol, 1997,17(5):592-598.
[3]Oh CK,Geba GP,Molfino N.Investigational therapeutics targeting the IL-4/IL-13/STAT-6 pathway for the treatment of asthma[J].Eur Respir Rev,2010,19(115):46-54.
[4]Liu Z,Tian F,Feng X,et al.LPS increases MUC5AC by TACE/ TGF-alpha/EGFR pathway in human intrahepatic biliary epithelial cell[J].Biomed Res Int,2013,2013:165715.
[5]Jonckheere N,Van Der Sluis M,Velqhe A,et al.Transcriptional activation of the murine Muc5ac mucin gene in epithelial cancer cells by TGF-beta/Smad4 signalling pathway is potentiated by Sp1[J].Biochem J,2004,377(Pt 3):797-808.
[6]Hewson CA,Haas JJ,Bartlett NW,et al.Rhinovirus induces MUC5AC in a human infection model and in vitro via NF-kappaB and EGFR pathways[J].Eur Respir J,2010,36(6):1425-1435.
[7]Kadam S,Emerson BM.Mechanisms of chromatin assembly and transcription[J].Curr Opin Cell Biol,2002,14(3):262-268.
[8]Hewson CA,Edbrooke MR,Johnston SL.PMA induces the MUC5AC respiratory mucin in human bronchial epithelial cells,via PKC,EGF/ TGF-alpha,Ras/Raf,MEK,ERK and Sp1-dependent mechanisms [J].J Mol Biol,2004,344(3):683-695.
[9]李升锦,周向东.人MUC5AC基因启动子荧光素酶报告基因载体的构建及其转录活性分析[J].中南大学学报:医学版,2010,35(8): 792-799.
[10]Dasgupta P,Chapoval SP,Smith EP,et al.Transfer of in vivo primed transgenic T cells supports allergic lung inflammation and FIZZ1 and Ym1 production in an IL-4Ralpha and STAT6 dependent manner[J]. BMC Immunol,2011,12(2):429-436.
[11]Kuperman DA,Huang X,Nguyenvu L,et al.IL-4 receptor signaling in Clara cells is required for allergen-induced mucus production[J].J Immunol,2005,175(6):3746-3752.
[12]Jayawickreme SP,Gray T,Nettesheim P,et al.Regulation of 15-lipoxygenase expression and mucus secretion by IL-4 in human bronchial epithelial cells[J].Am J Physiol,1999,276(4 Pt 1):596-603.
[13]Atherton HC,Jones G,Danahay H.IL-13-induced changes in the goblet cell density of human bronchial epithelial cell cultures:MAP kinase and phosphatidylinositol 3-kinase regulation[J].Am J Physiol Lung Cell Mol Physiol,2003,285(3):730-739.
Construction and analysis of the luciferase reporter gene of human MUC5AC promoter.
WANG Xiao-yun,LAN Nan,ZHANG Yun,WANG Xing,LI Guo-ping.Inflammation&Allergy laboratory,the Affiliated Hospital of Southwest Medical University,Luzhou 646000,Sichuan,CHINA
Objective To construct and analyze the luciferase reporter gene of human MUC5AC promoter. Methods Fragment of human MUC5AC promoter[(-1 300)~(+48)bp]was cloned by PCR technology.Purified product of PCR was connected with T vector.The connection product was transformed into Escherichia coli DH5α competent cells and identified by enzyme digestion and sequencing.The recombinant plasmid was cloned into luciferase reporter vector of pGL3-ehancer and transfected into 16HBE cells.Then recombinant cytokines of IL-4 and IL-13 were respectively used to stimulate cells at concentration of 1 ng/mL for 24 hours.Meanwhile,cells without any stimulation were used as control.After 24 hours,cells were tested for relative luciferase activity(Rlus1/Rlus2)by dual luciferase reporter gene detection kit of Promega.Results Human MUC5AC promoter was constructed successfully.Relative luciferase activity(Rlus1/Rlus2)of cells with stimulation of IL-4 and IL-13 was higher than that of control cells[IL-4 (21.666 7±2.081 67),IL-13(26.567 8±1.527 53),(8.33±1.527 53);F=89.815,P=0.000].Conclusion The core region of MUC5AC promoter is in(-1 300)~(+48)bp section.IL-4 and IL-13 have function in such region and promote expression of MUC5AC.
MUC5AC;Promoter;Luciferase reporter gene;IL-4;IL-13
R394
A
1003—6350(2016)15—2409—04
2016-03-11)
国家自然科学基金(编号:81170032)
李国平。E-mail:lzlgp@163.com
