乙醇胁迫对植物乳杆菌D5-5代谢活力的影响
2016-03-07李宝坤蒋彩虹卢士玲杨艳彬李开雄樊哲新蒋琰洁
朱 敏, 李宝坤, 蒋彩虹, 卢士玲, 杨艳彬, 李开雄, 樊哲新, 蒋琰洁
(石河子大学 食品学院,新疆 石河子832000)
乙醇胁迫对植物乳杆菌D5-5代谢活力的影响
朱 敏, 李宝坤*, 蒋彩虹, 卢士玲, 杨艳彬, 李开雄, 樊哲新, 蒋琰洁
(石河子大学 食品学院,新疆 石河子832000)
以(Lactobacillus plantarum D5-5)为研究对象,用不同体积分数乙醇胁迫菌体,测定乙醇胁迫后菌体中乳酸脱氢酶(LDH)、ATP酶的活力,胞外β-半乳糖苷酶相对酶活及细胞膜特性的变化,分析乙醇胁迫后造成菌体失活的主要因素,探讨乙醇胁迫对乳酸杆菌的损伤机制。结果表明:在乙醇体积分数为6%~8%胁迫条件下,菌体存活率分别降低了44.07%、61.81%、69.79%,乙醇胁迫对植物乳杆菌D5-5LDH、ATP酶具有显著影响,胞外β-半乳糖苷酶相对酶活升高,细胞膜完整性和表面结构受破坏程度增强。说明LDH、ATP酶是影响乙醇胁迫损伤的关键酶,乙醇胁迫致使菌体关键酶失活,细胞膜完整性破坏,细胞表面结构受损,从而影响植物乳杆菌D5-5的正常生理代谢。
植物乳杆菌D5-5;乙醇胁迫;关键酶;完整性;损伤
乳酸菌是一类革兰氏染色阳性细菌,经葡萄糖或乳糖发酵主要产物为乳酸的微生物群体。目前至少可分为18个属,其中乳杆菌属有50多个不同的种[1]。植物乳杆菌是乳杆菌科中乳杆菌属的一种,菌体通常长杆状,有时几乎是球状,单个或成短链,兼性厌氧,最适宜的生长温度为37℃,pH为6.5左右[2]。植物乳杆菌是目前传统工业发酵食品中最常见的益生菌,它与人类的生活关系密切,能通过胃对肠道发挥益生作用[3]。然而,植物乳杆菌在发酵过程和在胃肠道中,遇到各种环境因素的胁迫,如高温、高渗、氧化、乙醇等,造成菌体活性降低[4]。近年来,乳酸杆菌在不同胁迫下的应激反应已成为国内外研究热点。在传统乳酸菌与酵母菌共同发酵乳制品中,乳酸菌发酵至适应于酵母菌增殖的酸性条件时,酵母菌开始进行酒精发酵[5],并不断地大量累积酒精。乙醇本身的固有毒性对乳酸菌造成不同程度的损伤[6],乙醇成为胁迫乳酸菌生长代谢的重要因子之一。乙醇是有机溶剂,对细菌的毒害主要表现在细胞膜的破坏上[7-8],它可以破坏细胞膜的完整性,使细胞膜变的无序,增加细胞膜的通透性,造成胞内物质流失[9],从而造成菌体生长速率降低。作者以植物乳杆菌(Lactobacillus plantarum D5-5)为研究对象,分别用不同体积分数乙醇胁迫并与未加乙醇的菌体进行对比,通过对细胞内关键酶活性及胞外β-半乳糖苷酶的测定、细胞膜特性的研究及透射电镜(TEM)观察来测定出菌体细胞的变化,通过研究乙醇对菌体代谢活力的影响,进一步阐明乳酸杆菌的耐乙醇胁迫机理的关键点。
1 材料与方法
1.1 原料
植物乳杆菌D5-5:由新疆和布克赛尔县牧民家庭传统工艺制造的酸奶分离所得。
1.2 培养基和缓冲液
1.2.1 培养基 MRS MRS培养基 (g/L):蛋白胨10、牛肉膏10、酵母膏5、葡萄糖20、硫酸镁0.58、柠檬酸氢二铵2、乙酸钠5、硫酸锰0.25;吐温-80 1 mL,pH 6.4,121℃灭菌20 min。
乙醇MRS培养基:在MRS基础上,用无水乙醇调节培养基乙醇体积分数,配制成 4%、5%、6%、7%、8%共5个浓度,以不添加乙醇培养基作为对照。
1.2.2 缓冲液 磷酸盐缓冲液 (PBS,0.2 mol/L,pH 7.2~7.4):NaCl 7.9 g,KCl 0.2 g,KH2PO40.24 g,K2HPO41.8 g,加蒸馏水溶解至1 000 mL,121℃灭菌20 min。
0.85 g/dL生理盐水:8.5 g NaCl加蒸馏水定容至1 000 mL,121℃灭菌20 min。
1.2.3 其他试剂 ONPG:由南京建成生物公司提供 ;LIVE/DEAD BacLight Bacterial Viability Kit L7012:由美国life生物公司提供;无水乙醇及其他试剂:均为分析纯。
1.3 主要仪器设备 Tecnai G2F20型透射电子显微镜:美国FEI公司;IX71倒置荧光显微镜:日本奥林巴斯公司;KBF720恒温恒湿培养箱:德国 Binder公司;5810R型高速冷冻离心机:德国Eppendorf公司;超洁净工作台:苏州安泰空气技术有限公司;涡旋振荡器:金坛市医疗仪器厂;紫外可见光分光光度计:郑州中谱仪器有限公司;电子分析天平:上海第三天平仪器厂;高压灭菌锅:上海申安医疗器械厂。
1.4 试验方法
1.4.1 不同乙醇浓度胁迫对乳酸杆菌存活率的测定 收集对数生长末期的菌体,4℃、10 000 r/min离心5 min,细胞经无菌PBS洗涤两次后重悬于等体积不同体积分数乙醇的MRS培养基中,胁迫2 h。胁迫后的菌悬液经PBS洗涤两次后重悬于等体积0.85%生理盐水中,取1 mL重悬液,稀释不同梯度涂布于平板上测定存活率。37℃下培养18 h,实验重复3次,每次3个平行样品。根据NA/NB×100%计算存活率,NA为不同体积分数乙醇胁迫后的活菌数,NB为未添加乙醇的活菌数[10]。
1.4.2 乳酸脱氢酶(LDH)、ATP酶的测定
1)无细胞提取液的制备:菌体活化后,按体积分数2%分别接种到不同体积分数的乙醇液体培养基中培养,经4℃、4 000 r/min离心10 min,收集生长至对数末期的菌体,用无菌PBS溶液(0.2 mol/L,pH 7.4)或0.85%生理盐水洗涤两次。取4 mL在冰水浴中进行超声破碎(工作时间∶间歇时间=3 s∶9 s),持续5 min,4℃于6 000 r/min离心10 min后,取上清液用于相关酶活性的测定[11]。
2)蛋白质的测定:考马斯亮蓝染色法[12]。
3)相关酶活性的测定:乳酸脱氢酶(LDH)、ATP酶均采用南京建成生物公司相应的试剂盒进行测定。
1.4.3 β-半乳糖苷酶的测定 不同乙醇体积分数胁迫至对数末期,(4℃、10 000 g离心10 min)取上清液。在试管中加入0.05 mol/L ONPG 3.5 mL,30℃预热,再加入0.5 mL上清液,准确计时30 min,加入10 mL、0.5 mol/L NaHCO3终止反应,在OD420处测定吸光度,按照下面公式计算:
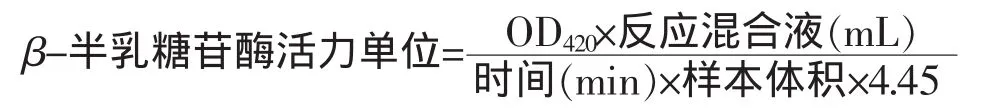
式中,4.45是1 mmol/mL ONP的吸光度。
β-半乳糖苷酶相对酶活=MB/MA
式中,MA为不同乙醇浓度胁迫后菌体胞外β-半乳糖苷酶活;MB为未添加乙醇的菌体胞外β-半乳糖苷酶活。
1.4.4 细胞膜完整性的测定
1)乳酸杆菌菌体的收集:收集对数生长末期的菌体,(4℃、5 000 r/min离心10 min)。细胞经无菌磷酸盐缓冲液洗涤两次后,用不同体积分数乙醇的PBS缓冲液 (5%、8%以不添加乙醇的作为对照)胁迫菌体2 h。胁迫后的菌体经无菌PBS洗涤两次后重悬于等体积PBS,混匀,制成菌悬液,作为待测样。
2)细胞膜完整性的测定:细胞膜完整性利用LIVE/DEAD BacLight Bacterial Viability Kit L7012进行测定。将荧光染料碘化吡啶(PI)和 SYTO9等体积混合均匀。取3 μL混合染料,加入到1 mL菌悬液中,混合均匀,在室温条件下避光孵育15 min。取5 μL染色菌悬液,滴加在洁净的载玻片上,盖上盖玻片,在荧光显微镜下进行观察。
3)电镜样品的观察及图像分析:以无菌注射器取数滴菌悬液于铜网上,吸附30 min,在凹面中加入2%磷钨酸溶液(pH 7.0),将有菌体的铜网置于溶液中染色2 min,用滤纸吸干残液,于灯下烤干,置于透射电镜下进行观察。作者观察透射电子显微镜下各组样品乳杆菌的超微结构,加速电压为100 kV,放大倍数为3 500倍,选取有代表性的视野观察。
1.5 数据统计分析
采用Excel软件作图,利用方差分析数据处理软件对实验数据进行显著性分析,P值小于0.05为显著水平。
2 结果与分析
2.1 不同体积分数乙醇胁迫对植物乳杆菌D5-5存活率的影响
收集对数末期的菌体,通过不同体积分数乙醇胁迫处理后,以未经乙醇胁迫的菌体作为对照,结果见图1。随着乙醇体积分数的增大,植物乳杆菌D5-5的存活率依次下降,pH迅速上升并逐渐趋于平稳。胁迫条件下植物乳杆菌D5-5的存活率相对于未经乙醇胁迫具有显著性差异(P<0.05),而经6%~8%乙醇胁迫处理下降幅度最大,存活率分别降低了 44.07%、61.81%、69.79%,pH值依次为 6.18、6.26、6.28,说明菌体的产酸能力逐渐下降,菌体活力也随着降低。这一结果说明乙醇胁迫处理对植物乳杆菌D5-5的生长产生明显的抑制作用。
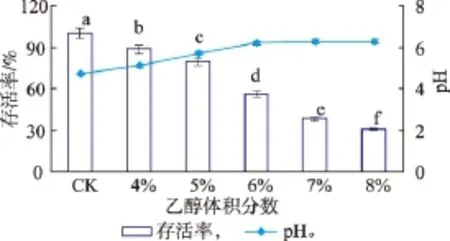
图1 不同体积分数乙醇胁迫对植物乳杆菌D5-5存活率的影响Fig.1 Effect of stress on the survivalrates of Lactobacillus plantarum D5-5during different treatments concentrations of ethanol
2.2 不同体积分数乙醇胁迫处理后对植物乳杆菌D5-5乳酸脱氢酶(LDH)的影响
乳酸脱氢酶广泛存在于各种生物体中,将丙酮酸催化还原为乳酸。乳酸脱氢酶其活力大小,反应了菌株的产酸能力。定义为每毫克组织蛋白于37℃与基质作用15 min,反应体系中产生1 μmol丙酮酸为1单位(U/mg蛋白质)。作者测定不同乙醇胁迫处理后乳酸脱氢酶活力的影响,结果见图2。
由图2可以看出,经不同体积分数乙醇胁迫后,植物乳杆菌D5-5乳酸脱氢酶活明显低于胁迫之前,且随着乙醇体积分数的升高而降低。在胁迫进行时乳酸脱氢酶活呈现出缓慢下降的趋势,在8%乙醇胁迫后,酶活达到最低值(22.01±0.23)U。通过方差分析可知,相对于未经乙醇胁迫的对照来说,不同体积分数乙醇胁迫效果具有显著性差异(P<0.05),这一结果说明乳酸脱氢酶是乙醇胁迫过程中造成植物乳杆菌D5-5损伤的关键酶。
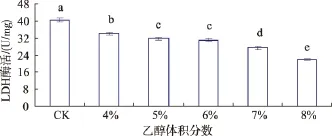
图2 不同体积分数乙醇胁迫处理后对植物乳杆菌D5-5乳酸脱氢酶活力的影响Fig.2 Effect of stress on the LDH of Lactobacillus plantarum D5-5 during differenttreatments ethanol concentration
2.3 不同体积分数乙醇胁迫处理后对植物乳杆菌D5-5ATP酶的影响
ATPase是广泛分布的生物膜酶系统,主要维持细胞的正常生理功能,是提供能量代谢的主要酶。Na+-K+-ATPase和Ca2+-Mg2+-ATPase酶是两种主要的ATPase,Na+-K+-ATPase是嵌于细胞质膜脂质双分子层中的一种蛋白质,具有载体功能和酶的活性,用于催化ATP水解,驱使Na+和K+从细胞膜两侧的对向传递,通过调节细胞Na+和K+浓度,细胞渗透压保持静息电位[13]。Ca2+-Mg2+-ATPase是另一种重要的膜酶,调节细胞内 Ca2+和 Mg2+的浓度[14]。本研究测定不同体积分数乙醇胁迫处理后对乳酸菌ATP酶的影响,规定每小时每微克组织蛋白的组织中ATP酶分解ATP产生1 μmol无机磷的量为一个ATP酶活力单位(U/μg蛋白质),结果见图3。
由图3可以看出,随着乙醇体积分数的升高,植物乳杆菌D5-5Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶活力依次下降。经不同体积分数乙醇胁迫处理后,菌体Na+-K+-ATP酶活均具有显著性差异,但是在乙醇体积分数为4%~5%时,胁迫效果不明显;菌体Ca2+-Mg2+-ATP酶活力呈下降趋势,且效果显著。在乙醇体积分数为6%~8%时,Ca2+-Mg2+-ATP酶下降浮动最大,酶活力分别下降了74.84%、77.29%、78.52%。这一结果表明,ATP酶是乙醇胁迫植物乳杆菌D5-5过程中另一关键酶。

图3 不同体积分数乙醇胁迫处理后对植物乳杆菌D5-5ATP酶的影响Fig.3 Effect of stress on the ATPase of Lactobacillus plantarum D5-5 during differenttreatments ethanol concentration
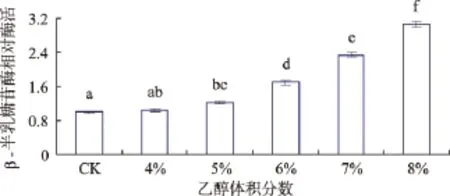
图4 不同体积分数乙醇胁迫处理后对植物乳杆菌D5-5β-半乳糖苷酶的影响Fig.4 Effectofstresson the β-galactosidase of Lactobacillus plantarum D5-5 during different treatments ethanol concentration
由图4可以看出,经过不同体积分数乙醇胁迫处理后,植物乳杆菌D5-5胞外β-半乳糖苷酶相对酶活均高于未经乙醇胁迫的对照,4%~5%乙醇胁迫条件下,效果并不显著;而经6%~8%乙醇胁迫,相对于未加乙醇的乳杆菌来说,β-半乳糖苷酶活性具有显著水平(P<0.05),其中酶活分别增至未经乙醇胁迫前菌体的1.69倍、2.34倍、3.05倍。随着乙醇体积分数的增大,胞外β-半乳糖苷酶相对酶活增大,说明乙醇胁迫处理的菌体细胞膜有损伤,致使内源酶β-半乳糖苷酶释放于体外。胞外β-半乳糖苷酶活性越强,细胞膜损伤越严重。这一结果表明,4%~5%乙醇胁迫对细胞膜损伤不明显,而6%~8%乙醇胁迫对菌体细胞膜有损伤,且效果显著。
2.5 不同体积分数乙醇胁迫处理后对植物乳杆菌D5-5细胞膜完整性的测定
由图5可以看出,通过不同体积分数乙醇对植物乳杆菌D5-5进行胁迫处理,分别经5%、8%乙醇胁迫2 h,对于经乙醇胁迫的菌体来说,未经乙醇胁迫的菌体几乎都是发绿色荧光(图5a),说明菌体的细胞膜完整性几乎未受到破坏,菌体活力未受影响;经5%乙醇胁迫的菌体有少数发红色荧光,多数发绿色荧光(图5b),说明5%乙醇对菌体细胞膜的完整性有破坏,但是效果较弱;8%乙醇胁迫处理后,菌体大多数发红色荧光(图5c);在8%乙醇胁迫条件下,菌体大多数发红色荧光,发绿色荧光的菌体明显减少,说明菌体的细胞膜完整性大部分受到破坏,菌体存活数降至最低。

图5 不同体积分数乙醇胁迫处理后对植物乳杆菌D5-5细胞膜完整性的影响Fig.5 Effect of stress on the cell membrane integrity of Lactobacillus plantarum D5-5 during different treatments ethanol concentration
2.6 不同体积分数乙醇胁迫处理后对植物乳杆菌D5-5微观结构的观察
通过透射电镜(TEM)观察菌体细胞的微观结构,对植物乳杆菌D5-5形态学结构进行了分析。由图6可以明显看到,未经乙醇胁迫的菌体结构基本完好,菌体表面均呈现出完整平滑的状态(图6a);经5%乙醇胁迫后的菌体与未经乙醇胁迫的对照相比,菌体细胞周边几乎为半透明状,变薄并出现毛糙,菌体的形态由长杆状变成短杆状(图6b),说明5%乙醇可以增加细胞通透性,但是细胞内部结构基本完整,没有受到破坏;而8%乙醇胁迫后菌体细胞周围几乎透明,细胞表面变薄、毛糙和破裂而致使胞内物质外溢的情况 (图6c),结构没有完全被破坏,但是已不完整。这一结果与乙醇胁迫存活率结果一致,8%乙醇胁迫明显抑制了菌体的生长。
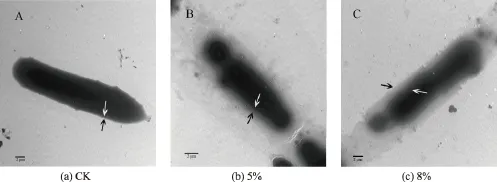
图6 不同体积分数乙醇胁迫处理后对植物乳杆菌D5-5细胞透射电镜图Fig.6 Transmission electron microscopy of Lactobacillus plantarum D5-5 during different treatments ethanol concentration
3 讨论
随着乙醇浓度的增加,植物乳杆菌D5-5存活率依次降低,pH不断上升并逐渐趋于平缓,8%乙醇胁迫处理后菌体pH值为6.28,而MRS培养基pH值为6.4左右,说明此条件下植物乳杆菌D5-5的产酸能力较弱,菌体的活力明显降低。植物乳杆菌D5-5乳酸脱氢酶活随乙醇体积分数增加而呈下降趋势,这可能与菌体活力相关,乳酸菌获取能量主要通过糖酵解途径[15],在EMP途径中乳酸脱氢酶活力大小决定了乳酸菌的产酸能力,乳酸脱氢酶活力逐渐降低,pH逐渐升高,说明乙醇胁迫致使植物乳杆菌D5-5受到损伤。ATP酶是一种常见的生物膜酶,Na+-K+-ATPase分布于细胞膜上的典型巯基酶,当乙醇胁迫使其巯基基团遭到破坏时,将导致细胞内外Na+、K+失衡,细胞膜的渗透性增加[16]。Ca2+-Mg2+-ATP酶是另一种重要的膜酶,主要用于调节细胞内 Ca2+和 Mg2+的浓度,胡纯铿[17-18]发现Mg2+和Ca2+对菌体耐乙醇能力具有显著促进作用,与菌体细胞膜的通透性密切相关。作者研究发现,随着乙醇体积分数的增大,植物乳杆菌D5-5 Na+-K+-ATPase和Ca2+-Mg2+-ATPase活性下降,且胁迫效果具有显著性差异,这一结果与S.Garbay[19]研究一致,细胞膜受损,菌体代谢活力减弱。
随着乙醇胁迫能力的增强,菌体形态由长杆状变成短杆状,乳杆菌的耐乙醇机制可能与菌体的形态改变有关,通过改变菌体自身的长度和宽度,减少与外界环境的接触面积,进而减少乙醇的侵入破坏,可暂时保持正常的生理结构,维持细胞的正常生命活动[20]。在样品处理过程中,离心的速度和时间对细胞超微结构的保存影响很大,作者选取OD600值为0.8,离心时间为 10 min,离心速度为5 000 r/min,效果俱佳。这一方法与王红[21]研究结果一致。尽量减少样品制备过程中其他因素的干扰。乙醇对乳杆菌胁迫处理是一个综合而又复杂的过程,菌体生长环境及代谢活动过程中涉及影响因素颇多,因此乙醇胁迫对乳杆菌代谢活力的影响有待进一步探究。探究乳杆菌生长的过程中乙醇胁迫损失的关键因素,通过必要的保护措施来提高乙醇胁迫环境中植物乳杆菌D5-5细胞的存活率,为提高工业发酵过程中培育优良菌种提供有力的理论基础。
4 结语
1)随着乙醇胁迫处理的加剧,植物乳杆菌D5-5的存活率逐渐下降,同时pH逐渐上升,说明菌体的产酸能力逐渐下降,菌体活力降低。
2)乙醇胁迫处理对植物乳杆菌D5-5 LDH和ATP酶具有显著性差异。这一结果说明,LDH和ATP酶是乙醇胁迫影响菌体损失的关键酶。
3)乙醇胁迫处理胞外β-半乳糖苷酶相对酶活逐渐升高,说明细胞通透性随着乙醇胁迫体积分数的加剧而增加。
4)通过检测细胞完整性及微观结构,发现经过8%乙醇胁迫处理后的发红色荧光菌体增多,细胞周边变薄、毛糙和破裂而致使胞内物质外溢,说明8%乙醇胁迫后细胞膜的完整性遭到破坏。
[1]OSMAN Cataloluk,BULENT Gogebakan.Presence of drug resistance in intestinal Lactobacilli of dairy and human origin in Turkey[J].FEMS Microbiology Letters,2004,236(1):7-12.
[2]王水泉,包艳,董喜梅,等.植物乳杆菌的生理功能及应用[J].中国农业科技导报,2010,12(4):49-55. WANG Shuiquan,BAO Yan,DONG Ximei,et al.Physiological function and application of Lactobacillus plantarum[J].Journal of Agricultural Science and Technology,2010,12(4):49-55.(in Chinese)
[3]VRIES M C de,VAUGHAN E E,KLEEREBEZEM M,et al.Lactobacillus plantarum-survival functional and potential probiotic properties in the human intestinal tract[J].International Dairy Journal,2006,16(9):1018-1028.
[4]STANLEY D,BANDARA A,FRASER S,et al.The ethanol stress response and ethanol tolerance of Saccharomyces cerevisiae[J]. Appl Microbiol,2010,109(1):13-24.
[5]闫彬,贺银凤.酸马奶中乳酸菌与酵母菌的共生发酵特性[J].食品科学,2012,33(7):131-137. YAN Bin,HE Yinfeng.Symbiotic fermentation characteristics of Lacticacid bacteria and yeast isolated from koumiss in Inner Mongolia[J].Food Science,2012,33(7):131-137.(in Chinese)
[6]MA M,HAN P,ZHANG R,et al.Ultrastructural changes of Saccharomyces cerevisiae in response to ethanol stress[J].Canadian Journal Microbiol,2013,59(9):589-597.
[7]LOURENCO A B,ROQUE F C,TEIXEIRA M C,et al.Quantitative1H-NMR-Metabolomics reveals extensive metabolic reprogramming and the effect of the aquaglyceroporin FPS1 in ethanol-stressed Yeast cells[J].PLoS ONE,2013,8(2):e55439
[8]HERMANN J Heipieper,GRIT Neumann,SJEF Comelissen,et al.Solvent-tolerant bacteria for biotransformations in two-phase fermentation systems[J].Appl Microbiol Biotechnol,2007,74(5):961-973.
[9]EVA G-Alegría,ISABEL López,J Ignacio Ruiz,et al.High tolerance of wild Lactobacillus plantarum and Oenococcus oeni strains to lyophilisation and stress environmental conditions of acid pH and ethanol[J].FEMS Microbiology Letters,2004,230(1):53-61.
[10]LI Baokun,TIAN Fengwei,LIU Xiaoming,et al.Effects of cryoprotectants on viability of Lactobacillus reuteri CICC6226[J]. Appl Microbiol Biotechnol,2011,92(3):609-616.
[11]ZHANG Juan,FU Ruiyan,Hugenholtz Jeroen,et al.Glutathione protects Lactococcus lactis against acid stress[J].Appl Environ Microbiol,2007,73(16):5268-5275.
[12]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72:248-254.
[13]GORINI A,CCNOSI U,DEVECCHI E,et al.ATPases enzyme activitives during ageing in different types of somatic and synaptic plasma membranes from rat frontal cerebral cortex[J].Progress in Neuro-Psychopharmacology&Biological Psychiatry,2002,26(1):81-90.
[14]李宝坤.乳酸杆菌冷冻干燥生理损伤机制及保护策略的研究[D].无锡:江南大学,2011.
[15]WMde Vos,Metabolic engineeringofsugarcatabolism in Lactic acid bacteria[J].Antonie van Leeuwenhoek,1996,70:223-242.
[16]张娟.谷胱甘肽对乳酸菌胁迫抗性的调控机制研究[D].无锡:江南大学,2008.
[17]胡纯铿,白凤武,安利佳.Mg2+和Ca2+对自絮凝颗粒酵母耐酒精性能的影响及作用机制的比较研究[J].高校化学工程学报,2004,18(2):179-184 HU Chunkeng,BAI Fengwu,AN Lijia.Comparison of ethanol tolerance in a self-flocculating fusant of Schizosacch aromyces pombe and Saccharomyces cerevisiae employing Mg2+or Ca2+as supplement[J].Journal of Chemical Engineering of Chinese Universities,2004,18(2):179-184.(in Chinese)
[18]HU Chunkeng,BAI Fengwu,AN Lijia.Protein amino acid composition of plasma membranes affects membrane fluidity and thereby ethanol tolerance in a self-flocculating fusant of Schizosaccharomyces pombe and Saccharomyces cerevisiae[J].Chinese Journal of Biotechnol,2005,21(5):809-813.
[19]GARBAY S,LONVAUD-FUNEL A.Characterization of membrane-bound ATPase activity of Leuconostoc oenos:growth conditions[J].Appl Microbiol Biotechnol,1994,41(5):597-602.
[20]袁峥,赵瑞香,牛生洋,等.酸胁迫下嗜酸乳杆菌菌体形态的扫描电镜观察[J].食品工业科技,2012,33(24):199-201. YUAN Zheng,ZHAO Ruixiang,NIU Shengyang,et al.Observation of the mycelia morphology of Lactobacillus acidophilus with scanning electron microscope under acid stress[J].Science and Technology of Food Industry,2012,33(24):199-201.(in Chinese)
[21]王红,范京川,徐晨,等.不同细菌浓度及离心条件对大肠杆菌透射电镜观察的影响[J].重庆医科大学学报,2010,35(3):393-395 WANG Hong,FAN Jingchuan,XU Chen,et al.The Influence of different concentration and centrifugal parameters on TEM sample preparation of Escherichia coli[J].Journal of Chongqing Medical University,2010,35(3):393-395.(in Chinese)
Effect of Ethanol Stress on the Metabolic Activity of Lactobacillus plantarum D5-5
ZHU Min, LI Baokun*, JIANG Caihong, LU Shiling,YANG Yanbin, LI Kaixiong, FAN Zhexin, JIANG Yanjie
(Food Science College,Shihezi University,Shihezi 832000,China)
To analyze the main factors causing the loss of viability and the physiological damage mechanism of Lactobacillus plantarum D5-5,in this study,the survival rates of bacteria was investigated during different treatments concentrations of ethanol.In addition,the activity changes of lactate dehydrogenase (LDH),ATPases,the extracellular relative β-galactosidase and the cell membrane with stress treatments were determined relatively.The results showed that the survival rate of Lactobacillus plantarum D5-5 was decreased by 44.07%、61.81%、69.79%with 6%~8% ethanol concentration treatments,and the activities of LDH and ATPase were significantly affected,but the extracellular relative β-galactosidase activity was increased.Meanwhile,the membrane integrity and cell ultrastructure was injured in the presence of ethanol stress treatment.The above results indicated that LDH and ATPase are the key enzymes resulting the activity loss by ethanol stress and could be used to evaluate the effect of ethanol stress on viability and metabolic activities ofLactobacillus plantarum D5-5 during different treatments concentrations of ethanol.
Lactobacillus plantarum D5-5,ethanol stress,key enzyme,integrity,damage
2.4 不同体积分数乙醇胁迫处理后对植物乳杆菌D5-5胞外β-半乳糖苷酶的影响
β-半乳糖苷酶是水解酶类,能催化乳糖生成葡萄糖和半乳糖的混合物,在动植物和微生物中广泛存在,其中以微生物来源为主。其活力大小,一方面反映菌株的发酵能力,另一方面由于β-半乳糖苷酶是细菌内源性酶,为大分子蛋白质,一般在细菌细胞发生膜损害,β-半乳糖苷酶才会释放出细菌胞外,可以作为微生物细胞膜通透性变化的一个指标[14]。作者测定了不同体积分数乙醇条件下指数末期植物乳杆菌D5-5胞外β-半乳糖苷酶相对酶活变化,结果见图4。
Q 939.11
A
1673—1689(2016)12—1300—07
2015-01-22
国家自然科学基金项目(31560444;31460007;31201395;兵团博士基金项目(2014BB005);石河子大学重点科技攻关项目(gxjs2014-zdgg07);石河子大学博士启动基金项目(RCZX201223)。
*通信作者:李宝坤(1979—),新疆石河子人,工学博士,副教授,硕士研究生导师,主要从事畜产品加工方面的研究。E-mail:libaokun1998@163.com
