去甲万古霉素生产菌株Amycolatopsisorientalis遗传操作体系的建立
2016-03-07张雪霞
赵 颖, 戴 梦, 章 丽, 张雪霞
(华北制药集团新药研究开发有限责任公司 微生物药物国家工程研究中心河北省工业微生物代谢工程技术研究中心,河北 石家庄 050015)
去甲万古霉素生产菌株Amycolatopsisorientalis遗传操作体系的建立
赵 颖, 戴 梦, 章 丽, 张雪霞*
(华北制药集团新药研究开发有限责任公司 微生物药物国家工程研究中心河北省工业微生物代谢工程技术研究中心,河北 石家庄 050015)
为了对去甲万古霉素高产菌中的功能基因进行研究,以整合型pZMW为载体,考察了去甲万古霉素生产菌东方拟无枝酸菌属间接合转移限制因素,优化3个关键限制因素:产孢培养基为YD,起始孢子量控制在1×108~4×108/反应,抗生素覆盖时间为16~17 h为宜。建立了东方拟无枝酸菌生产菌株NCPC 2-48的操作方法和培养条件,使体内分析该菌的生物合成及调控基因的功能成为可能,并为建立其他放线菌遗传操作体系提供了参考。
去甲万古霉素;东方拟无枝酸菌;接合转移;整合
去甲万古霉素(Norvancomycin)是由东方拟无枝酸菌(Amycolatopsisorientalis)发酵产生的一种糖肽类抗生素,为华北制药自主研发品种。去甲万古霉素与万古霉素结构类似,作用于细菌细胞壁,与粘肽的侧链形成复合物,从而抑制细胞壁的合成,对各种革兰阳性球菌与杆菌均具强大抗菌活性,尤其对甲氧西林耐药菌极其有效,是目前治疗由甲氧西林耐药菌引起严重感染的主要药物[1]。作为糖肽类的去甲万古霉素结构复杂,化学合成具有极大的难度,微生物发酵有不可替代的优势。菌种的优化在微生物制药领域是永恒不变的话题,而传统育种有耗时、耗力、正突变低等弊端。针对生物合成基因及其调控基因开展多表达、敲除、突变等一系列操作,不但可以增加天然产物的产量,定向积累某种化合物,还可以对天然产物进行定向改造,为药物发现开辟一条新的途经[2-3]。本研究对去甲万古霉素高产菌接合转移方法进行了详细的摸索及优化,初步建立了稳定的遗传操作体系,为次级代谢中生物合成基因及调控基因的研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌种及质粒 ET12567(pUZ8002)为接合转移供体菌,东方拟无枝酸菌NCPC 2-48为受体菌,以上均为本实验室保存。pZMW是在pSET152质粒的基础上添加了红霉素的强启动子,携带阿泊拉霉素抗性基因,含噬菌体φC31-attP整合位点,可以特异性地整合到链霉菌中,由张部昌博士惠赠[4]。
1.1.2 培养基及试剂 ①LB培养基:蛋白胨 10 g,酵母抽提物 5 g,NaCl 10 g,蒸馏水至1 000 mL[5]; ②2×YT培养基:蛋白胨 16 g,酵母提取物 10 g,NaCl 5 g,蒸馏水至1 000 mL[5];③MS培养基:黄豆粉 20 g,甘露醇 20 g,琼脂 20 g,蒸馏水至1 000 mL[5];④2CMY培养基: 可溶性淀粉 10 g,蛋白胨 2 g,K2HPO41 g,NaCl 1 g,硫酸铵 2 g,碳酸钙 2 g,琼脂 20 g,蒸馏水 1 000 mL;⑤YD培养基: 酵母抽提物 4 g, 麦芽糖 10 g,葡萄糖 4 g,MgCl22 g,CaCl21.5 g,琼脂 20 g,蒸馏水 1 000 mL, pH 7.2;⑥瓦氏肉汁琼脂培养基:蛋白胨5 g,葡萄糖10 g,牛肉膏10 g,NaCl 5 g,琼脂20 g,蒸馏水1 000 mL;⑦YEME培养基:酵母提取物 3 g, 蛋白胨 5 g,麦芽提取物3 g,葡萄糖 10 g;蔗糖 340 g,蒸馏水至1 000 mL,灭菌条件115 ℃,15 min;⑧TSBY培养基: TSB 30 g,蔗糖 340 g,酵母抽提物 5 g,琼脂20 g,蒸馏水至1 000 mL;⑨YMB培养基:K2HPO40.5 g,MgSO420 g,NaCl 0.1 g,甘露醇 10 g,酵母提取物 0.4 g,蒸馏水至1 000 mL,pH 7.0[6];⑩斜面培养基: 葡萄糖 30 g,蛋白胨 5 g,NaCl 2.5 g ,豌豆浸液 10 g ,琼脂 18 g,加水至1 000 mL[7]。
1.1.3 试剂及仪器 ExTaq酶、DNA Marker购自TaKaRa公司;阿泊拉霉素购自Sigma公司,纯度95%;萘啶酮酸、硫链丝菌素、卡那霉素、氯霉素购自生工生物工程(上海)股份有限公司,纯度均>97%;酵母抽提物、蛋白胨为Oxoid公司产品;麦芽提取物、TSB为BD公司产品;其他生化试剂为国产分析纯试剂。引物委托生工生物工程(上海)股份有限公司合成。PCR仪为PE公司9600,电泳仪为北京六一公司产品,成像系统为富士LAS 3000。
1.2 方法
1.2.1 产孢培养 共尝试5种产孢培养基:2CMY、YEME、TSBY、YD、瓦氏肉汁琼脂培养基。将斜面生长的孢子用水洗下,玻璃珠打散,过滤除掉未打散的孢子及菌丝,血球计数板计数,用水稀释至103个/mL,取50 μL单孢子液均匀涂布于以上5种固体培养基上,28 ℃培养5~7 d。
1.2.2 东方拟无枝酸菌抗生素敏感性实验 针对常用的接合转移抗生素筛选压力,分别考察东方拟无枝酸菌对阿泊拉霉素(Apramycin)和硫链丝菌素(Thiostrepton)的耐受情况。将阿泊拉霉素和硫链丝菌素按0、25、50、75、100 μg/mL的质量浓度加入45 ℃左右的MS培养基中倒平板,凝固后均匀涂布约含1×108个单孢子悬液,28 ℃培养7~10 d。
1.2.3 接合转移实验 东方拟无枝酸菌菌株在YD固体平板中培养5~7 d,无菌棉签洗下表面孢子,用含10个玻璃珠的无菌水三角锥瓶打散,过滤吸管过滤以除去未打散的孢子团及菌丝体,稀释后血球计数板计数,取1×108个/反应的孢子分装至1.5 mL Ep管中(如果用20%甘油打散的孢子可冻存于-20 ℃备用)。40、45、50 ℃下分别热激10 min和20 min,作为接合转移的受体菌。供体菌E.coliET12567/pUZ8002/pZMW在50 mL含25 mg/L卡那霉素,25 mg/L氯霉素和50 mg/L阿泊拉霉素的LB液体培养基中,于37 ℃生长至OD600值约为0.4~0.6时,离心收集菌体,用LB清洗菌体2~3遍除去抗生素,重悬于5 mL LB培养基中,作为接合转移的供体菌。将上述受体菌和5 μL供体菌混合均匀,离心,去适量上清后重悬涂布于含10 mmol/L MgCl2的MS固体培养基上,吹干后,置于28 ℃培养约17 h。用1 mL含25 mg/L萘啶酮酸和25~100 μg/mL阿泊拉霉素的无菌水覆盖,轻摇平皿使溶液分布均匀,置于28 ℃培养7 d后观察。待长出单菌落后,用牙签将菌落转移至含相同量萘啶酮酸和阿泊拉霉素的MS固体平板上复筛。再次长出的菌落在斜面上涂布均匀,待用。
1.2.4 接合转移中热激条件的考察 在接合转移实验初步建立后考察3个温度:40、45、50 ℃,分别热激10 min和20 min。28 ℃培养5~7 d后观察。
1.2.5 阳性接合子的鉴定 接合子及出发菌株用YMB培养基摇培3~4 d,用微波法[8]快速提取基因组DNA。用Am-1/Am-2引物对提取的基因组DNA进行PCR验证。PCR引物:Am-1 5′-gtg caa tac gaa tgg cga-3′,Am-2 5′-cag cca atc gac tgg cga g-3′。PCR条件反应程序:96 ℃,5 min;94 ℃ 50 s,55 ℃ 50 s,72 ℃ 1 min,35个循环。取5 μL 进行琼脂糖凝胶电泳,成像系统采集影像。
2 结果与分析
2.1 产孢培养基的选择
去甲万古霉素产生菌东方拟无枝酸菌的形态特征表现为气生菌丝菌层薄,孢子少[9]。生产菌株在经历了20多年选育后,气生菌丝及孢子变得更加贫瘠,这给接合转移带来了较大困难。为了获得足够量的孢子进行接合转移实验,本研究尝试了5种常用放线菌培养基。
单孢子在2CMY、YEME、TSBY、YD、瓦氏肉汁琼脂培养基上培养,7 d后观察,该菌在这5种培养基上的形态差异较大,菌落形态见图1。其中YEME、TSBY、2CMY平板上呈现扁平片状菌落,且没有孢子产生。YD、瓦氏肉汁琼脂培养基上呈花形,有灰白色孢子,经过活计数显示YD培养基孢子量最丰富,一支YD斜面孢子量可达到1.5×109个,而瓦氏肉汁琼脂培养基只能达到2.6×107个。最终确定YD培养基为产孢培养基。
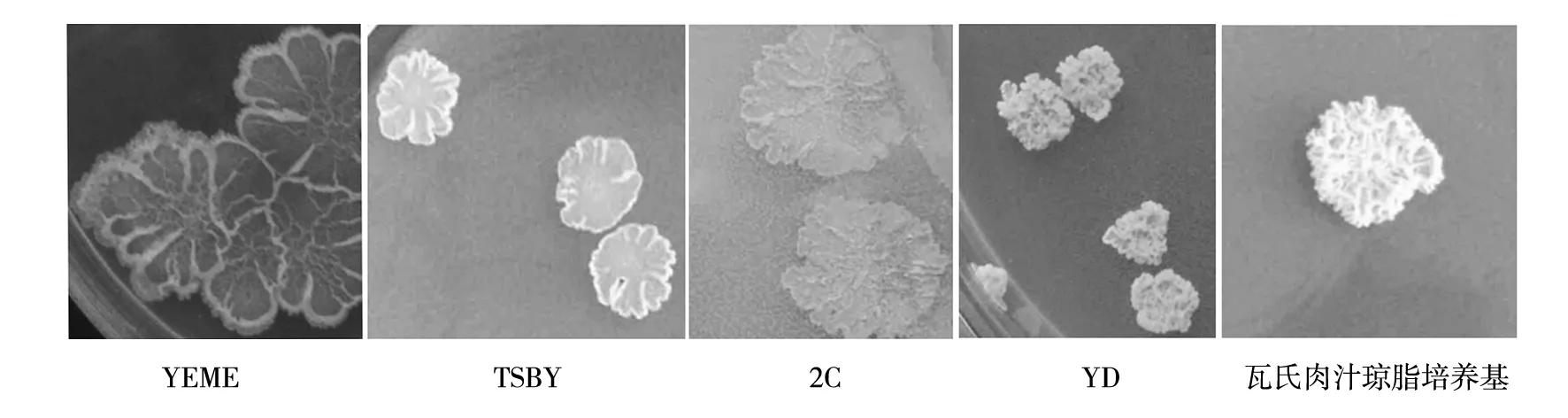
图1 不同产孢培养基上的菌落形态Fig.1 The colonial morphology of different media to spores culture
2.2 抗生素敏感性实验
为了确定接合转移质粒适合的抗生素筛选标记,首先对东方拟无枝酸菌进行了抗生素敏感实验。在含常用的阿泊拉霉素或硫链丝菌素抗生素平板上涂布了接合转移等量的孢子量,结果见表1。
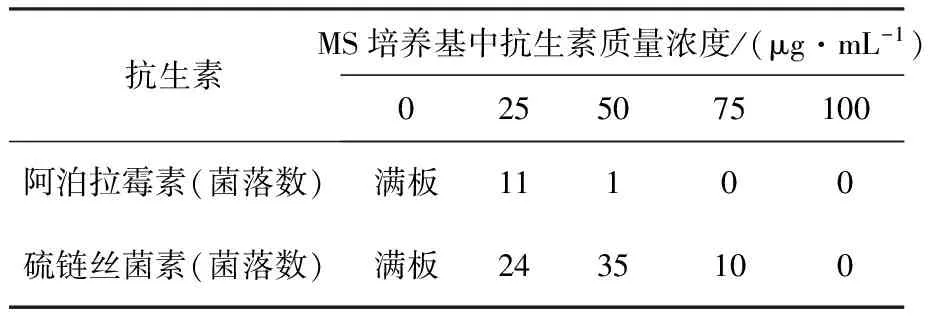
表1 东方拟无枝酸菌抗生素敏感性实验
东方拟无枝酸菌对硫链丝菌素不敏感,且有波动。而对阿泊拉霉素有较为稳定的敏感度,50 mg/L只有1个菌落长出。确定质粒的抗性筛选标记为阿泊拉霉素,使用浓度为50 mg/L。
2.3 孢子浓度
东方拟无枝酸菌对孢子浓度较为敏感,适量孢子浓度可以顺利地获得接合子。而该菌的孢子很小,计数困难,给孢子浓度的考察带来一定难度。经多次实验,按1×108~4×108/反应的孢子浓度较为适宜,过多则会产生连片的菌苔干扰接合子的挑选,过少则没有接合子长出。
2.4 热激条件的确定
适度的热激更有利于接合转移的顺利进行。在控制孢子量的前提下,考察了40、45、50 ℃三个温度,分别热激10 min和20 min,结果均有接合子长出。从接合子的生长情况来看,20 min热激时间普遍比10 min好,但3个温度差异不显著,由此可见热激温度在该菌的接合转移中并不是关键点,暂定40 ℃热激20 min。
2.5 阿泊拉霉素抗性覆盖时间
如果用抗生素作为筛选压力,则抗性覆盖时间很重要。覆盖过早,则接合转移不完全,抗性基因未得到充分表达,最终没有接合子长出;覆盖过晚,假阳性菌落较多,干扰接合子的筛选。东方拟无枝酸菌的正常菌落形态是不规则的花形,不像很多链霉菌菌落形态规则,大小均一。经反复实验,该菌的抗性覆盖时间应该在16~17 h为宜,超过17 h则会有片状菌苔出现,严重影响正常接合子的生长。
2.6 接合子的获得及鉴定
pZMW为整合型载体,进入链霉菌体内不能自主复制,需要整合至宿主菌基因组上。因此,如果在覆盖阿泊拉霉素后长出的单菌落,继续在含阿泊拉霉素及萘定酮酸平皿上复筛,再次长出的正常菌落可以初步认为是阳性接合子。
以徐平等[8]用微波法简便、快速提取放线菌菌落基因组DNA作为本文优选的实验方案。液体培养收获菌丝,利用微波法提取基因组。用一对Am抗性引物进行PCR扩增,琼脂糖凝胶电泳图见图2。
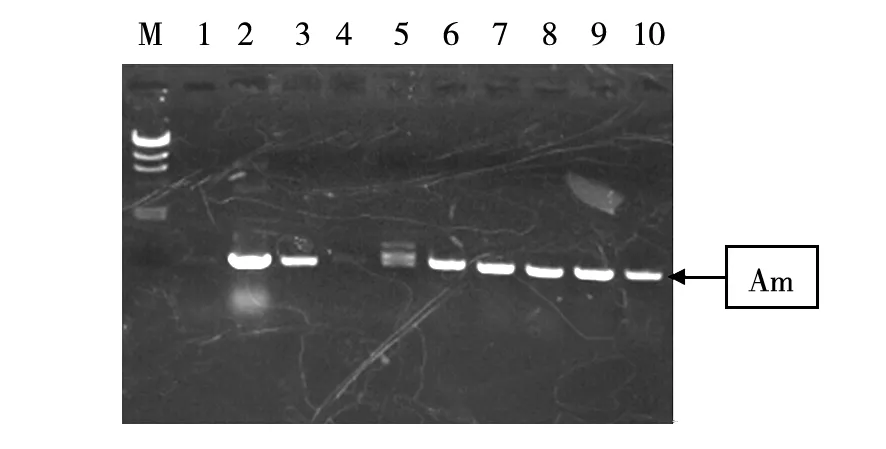
图2 接合子的鉴定Fig.2 PCR confirmation of conjugonsM:λDNA/HindIII;1:A. orientalis NCPC 2-48基因组;2:pZMW质粒;3~10:pZMW不同接合子M: λDNA/HindIII;1: A. orientalis NCPC 2-48 genomic;2: pZMW plasmid;3-10: conjugons of pZMW
3 讨 论
接合转移方法是属间基因转移方法,被广泛应用于链霉菌中[10],越来越多的放线菌成功建立了接合转移遗传操作体系[11-13],极大地方便了次级代谢相关的生物合成基因及调控基因的深入研究。
早在1987年由Matsushima P建立了原生质体方法,成功地将pIJ702导入万古霉素产生菌A.orientalisATCC 19795中[14]。2005年,贾素娟等[15]运用原生质体转化的方法成功建立了A.orientalis的DNA转化系统,随后李航等[16]提到运用接合转移的方法在A.orientalis中成功敲除了vcm14基因,但是文中并未详细描述接合转移实验过程。A.orientalisNCPC 2-48是华北制药厂去甲万古霉素的生产菌,经过多年驯化培养,该菌与低产菌相比在气生菌丝、产孢能力、发酵菌丝形态、培养特性等方面发生了很大改变。本实验室欲运用合成生物学理念对生产菌株进行遗传改造,以期获得高产量、低杂质的工程菌。用传统的接合转移方法屡次未获得稳定的接合子,或出现成片菌苔,或没有接合子长出,而且有菌苔出现时,假阳性接合子较多,干扰正常接合子的挑选。本研究通过系统地研究该菌的接合转移条件,建立并优化了大肠埃希菌/去甲万古霉素高产菌的属间接合转移系统。
本研究对几个实验点严格控制,经过多次试验终于找到关键影响因素:产孢培养基、每个反应的孢子量、抗性覆盖时间。这三个关键点严格控制后,每反应可以收获20 个左右的接合子,接合转移效率大大提高,针对高产菌成功建立了高效、操作简便的遗传操作系统,使定向改造基因,提高基因的表达水平和菌种的生产能力,获得高产出或低杂质的工程菌株等成为可能,为该菌的次级代谢合成及调控机制的探索提供参考。
[1] 陈代杰,李继安,邹韵华,等.万古霉素的研究开发[J].中国抗生素杂志,2004,29(1):8-10.
[2] Zhou H,Xie X,Tang Y.Engineering natural products using combinatorial biosynthesis and biocatalysis[J].Current Opinion in Biotechnology,2008,19 (6):590-596.
[3] 白林泉,邓子新.微生物次级代谢产物生物合成基因簇与药物创新[J].中国抗生素杂志,2006,31(1):80-89.
[4] 张部昌,李凌凌,于秀琴,等.糖多孢红霉菌表达载体pZMW的构建[J].军事医学科学院院刊,2003,27(3):176-179.
[5] Kieser T,BibbMJ,ButtnerMJ,et al.Practical Streptomyces genetics[M].The John Innes Foundation,2000:409-414.
[6] 李航,魏维,阮林高,等.东方拟无枝酸菌中vcm14基因的敲除对万古霉素合成的影响[J].中国抗生素杂志,2009,34(6):329-332.
[7] 朱研研,王耀耀,刘云清,等.微量元素和前体对去甲基万古霉素合成的影响[J].河北大学学报(自然科学版),2006,26(5):542-546.
[8] 徐平,李文均,徐丽华,等.微波法快速提取放线菌基因组DNA[J].微生物学通报,2003,30(4):82-84.
[9] 阮继生,刘志恒,梁丽糯,等.放线菌研究及应用[M].北京:科学出版社,1990:21.
[10]Jorgensen H,Degnes K F,Dikiy A,et al.Insights into the evolution of macrolactam biosynthesis through cloning and comparative analysis of the biosynthetic gene cluster for a novel macrocyclic lactam[J].Appl Environ Microbiol,2010,76(1):283-293.
[11]杨旻,陶美凤.雷帕霉素产生菌吸水链霉菌NRRL 5491接合转移系统的建立[J].华中农业大学学报,2007,26(5):637-641.
[12]方志锴,赵薇,彭飞,等.子囊霉素产生菌吸水链霉菌FIM260840基因转移系统的建立[J].生物技术,2014,24(5):44-48.
[13]严凌斌,洪文荣,方志锴,等.绛红色小单孢菌G1008接合转移体系的构建[J].中国抗生素杂志,2011,36(12):899-904.
[14]Matsushima P,Mchenny MA,Baltz RH.Efficient transformation ofAmycolatopsisorientalis(Nocardiaorientalis) protoplast byStreptomycesplasmids[J].J Bacteriol,1987,169(5):2298-2300.
[15]贾素娟,陈代杰,许文思.东方拟无枝酸菌DNA转化系统的建立[J].中国医药工业杂志,2005,36(6):332-335.
[16]李航,魏维,阮林高,等.东方拟无枝酸菌中vcm14基因的敲除对万古霉素合成的影响[J].中国抗生素杂志,2009,34(6):329-332.
欢 迎 投 稿 欢 迎 订 阅
The Establishment of Genetic Manipulation System for Norvancomycin Producing StrainAmycolatopsisorientalis
ZHAO Ying, DAI Meng, ZHANG Li, ZHANG Xue-xia
(NewDrugRes. &Devel’tCo.Ltd.,N.ChinaPharm.Co.,Nat’lEngin.Res.Ctr.ofMicrob.Med.,HebeiIndust.Microb.MetabolicEngin. &Technol.Res.Ctr.,Shijiazhuang050015)
In order to study the functional genes inAmycolatopsisorientalis, the key constraints factors of conjugation fromE.colitoA.orientaliswere studied by the integrative plasmid pZMW. Three key restricted factors were optimized: YD spore-producing medium, preliminary spore amount was controlled at 1×108~4×108/reaction, incubation time before covered by antibiotics at suitable at 16~17 hours. A genetic manipulation system for the industrial strainA.orientalisNCPC 2-48 was developed which would make the analysis of the functions of biosynthetic and regulation genes of the straininvivopossible, and provided references for the establishment of the genetic manipulation system of the other Actinomycetes.
norvancomycin;Amycolatopsisorientalis; conjugation transferring; integration
国家科技重大专项(2014ZX09201001-004)
赵颖 女,高级工程师。主要从事工业微生物遗传育种工作。E-mail:zhaoyingxx@163.com
2016-01-26;
2016-03-03
Q93
A
1005-7021(2016)06-0035-05
10.3969/j.issn.1005-7021.2016.06.006
* 通讯作者。女,正高级工程师,硕士生导师。研究方向为天然药物与微生物制药。Tel:0311-85992995,
E-mail:zhangxuexiazxx@163.com
