高产莫纳可林K低产桔霉素红曲霉菌株的筛选和发酵条件初步优化
2016-03-07蒋冬花冯青青郑婕施韩肖飞
蒋冬花 , 冯青青, 任 浩, 章 婷, 郑婕施, 韩肖飞
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
高产莫纳可林K低产桔霉素红曲霉菌株的筛选和发酵条件初步优化
蒋冬花 , 冯青青, 任 浩, 章 婷, 郑婕施, 韩肖飞
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
采集全国各地红曲霉制品中的红曲霉资源,经分离获278株红曲霉菌株。高效液相色谱(HPLC)法测定各菌株发酵液中莫纳可林 K(Monacolin K)和桔霉素含量,筛选获1株Monacolin K产量较高、桔霉素含量较低的红曲霉菌株编号为M-22。依据形态特征和ITS基因序列,参照红曲霉属分类检索表,鉴定M-22菌株为紫色红曲霉(Monascuspurpureus)。通过摇瓶发酵对温度、初始pH、碳源、氮源、碳氮比(C/N)等因素进行优化,确定M-22菌株摇瓶发酵产Monacolin K适宜条件为发酵温度26 ℃、初始pH 5.0、转速160 r/min,甘油为碳源、蛋白胨为氮源、碳氮比(C/N)为5∶1,Monacolin K产量显著提高,最高为107.16 mg/L。以优化的发酵条件对M-22菌株进行5 L发酵罐发酵,发酵液中Monacolin K产量最高为189.83 mg/L,桔霉素含量32.53 μg/L,红曲色素色价为16.38 U/mL。
红曲霉;Monacolin K;桔霉素;筛选;发酵条件
红曲霉(Monascus)是我国酿造微生物中的一个重要的属,至今已有数百年的历史[1]。近几年红曲霉的许多功效相继被证实,其发酵产物γ-氨基丁酸、莫纳可林 K(Monacolin K)、红曲色素等已广泛应用于医药保健、食品加工及相关领域中[2-3]。1979年,日本学者Endo等[4]从红色红曲霉(Monascusruber)发酵液中分离得到一种可抑制体内胆固醇合成的活性物质,命名为Monacolin K。Monacolin K是一种甲基戊二酞辅酶A还原酶(HMG-CoA还原酶)的抑制剂,有降低胆固醇、降血脂作用,其分子式为C24H36O5,分子量404[5]。现国内已有以红曲为主要成分的中成药如“血脂康”和“地奥脂必妥”等上市应用,且疗效确切,其关键成分就是Monacolin K。1995年法国学者Blanc等[6]首先在红曲霉中发现毒性物质——桔霉素,使红曲霉制品在国内外的推广受到了一定限制。因此,从各地红曲霉制品中分离红曲霉资源,筛选高产有益产物Monacolin K、低产桔霉素的红曲霉菌株,对我国传统微生物资源的保护和利用有积极的意义。由于Monacolin K的多种生理活性,产Monacolin K的红曲霉及其发酵制品一直都是国内外学者的研究热点[2,5,7]。但目前国内缺乏优良高效菌种,对于Monacolin K的生产也处于粗放状态,其发酵生产还处于探索和完善的阶段[8-9],筛选稳定高产的Monacolin K红曲霉菌株是Monacolin K工业化生产的源头和核心,对进一步发掘和保护红曲霉菌株资源具有重要意义。
1 材料与方法
1.1 材料
1.1.1 红曲霉菌株 从全国各地购买或采集市售的红曲米、红曲酒、红曲腐乳等红曲霉制品,经分离纯化筛选获得。
1.1.2 主要培养基 ① PDA培养基和PD培养基[7]:用于红曲霉各菌株的分离、纯化、筛选和种子培养;② 基础培养基(质量分数,%):葡萄糖6,蛋白胨2,KH2PO40.2,MgSO4·7H2O 0.1,NaNO30.2,水100 mL,pH 6.0。用于发酵条件的优化;③ 发酵培养基(质量分数,%):甘油13,大米水解液5,大豆蛋白胨3,酵母膏0.5,MgSO4·7H2O 0.1,NaNO30.2,KH2PO40.1,ZnSO40.2,水100 mL,pH 5.0。用于5 L发酵罐发酵。
1.2 方法
1.2.1 红曲霉菌株的分离纯化与保藏 红曲米等红曲霉制品0.5 g研磨成粉,取少量均匀洒入PDA培养基表面,28 ℃培养48 h,待白色绒毛状菌丝长出后,挑取少许菌丝转接于另一PDA培养平板上继续培养1周,显微镜观察具有红曲霉的典型特征,挑取少许边缘菌丝纯化3次,得性状均一的红曲霉纯菌株,编号后保存于25%甘油中,置于4 ℃冰箱备用。
1.2.2 高产Monacolin K、低含量桔霉素菌株的筛选 红曲霉各菌株接种于PDA培养基上,28 ℃培养7 d;转接种于PD培养液中,26 ℃、200 r/min摇床培养5 d,取发酵液用HPLC检测。① HPLC法检测发酵液中Monacolin K含量[10]:取发酵液1 mL,煮沸10 min,4 ℃、8 000 r/min离心10 min,上清液用HPLC法检测Monacolin K产量。配制梯度浓度的Monacolin K标准品用下述色谱条件测定产量并绘制标准曲线。色谱条件:Agilent TC-C18液相色谱柱(250 mm×4.6 mm,5 μm),A溶液为乙腈(0.45 μm有机相滤膜过滤),B溶液为pH值2.5的磷酸溶液(0.45 μm水相滤膜过滤)。检测波长λ=237 nm;流速0.6 mL/min;柱温50 ℃。得出相关系数高的标准曲线后,发酵上清液用相同的色谱条件测定Monacolin K产量。② TLC结合HPLC法检测发酵液中桔霉素含量[10]:在5 mL的离心管中吸取发酵液1 mL,加入2 mL 的甲醇,混匀后用封口膜和保鲜膜封好管口,与磁力搅拌转子绑在一起,放在60 ℃的集热式磁力搅拌器内搅拌1 h,取出后在4 ℃、3 000 r/min的条件下离心15 min;取上清液,用毛细吸管点于制好的硅胶板上,用展开剂V(甲苯)∶V(乙酸乙酯)∶V(甲酸)= 6∶3∶1展开,在紫外灯下观察,Rf值在0.7~0.8之间的黄绿色条带即为桔霉素显色条带明暗程度。刮取桔霉素条带的硅胶加入甲醇溶解,HPLC法定量检测。配制梯度浓度的桔霉素标准品用下述色谱条件测定含量并绘制标准曲线。Agilent TC-C18液相色谱柱(250 mm×4.6 mm,5 μm),V(流动相乙腈)∶V(甲醇)∶V(水)=70∶10∶20,荧光检测器(检测波长λex=331 nm、λem=500 nm),流速1 mL/min,柱温28 ℃。得出相关系数高的标准曲线后,发酵上清液用相同的色谱条件测定桔霉素含量。
1.2.3 红曲霉目的菌株的鉴定 用柱式真菌基因组DNA抽提试剂盒,按操作说明提取PDA上培养7 d的红曲霉M-22菌株基因组DNA,用真菌通用引物: ITS1-TCCGTAGGTGAACCTGCGG; ITS4-TCCTCCGCTTATTGATATGC 进行PCR扩增。PCR反应条件:95 ℃预变性5 min,94 ℃变性40 s,56 ℃退火1 min,72 ℃延伸1.5 min,35个循环,72 ℃延伸10 min,4 ℃保存,1%琼脂糖凝胶电泳后割胶回收目的条带送上海生工公司测序。显微镜观察M-22菌株的形态特征,结合ITS基因序列Blast比对结果,确定M-22菌株的分类地位。
1.2.4 摇瓶优化发酵条件提高Monacolin K产量 M-22菌株28 ℃、200 r/min液体培养7 d,探讨培养基配方和培养条件对M-22菌株产Monacolin K的影响。① 碳源:葡萄糖、大米粉、木糖、淀粉、甘油;② 氮源:牛肉膏、蛋白胨、酵母膏、硝酸钠、硫酸铵;③碳氮比(C/N,质量比):2/1、3/1、4/1、5/1、6/1、7/1;④ 初始pH值:pH 4、pH 5、pH 6、pH 7、pH 8;⑤ 培养温度:24、26、28、30、32 ℃;⑥ 摇床转速:120、140、160、180、200、220 r/min。设3次重复,发酵液用HPLC法检测Monacolin K产量。
1.2.5 5L发酵罐发酵及发酵产物动态变化检测 M-22菌株在PD种子培养基中,26 ℃、200 r/min摇瓶培养5 d。过滤菌液菌丝,吸取孢子浓度为1×105个/mL的孢子液5 mL转接到PD二级种子液中,26 ℃、200 r/min摇床培养5 d,按15%接种量接入发酵培养基中进行5 L发酵罐发酵。① M-22菌株生物量检测和生长曲线制作:每4 h取样30 mL,5 000 r/min、10 min离心弃上清,无菌水洗涤3次,60 ℃烘箱烘至恒重后进行称量。以取样时间为横坐标,M-22菌株菌丝干重为纵坐标绘制生长曲线。② Monacolin K产量随发酵时间变化曲线绘制:HPLC法检测上清液中Monacolin K含量。以发酵时间为横坐标,M-22菌株的Monacolin K产量为纵坐标,绘制M-22菌株Monacolin K产量随发酵时间变化曲线。③ 桔霉素含量随发酵时间变化曲线绘制:HPLC法检测上清液中桔霉素产量。以发酵时间为横坐标,M-22菌株的桔霉素含量为纵坐标,绘制M-22菌株桔霉素含量随发酵时间变化曲线。④ 红曲色素提取、色价检测和变化曲线绘制[10-11]:吸取1 mL发酵液于5 mL的离心管中,加入2 mL 70%的乙醇,混匀后,调节pH至6.0~7.0。静置20 min后,5 000 r/min离心10 min,取上清液检测。以70%乙醇溶液做参比,测定505 nm处的OD值。按公式计算:色价(U/mL)=稀释倍数×吸光值。以发酵时间为横坐标,M-22菌株的色素色价为纵坐标,绘制M-22菌株色素色价随发酵时间变化曲线。
1.2.6 数据分析 用SPSS(Statistical Product and Service Solutions)软件分析显著性及相关性。
2 结果与分析
2.1 HPLC测定Monacolin K和桔霉素标准品的色谱图和标准曲线
2.1.1 Monacolin K和桔霉素标准品的色谱图 如图1所示,Monacolin K标准品出峰时间为6.9 min左右,桔霉素标准品出峰时间为16.96 min左右。
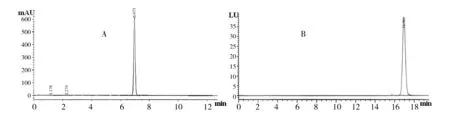
图1 Monacolin K(A)和桔霉素(B)标准品的HPLC色谱图 Fig.1 High performance liquid graph of Monacolin K (A)and citrinin (B)standard sample
2.1.2 Monacolin K和桔霉素的标准曲线 ①Monacolin K标准曲线:以一系列不同Monacolin K标准品质量浓度为横坐标,峰面积为纵坐标,绘制Monacolin K标准曲线如图2所示。HPLC法检测Monacolin K的标准曲线为y = 44.653x + 14.445,相关系数R2=0.999 9,符合要求。②桔霉素标准曲线:以一系列不同桔霉素标准品质量浓度为横坐标,峰面积为纵坐标,绘制桔霉素标准曲线如图2所示。HPLC法检测桔霉素的标准曲线为y = 45.44x + 0.015 2,相关系数R2=0.999 9,符合要求。
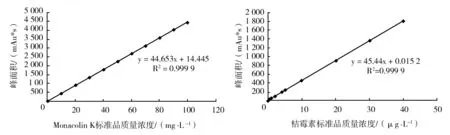
图2 Monacolin K和桔霉素的标准曲线Fig.2 Standard curve of Monacolin K and citrinin
2.2 高产Monacolin K红曲霉菌株的分离纯化与筛选
分离纯化筛选共获278株红曲霉纯菌株,编号后,保藏于-80 ℃冰箱中。HPLC法检测278株红曲霉纯菌株发酵液,筛选获得11株Monacolin K产量较高菌株,其中M-22号菌株Monacolin K最高,达28.29 mg/L(表1)。
2.3 低产桔霉素红曲霉菌株的筛选
利用甲醇浸提红曲霉菌株发酵液(包括菌丝)中桔霉素,通过薄板层析(TCL),在254 nm紫外光下观察桔霉素条带的明暗程度(图3),初步判别各转化子桔霉素含量的高低;再将桔霉素荧光条带刮下溶于甲醇中,HPLC法检测桔霉素含量(表1、图3)。结果表明M-22菌株发酵液中桔霉素含量最低,为8.83 μg/L(表1)。选取M-22菌株为后续实验菌株。
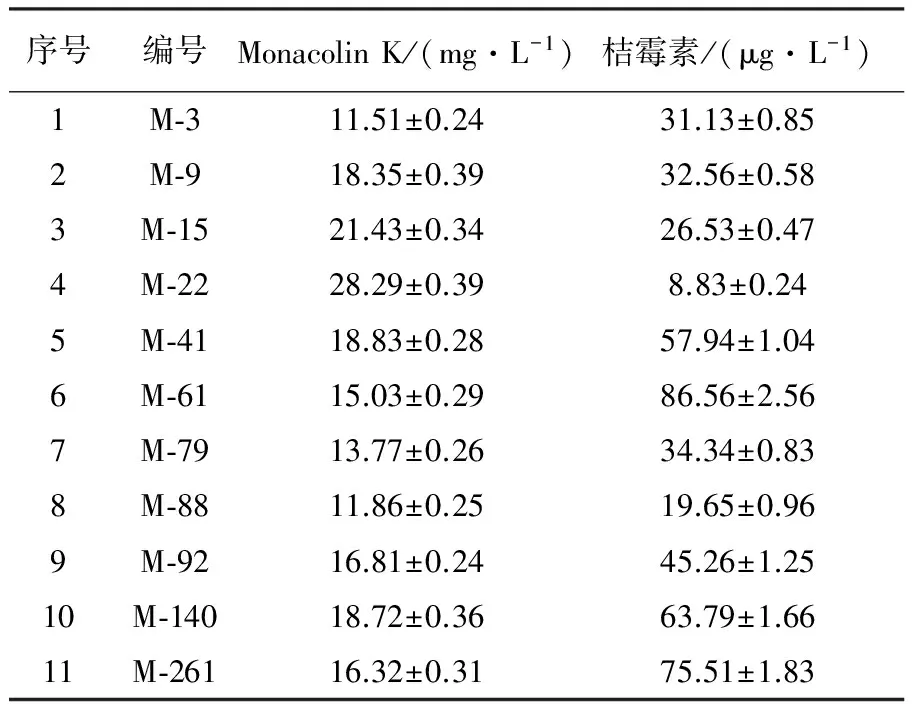
表1 11株Monacolin K产量较高的红曲霉菌株与桔霉素含量
注:Monacolin K产量、桔霉素含量为3次重复测定的平均值
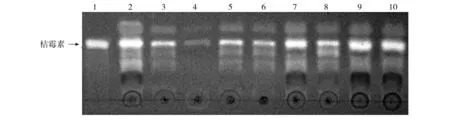
图3 9株代表性红曲霉菌株发酵液桔霉素含量薄层层析结果Fig.3 Results of citrinin TLC from fermentation broth of 9 Monascus strains1:桔霉素标准品;2~10:红曲霉不同菌株发酵液桔霉素甲醇提取物1:Citrinin standard sample;2-10:Methanol extract citrinin of 9 Monascus strains
2.4 红曲霉M-22菌株的鉴定
2.4.1形态特征 M-22红曲霉菌株PDA上28 ℃培养15 d,PDA培养基上的菌落呈橘红色绒毛状,边缘呈白色,菌落直径达60 mm;显微镜观察菌丝有隔膜和色素颗粒;分生孢子近球形或倒梨形,单生或成链,大小为(6~10) μm×(7~9) μm;闭囊壳呈球形,囊内孢子可见,子囊孢子椭球形,大小为(5~6) μm×(3~5) μm,透明淡红色(图4)。

图4 M-22菌株的菌落(A)、菌丝和分生孢子(B)及闭囊壳和子囊孢子(C)Fig.4 The colony (A), hypha and conidia (B) and cleistothecia and ascospores (C) of strain M-22
2.4.2 ITS基因序列 M-22菌株的基因组DNA和ITS PCR扩增产物电泳图谱见图5,ITS 基因序列分析结果见图6,其长度为551 bp,基于红曲霉属ITS序列建立的系统发育树如图7,与紫色红曲霉(Monascuspurpureus)的相似度最高,为99%。
2.4.3 M-22菌株鉴定结果 根据M-22菌株形态特征和ITS 基因序列,结合李钟庆和郭芳红曲霉分种检索表[1],鉴定为紫色红曲霉(Monascuspurpureus)。
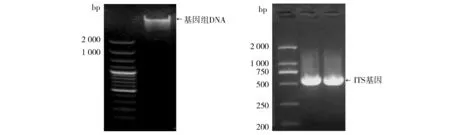
图5 M-22菌株的基因组DNA和ITS基因PCR产物电泳图Fig.5 The genomic DNA and ITS gene electrophoresis diagram of strain M-22

图6 M-22菌株ITS基因序列(551 bp)Fig.6 The ITS gene sequence of strain M-22(551 bp)
2.5 M-22菌株摇瓶发酵条件优化
以Monacolin K产量为指标,经单因素优化M-22菌株适宜的发酵条件为培养温度26 ℃、pH 5.0、摇床转速160 r/min时,甘油为碳源、蛋白胨为氮源、C/N(甘油∶蛋白胨)为5∶1(质量比)时,Monacolin K产量最高为107.16 mg/L(图8)。
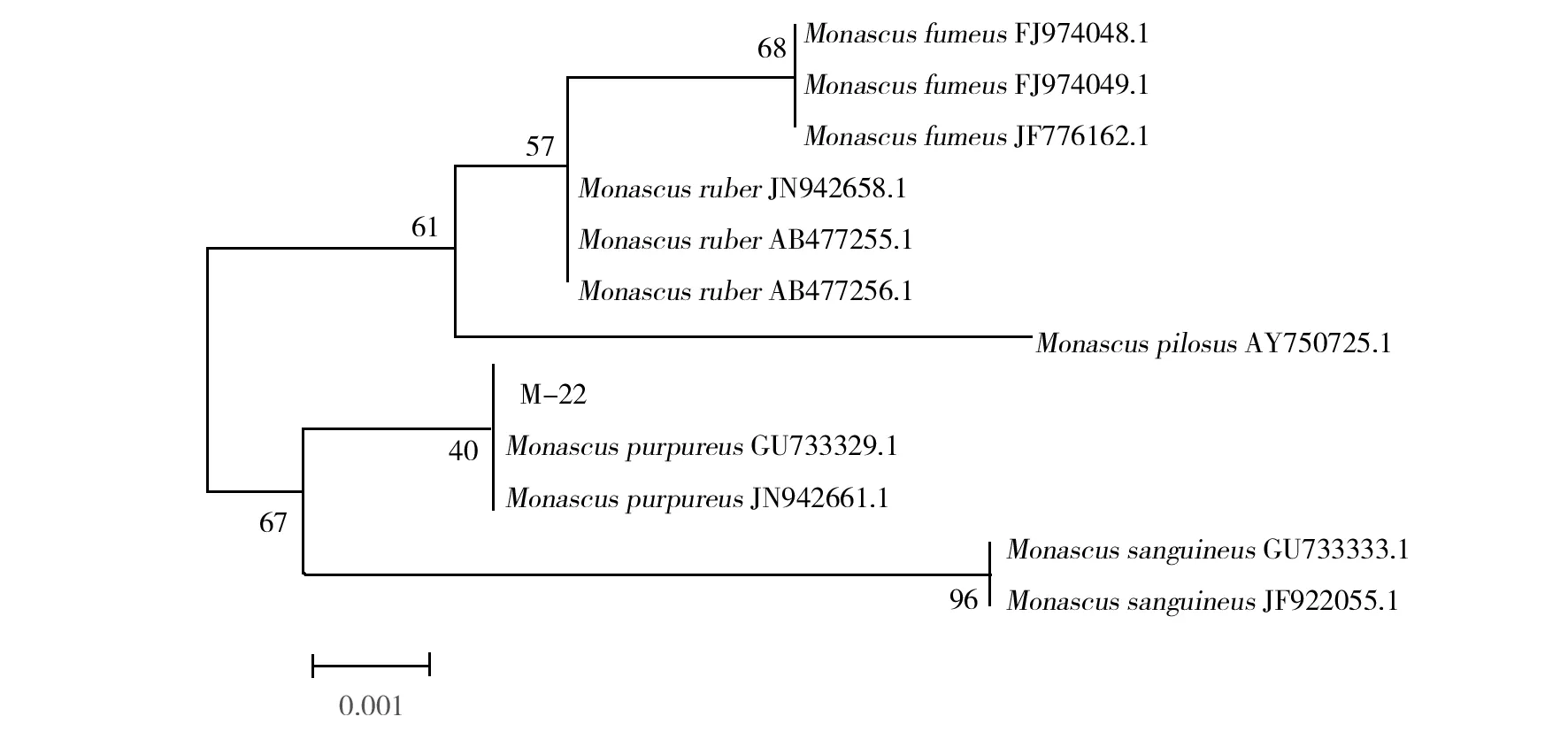
图7 基于12株红曲霉属ITS基因序列建立的M-22菌株系统发育树Fig.7 Phylogenetic tree of strain M-22 based on ITS gene sequence of 12 Monascus strains
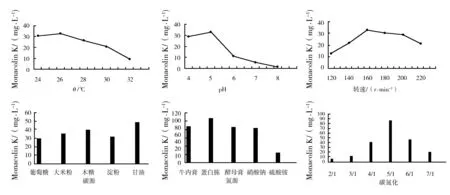
图8 培养基配方和发酵条件对M-22菌株Monacolin K产生的影响Fig.8 The effect of culture medium and fermentation conditions on production of Monacolin K of strain M-22
2.6 5 L发酵罐发酵M-22菌株及代谢产物的动态检测
按15%接种量,26 ℃、pH 5.0、转速160 r/min,通气量80~120 L/h,罐压0.1~0.5 MPa条件下,用发酵培养基进行5 L发酵罐发酵M-22菌株,并检测代谢产物的动态变化。
① M-22菌株的生长曲线:发酵0~24 h为延滞期(图9A),24~92 h进入对数期,92~120 h处于稳定期,120 h以后进入衰亡期;生物量最大值为191.23 g/L;② 发酵液中Monacolin K产量动态变化:发酵68 h后Monacolin K产量开始快速增长,144 h达到最高,为189.83 mg/L(图9A);③ 发酵液中桔霉素含量动态变化:68~116 h桔霉素含量增长较快;140 h之后基本处于稳定,桔霉素最高含量为32.53 μg/L(图9B);④ 发酵液中红曲色素色价动态变化:M-22菌株发酵液中红曲色素最高色价为16.38 U/mL(图9B)。
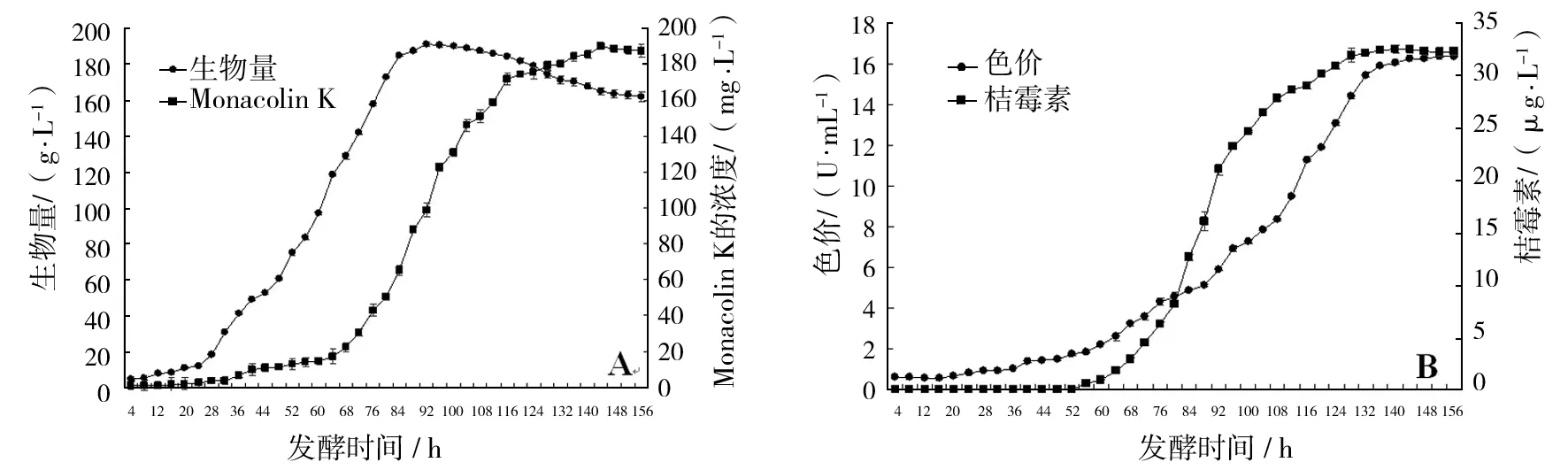
图9 M-22菌株发酵过程中生物量和Monacolin K(A)、色价和桔霉素(B)的变化Fig.9 Time courses of biomass and Monacolin K (A), color value and citrinin (B) of strain M-22 during the fermentation process
3 讨 论
本研究筛选获1株Monacolin K产量较高、桔霉素含量较低的红曲霉菌株(编号为M-22)。依据形态特征和ITS基因序列,参照红曲霉属分类检索表,鉴定M-22菌株为紫色红曲霉(Monascuspurpureus)。张朝晖等[12]利用添加酵母膏的葡萄糖-甘油培养基,使紫色红曲霉产量达104 mg/L;徐伟等[13]优化了影响发酵的主要因素,使红曲霉M5028菌株的Monacolin K产量达到了168.73 μg/mL;胡文效等[8]对红曲霉MS-12菌株进行紫外照射、LiCl诱变以及硫酸二乙酯处理与LiCl复合诱变三次诱变,最终Monacolin K产量提高到264.7 μg/mL;陈泉等[14]通过原生质体融合技术和发酵条件优化,使Monacolin K产量提高到1 216 mg/L。本研究筛选的红曲霉M-22菌株在初步优化条件下Monacolin K产量为189.83 mg/L,通过培养基配方的进一步优化,结合理化诱变和原生质体融合等技术,产量有望大幅度提高[7,14]。
[1] 李钟庆, 郭芳. 红曲菌的形态与分类学[M]. 北京:中国轻工业出版社, 2003:1-45.
[2] Feng Y L, Shao Y C, Zhou Y X, et al. Monacolin K production by citrinin-freeMonascuspilosusMS-1 and fermentation process monitoring[J]. Engineering in life sciences, 2014, 14(4):538-545.
[3] Feng Y L, Shao Y C, Zhou Y X, et al. Effects of glycerol on pigments and Monacolin K production by the high-Monacolin K-producing but citrinin-free strain,MonascuspilosusMS-1[J]. European Food Research and Technology, 2015, 240(3): 635-643.
[4] Endo A, Monacolin K. A new hypocholesterolemic agent produced by aMonascusspecies[J]. Journal of Antibiotics, 1979, 32(8): 852-854.
[5] Jirasatid S, Montira N, Panit K, et al. Statistical optimization for Monacolin K and yellow pigment production and citrinin reduction byMonascuspurpureusin solid-state fermentation[J]. Journal of Microbiology and Biotechnology,2013, 23(3): 364-374.
[6] Blanc P J, Loret M O, Gomam G. Production of citrinin by various species ofMonascus[J]. Biotechnology Letters, 1995, 17(3): 291-294.
[7] Zhang J, Wang Y L, Lu L P, et al. Enhanced production of Monacolin K by addition of precursors and surfactants in submerged fermentation ofMonascuspurpureus9901[J]. Biotechnology and Applied Biochemistry, 2014, 61(2): 202-207.
[8] 胡文效, 魏彦锋, 蒋锡龙, 等. 高产Monacolin K红曲霉菌种的诱变选育及液态发酵工艺优化[J]. 食品工业科技, 2013, 34(24): 296-301.
[9] 李亚莉, 黑利生, 秘鸣, 等. 1株紫色红曲菌(MPT13)产洛伐他汀发酵条件的优化[J]. 食品工业, 2013,(8):70-72.
[10]何晓娇, 陈璨, 周月婷, 等. 高产γ-氨基丁酸低产桔霉素红曲霉(Monascusruber)突变子1047筛选与发酵特性研究[J]. 微生物学杂志, 2014, 34(4): 38-43.
[11]曹丽凌, 齐育平, 梁帅帅, 等. 两株紫色红曲菌根癌农杆菌介导的T-DNA 转化子的生物学特性[J]. 浙江师范大学学报(自然科学版), 2013, 36(2): 217-223.
[12]张朝晖, 王圆, 周立平, 等. 不产桔霉素的红曲霉菌种深层发酵生产莫纳可林K[J]. 工业微生物, 2005, 35(4): 1-5.
[13]徐伟, 王金凤, 易曼. 红曲霉玉米发酵产Monacolin K最佳条件研究[J]. 哈尔滨商业大学学报, 2008, 24(2): 207-209.
[14]陈泉, 吴远征, 扈进冬, 等. 高产Monacolin K红曲霉菌种的筛选及液态发酵条件优化[J]. 中国酿造, 2015, 34(6): 43-47.
ScreeningMonascusstrains and Initial Optimization Fermentation Conditions of Higher-Yielding Monacolin K and Low-Yielding Citrinin
JIANG Dong-hua, FENG Qing-qing, REN Hao, ZHANG Ting, ZHENG Jie-shi, HAN Xiao-fei
(Coll.ofChem. &LifeSci.,ZhejiangNormalUni.,Jinhua321004)
278Monascusstrains were isolated fromMonascusresources collection ofMonacusproducts around the country. AMonascusstrain (No: M-22) which produces higher monacolin K and lower citrinin was screened from the isolated strains with HPLC determination. Based on their ITS sequence and morphology characteristics, and referred to classification searching table ofMonascus, the strain M-22 was classified asMonascuspurpureus. Through factors optimization of the fermentation temperature, initial pH, carbon source, nitrogen source, ratio of carbon and nitrogen (C/N) etc. the suitable conditions for monacolin K production in shaking flask fermentation were: temperature 26 ℃, initial pH 5.0, 160 r/min, glycerol as carbon source, peptone as nitrogen source, with C/N ratio at 5∶1. The monacolin K production was significantly increased with the highest at 107.16 mg/mL. With the same optimized fermentation conditions applied to amplified fermentation in 5 L fermentation tank. The highest production of monacolin K was at 189.83 mg/mL, and the content of citrinin was 32.53 μg/L and monascus pigment value of was 16.38 U/mL.
Monascus; monacolin K; citrinin; screening; fermentation conditions
国家自然科学基金项目(31270061,31570013)
蒋冬花 女, 教授,博士, 硕土生导师。研究方向为应用微生物学。E-mail: jdh@zjnu.cn
2016-01-18;
2016-04-02
Q93
A
1005-7021(2016)06-0010-07
10.3969/j.issn.1005-7021.2016.06.002
