蟾毒灵对人结肠癌HCT8细胞凋亡及钙离子代谢的影响
2016-03-06石晓静孙剑玥邱艳艳邹瑜袁玉霞张祎稀唐雪瑶殷佩浩上海中医药大学附属普陀医院上海200062
石晓静,孙剑玥,邱艳艳,邹瑜,袁玉霞,贺 雪,张祎稀,唐雪瑶,殷佩浩上海中医药大学附属普陀医院,上海 200062
·论 著·
蟾毒灵对人结肠癌HCT8细胞凋亡及钙离子代谢的影响
石晓静,孙剑玥,邱艳艳,邹瑜,袁玉霞,贺 雪,张祎稀,唐雪瑶,殷佩浩
上海中医药大学附属普陀医院,上海 200062
目的探讨蟾毒灵对人肠癌HCT8细胞凋亡及钙离子代谢的影响及其机制。方法采用CCK-8法和Annexin V/PI双染凋亡试剂盒检测蟾毒灵对人肠癌HCT8细胞增殖和凋亡的影响,Ca2+荧光探针Fluo-3 AM标记HCT8细胞内Ca2+并检测蟾毒灵对细胞内Ca2+的影响。结果蟾毒灵抑制人结肠癌HCT8细胞增殖呈剂量-时间依赖性;诱导细胞凋亡,呈剂量依赖性;且蟾毒灵浓度越高,细胞内Ca2+浓度越高。结论蟾毒灵诱导人结肠癌HCT8细胞凋亡,可能与细胞内Ca2+代谢相关。
结肠癌;蟾毒灵;凋亡;钙离子
结直肠癌是最常见的消化道恶性肿瘤之一,在美国发病率和死亡率均位居第三[1],且逐年上升,我国发病率和死亡率分别是20.9/100 000、10.05/100 000[2]。目前最有效的治疗方法是手术辅以放、化疗。而中医药治疗可明显改善患者化疗不良反应[3-5]。
蟾毒灵提取自中药蟾酥,是其主要的有效成分。本课题组对蟾毒灵抗结肠癌及其机制的多年研究表明,蟾毒灵可诱导癌细胞凋亡,是抗癌的重要物质之一[6-9],但蟾毒灵诱导人结肠癌HCT8细胞凋亡与细胞内Ca2+代谢的相关性,迄今未有定论。本研究旨在探讨蟾毒灵对人结肠癌HCT8细胞凋亡、Ca2+代谢的影响及其可能机制。
1 材料与方法
1.1 主要试剂与仪器
人结肠癌HCT8细胞购买于中国科学院上海细胞库;蟾毒灵购自于成都瑞芬思生物科技有限公司;CCK-8试剂盒购自东京同仁化学有限公司;Annexin V/PI双染凋亡试剂盒和流式细胞仪购自于BD公司;Ca2+荧光探针购自Sigma公司;1640培养基、胎牛血清、胰酶、青霉素、链霉素购自Gibco公司;多功能荧光酶标仪购自Thermo公司。
1.2 方法
1.2.1 细胞培养技术
将细胞置于含有1640培养基(含10%胎牛血清)的培养瓶中,在5%CO2、37℃培养箱中培养。细胞用含EDTA的胰蛋白酶消化,取对数生长期细胞用于后续实验。
1.2.2 细胞增殖测定
取密度为5×104个/mL的细胞均匀铺于96孔板中,每孔100 μL,培养24 h后分别加入2.5、10、20、40、80、160、320、640、1 280 nmol/L蟾毒灵作用24 h,再取80 nmol/L蟾毒灵分别于3、6、12、24、48 h处理细胞后,吸弃培养基,加入含10%CCK-8工作液的培养基置于恒温培养箱中孵育1.5 h。运用多功能荧光酶标仪检测细胞光密度值(450 nm)。
1.2.3 Annexin V/PI双染凋亡检测
取密度为5×104个/mL的细胞均匀铺于6孔板中,每孔2 mL培养。隔日分别加入2.5、10、20、40、80、160、320、640、1 280 nmol/L蟾毒灵处理24 h。收集上清,磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗2遍,胰酶消化,收集细胞,1 500 r/min离心5 min,PBS重悬,再离心,重复2遍,用1×Binding Buffer重悬,取密度为1×105个/mL细胞100 μL至流式管中,分别加入5 μL的Annexin V/PI,室温避光震荡15~20 min,后每管再加入200 μL 1×Binding Buffer,混匀,流式细胞仪检测。
1.2.4 Ca2+荧光探针Fluo-3 AM标记细胞内Ca2+
将细胞接种于6孔板中,待细胞贴壁后,分别用0、80、160、320、640、1 280 nmol/L蟾毒灵处理24 h,然后加入2 μmol/L Fluo-3 AM于37℃、5%CO2条件下孵育30 min,PBS清洗2遍,胰酶消化并收集细胞,1 500 r/min离心5 min,Ca2+-free PBS重悬,再离心,500 μL Ca2+-free PBS重悬细胞后用流式细胞仪(FL-1,Ex=488 nm,Em=530 nm)检测细胞内游离Ca2+变化。
1.3 统计学分析
2 结果
2.1 蟾毒灵对人结肠癌HCT8细胞增殖的影响
如图1所示,蟾毒灵作用于HCT8细胞24 h,随浓度递增其抑制细胞增殖的作用增强,呈剂量依赖性,IC50约80 nmol/L;用80 nmol/L蟾毒灵作用于HCT8细胞,随时间延长其抑制细胞增殖的作用增强,呈时间依赖性。

图1 蟾毒灵对人结肠癌HCT8细胞增殖的影响Fig.1 Effects of bufalin on proliferation of colorectal cancer HCT8 cells
2.2 蟾毒灵诱导人结肠癌HCT8细胞凋亡
如图2所示,蟾毒灵作用于HCT8细胞24 h,随浓度增高蟾毒灵诱导细胞凋亡率逐渐增高,亦呈剂量依赖性。
2.3 蟾毒灵致人结肠癌HCT8细胞Ca2+内流
如图3所示,蟾毒灵作用于HCT8细胞24 h,随浓度增加蟾毒灵使胞内Ca2+浓度增加,即Ca2+内流情况加重。
3 讨论
针对结肠癌的治疗,目前临床最常见的方法是手术切除,并辅以放疗、化疗、生物治疗、中医药治疗等综合治疗,延长患者生存期。但术后并发症和放、化疗的不良反应严重影响患者的生存质量。大量研究表明,中药在抑制结肠癌发生、发展上具有显著疗效[3-5]。在抑制肿瘤复发转移、逆转多药耐药、增强放化疗敏感性和改善患者症状等方面发挥重要作用。其中,蟾毒灵具有一定的细胞毒性,抗癌作用已取得一定进展,包括诱导癌细胞凋亡、分化,抑制增殖,增强放、化疗敏感性等,但具体机制尚不明确。诱导癌细胞凋亡是治疗癌症的重要方向之一。研究表明,蟾毒灵能诱导癌细胞凋亡[11-15],但凋亡机制尚不明确。本研究初步探索了蟾毒灵对人结肠癌HCT8细胞凋亡和Ca2+代谢的影响及其可能的机制。
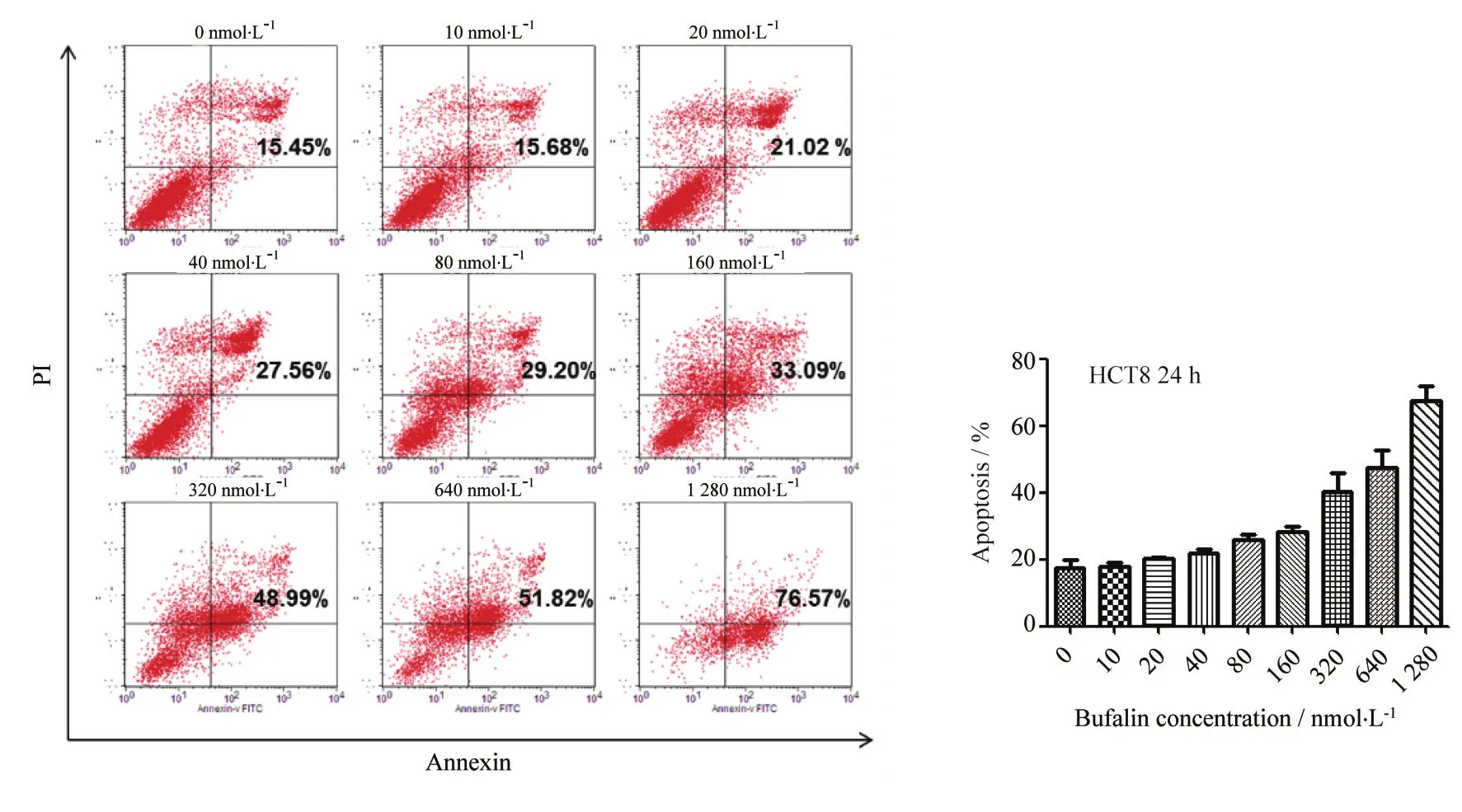
图2 蟾毒灵对人结肠癌HCT8细胞凋亡的影响Fig.2 Effects of bufalin on apoptosis of colorectal cancer HCT8 cells
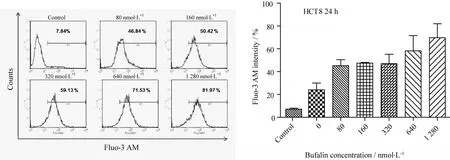
图3 蟾毒灵对人结肠癌HCT8细胞Ca2+内流的影响Fig.3 Effects of bufalin on intracellular Ca2+in colorectal cancer HCT8 cells
细胞凋亡是机体的一种主动、程序化的过程,受体内多种因素调节,是细胞衰老、死亡过程的主要形式。内质网与线粒体间的钙通路是细胞凋亡的一个重要环节。有研究表明,Ca2+通道抑制剂对多种肿瘤细胞表现出抗癌活性,且在临床上已作为抗肿瘤化疗的辅助用药[16]。Ca2+通透性通道主要包括电压门控钙通道(voltage-gated calcium channels,VGCC)、配体门控钙通道(ligand-gated calcium channels,LGCC)、瞬时感受器电位(transient receptor potential,TRP)、钙库调控的钙通道[17](store-operated calcium channels,SOCs)和花生四烯酸调控的钙通道(arachidonate-regulated Ca2+entry channel,ARC)[18]等。细胞内Ca2+浓度的增加主要来源于细胞外Ca2+内流和细胞内钙源的释放。钙的内流和释放被细胞各种调控系统精密控制。在人类SPC-A1肺腺癌细胞株中,通过L型钙通道的钙内流被证实与内皮素-1(endothelin-1,ET-1)有关而促进肿瘤增殖[19]。在乳腺癌细胞株MCF-7中TRPM7基因沉默后,细胞内基础Ca2+浓度和细胞增殖减少,提示TRPM7可能通过调节Ca2+内流而参与乳腺癌细胞凋亡[20]。激素耐受且凋亡拮抗的前列腺癌细胞表型钙库操作性Ca2+通道(store-operated Ca2+entry,SOCE)水平明显降低[21],从而阻止促凋亡刺激引起的钙过载,降低了线粒体和细胞质的凋亡通路活性。钙通透性通道和钙依赖信号对肿瘤血管生成起重要作用[22]。可见,细胞内Ca2+变化不仅与凋亡相关,还与肿瘤的发生、发展密切相关。
本研究表明,蟾毒灵诱导人结肠癌HCT8细胞凋亡,可能与细胞内Ca2+代谢相关。Ca2+在体内代谢是一个较为复杂的过程。蟾毒灵诱导HCT8细胞凋亡与Ca2+代谢具体作用机制,关键的作用靶点,有待进一步研究。
[1] Siegel RL,Miller KD,Jemal A.Cancer Statistics,2016[J].CA Camcer J Clin,2016,66(1):7-30.
[2] 陈万青,张思维,曾红梅,等.中国2010年恶性肿瘤发病与死亡[J].中国肿瘤,2014,23(1):1-10.
[3] Deng S,Hu B,An HM,et al.Teng-Long-Bu-Zhong-Tang,a Chinese herbalformula,enhances anticancer effects of 5-Fluorouracil in CT26 colon carcinoma[J].BMC Complement Altern Med,2013,13(1):128.
[4] Wen XD,Wang CZ,Yu CH,et al.Salvia miltiorrhiza(Dan Shen)significantly ameliorates colon inflammation in dextran sulfate sodium induced colitis[J].Am J Chin Med,2013,41(5):1097-1098.
[5] Cai YC,Xia Q,Luo RZ,et al.Berberine inhibits the growth of human colorectal adenocarcinoma in vitro and in vivo[J].J Nat Med,2014,68(1):53-62.
[6] Qiu Y,Yu H,Shi X,et al.microRNA-497 inhibits invasion and metastasis of colorectal cancer cells by targeting vascular endothelial growth factor-A[J].Cell Prolif,2016,49(1):69-78.
[7] Qiu YY,Hu SJ,Bao YJ,etal.Anti-angiogenic and anti-proliferative effects of inhibition of HIF-1α by p-HIF-1α RNAi in colorectal cancer[J].Int J Clin Exp Pathol,2015,8(7):7913-7920.
[8] Qiu YY,Hu Q,Tang QF.MicroRNA-497 and bufalin act synergistically to inhibitcolorectalcancermetastasis[J]. Tumour Biol,2014,35(3):2599-2606.
[9] Wang Z,Zhang L,NiZ,etal.Resveratrolinduces AMPK-dependentMDR1 inhibition in colorectalcancer HCT116/L-OHP cells by preventing activationof NF-κB signaling and suppressing cAMP-responsive element transcriptional activity[J].Tumor Biol,2015,36(12):9499-9510.
[10] Hawk ET,Levin B.Colorectal cancer prevention[J].J Clin Oncol,2005,23(2):378-391.
[11] Tian X,Dai S,Sun J,et al.Bufalin induces mitochondriadependent apoptosis in pancreatic and oral cancer cells by downregulating hTERT expression via activation of the JNK/ p38 pathway[J].Evid Based Complement Alternat Med,2015,2015:546210.
[12] Wang J,Chen C,Wang S,et al.Bufalin inhibits HCT116 colon cancer cells and its orthotopic xenograft tumor in mice model through genes related to apoptotic and PTEN/AKT pathways[J]. Gastroenterol Res Pract,2015,2015(5):1-10.
[13] Chen Y,Li M,Li Z,et al.Bufalin induces apoptosis in the U-2OS human osteosarcoma cellline viatriggering the mitochondrial pathway[J].Mol Med Rep,2016,13(1):817-822.
[14] Liu F,Tong D,Li H,et al.Bufalin enhances antitumor effect of paclitaxel on cervical tumorigenesis via inhibiting the integrin α 2/β5/FAK signaling pathway[J].Oncotarget,2016,7(8):8896-8907.
[15] Wang Q,Li C,Zhu Z,et al.miR-155-5p antagonizes the apoptotic effect of bufalin in triple-negative breast cancer cells [J].Anticancer Drugs,2016,27(1):9-16.
[16] McCalmont WF,Heady TN,Patterson JR,et al.Design,synthesis,and biological evaluation of novel T-Type calcium channel antagonists[J].Bioorg Med Chem Lett,2004,14(14):3691-3695.
[17] Che Y,Potocnik S,Li CG,et al.Pharmacological and molecular biological characteristics of store-operated calcium channels[J].Chin Pharmacol Bull,2002,18(4):365-369.
[18] Mignen O,Shuttleworth TJ.I(ARC),a novel arachidonateregulated,noncapacitative Ca(2+)entry channel[J].J Biol Chem,2000,275(13):9114-9119.
[19] Zhang WM,Zhou J,Ye QJ.Endothelin-1 enhances proliferation of lung cancer cells by increasing intracellular free Ca2+[J].Life Sci,2008,82(13-14):764-771.
[20] Guilbert A,Gautier M,Dhennin-Duthille I,et al.Evidence that TRPM7 is required for breast cancer cell proliferation[J].Am J Physiol Cell Physiol,2009,297(3):C493-C502.
[21] Prevarskaya N,Skryma R,ShubaY.Ca2+homeostasis in apoptotic resistance of prostate cancer cells[J].Biochem Biophys Res Commun,2004,322(4):1326-1335.
[22] Munaron L.Intracellularcalcium,endothelialcells and angiogenesis[J].Recent Pat Anticancer Drug Discov,2006,1(1):105-109.
Preliminary study of effects of bufalin on apoptosis and calcium metabolism in human colorectal cancer HCT8 cells
SHI Xiaojing,SUN Jianyue,QIU Yanyan,ZOU Yu,YUAN Yuxia,HE Xue,ZHANG Yixi,TANG Xueyao,YIN Peihao
Putuo Hospital,Shanghai University of Traditional Chinese Medicine,Shanghai 200062,China
ObjectiveTo investigate the effects and mechanism of bufalin on apoptosis and calcium metabolism in human colorectal cancer HCT8 cells.MethodsCCK-8 method and Annexin V/PI double staining were used to detect the effects of bufalin on proliferation and apoptosis of human colorectal cancer HCT8 cells,respectively.Ca2+fluorescence probe Fluo-3 AM marker was adopted to investigate the effects of bufalin on intracellular Ca2+of HCT8 cells.ResultsBufalin inhibited the proliferation of HCT8 cells in dose-and time-dependent manners,and induced the apoptosis of HCT8 cells in a dose-dependent manner.A higher concentration of intracellular Ca2+was observed when cells were treated by a higher concentration of bufalin.ConclusionBufalin can induce apoptosis of human colorectal cancer HCT8 cells,and its mechanism may be related to the metabolism of intracellular Ca2+.
Colorectal cancer;Bufalin;Apoptosis;Ca2+
R735.3
A
2095-378X(2016)04-0225-04
10.3969/j.issn.2095-378X.2016.04.001
2016-09-30)
国家自然科学基金(81473482,81603464);国家中医药管理局“十二五”中医药重点学科(中西医结合临床);上海市科委2016年度医学引导类(中、西医)科技支撑项目(16411972600)
石晓静(1990—),女,住院医师,硕士,从事中西医结合防治胃肠肿瘤的临床研究
殷佩浩,电子信箱:yinpeihao1975@hotmail.com
