氨氯地平对大鼠动脉粥样斑块稳定性和MMP-9及其抑制物表达的影响
2016-03-06孙劼冯力董剑廷邓志华李飞
孙劼,冯力,董剑廷,邓志华,李飞
(中山市人民医院心血管内科,广东 中山 528400)
氨氯地平对大鼠动脉粥样斑块稳定性和MMP-9及其抑制物表达的影响
孙劼,冯力,董剑廷,邓志华,李飞
(中山市人民医院心血管内科,广东 中山 528400)
目的 探讨氨氯地平对大鼠动脉粥样斑块稳定性和基质金属蛋白酶9(MMP-9)及其抑制物表达的影响。方法以18只雄性Wistar大鼠构建动脉粥样硬化模型,采用随机数字表法将18只雄性Wistar大鼠分为氨氯地平组和模型组,每组9只。模型组采取单纯高脂饲料喂养,氨氯地平组每日在高脂饮食基础上给予苯磺酸氯氨地平6 mg/(kg·d)灌胃。连续饲养3个月后采血检测血清总胆固醇(TC)、三酰甘油(TG);免疫组织化学SABC法进行MMP-9及基质金属蛋白酶组织抑制剂(TIMP-1)表达检测,同时计数血管平滑肌细胞(VSMC)和巨噬细胞占总细胞的百分比。结果氨氯地平组大鼠TC和TG水平分别为(1.63±0.74)mmol/L和(0.81±0.21)mmol/L,明显低于模型组的(3.08±0.67)mmol/L和(1.35±0.34)mmol/L,差异均有统计学意义(P<0.05);氨氯地平组MMP-9表达水平为(266.53±32.15)µm2,明显低于模型组的(351.02±45.69)µm2,TIMP-1表达水平为(305.64±36.22)µm2,明显高于模型组的(230.36±25.11)µm2,差异均有统计学意义(P<0.05);氨氯地平组血管平滑肌细胞[(88.12±3.58)%vs(100.00±0.00)%]和巨噬细胞[(90.35±5.33)%vs(100.00±0.00)%]占总细胞的百分比均显著低于模型组(P<0.05)。结论氨氯地平可抑制MMP-9的表达,进而起到稳定动脉粥样硬化板块、降低血脂的作用。
Wistar大鼠;动脉粥样斑块;氨氯地平;基质金属蛋白酶9;基质金属蛋白酶组织抑制剂1;血脂
动脉粥样硬化(Atherosclerosis,AS)斑块破裂继发血栓形成是临床急性冠状动脉综合征(Acute coronary syndrome,ACS)公认的主要原因[1]。不稳定斑块是指易于形成血栓,其通过形成持续的或瞬时性的管腔闭塞进而导致急性冠状动脉综合征发生[2-3]。因此,采取措施增强斑块稳定性将对急性冠状动脉综合征的防治有着重要的意义。既往研究显示,长期应用钙拮抗剂氨氯地平治疗原发性高血压合并颈动脉粥样硬化斑块,在有效控制血压的同时可逆转动脉粥样硬化[4]。目前国内针对氨氯地平对动脉粥样斑块稳定性的基础研究还十分有限,其机制并未明确。本文大胆猜测氨氯地平对大鼠动脉粥样斑块稳定性产生影响可能与基质金属蛋白酶(Matrx metallop roteinases,MMPs)及其抑制物表达相关。本文以雄性Wistar大鼠构建动脉粥样硬化模型,探讨氨氯地平对大鼠动脉粥样斑块稳定性和MMP-9及其抑制物TIMP-1表达的影响。
1 材料与方法
1.1 实验动物与分组 18只健康雄性Wistar大鼠购自中山大学实验动物中心(动物生产许可证号SCXK(粤)2015-0025),体质量310~350 g。18只健康雄性Wistar大鼠随机分为氨氯地平组和模型组,每组9只。
1.2 主要仪器与试剂 苯磺酸氯氨地平(昆明金殿制药有限公司);DAB显色试剂盒(北京中山生物技术有限公司);羊抗鼠MMP-9抗体(Bioworld公司);其他试剂均为国产分析纯剂试剂;离心管(美国Corning公司);超净工作台(AIRTECH,苏净集团安泰公司);台式低温高速冷冻离心机(3K3,Sigma,美国);紫外可见分光光度计(Perlcin-Elmer USA)。
1.3 模型制备 实验开始前3 d,予以基础饲料喂养。试验过程中予以高脂饲料(2%胆固醇,0.5%胆酸钠,5%白糖,10%猪油,82.5%基础饲料),喂食为2次/d、20~40 g·只-1·d-1。模型组采取单纯高脂饲料喂养,氨氯地平组每日在高脂饮食基础上给予苯磺酸氯氨地平6 mg/(kg·d)灌胃。于第4周处死模型组和氨氯地平组各一只,取主动脉弓远端主动脉5 mm,病理切片,HE染色进行病理学观察,证实AS斑块形成,说明造模成功。
1.4 检测指标 连续饲养3个月后采血检测血清总胆固醇(TC)、三酰甘油(TG)。之后处死动物,首先取主动脉根部作为切片标本,中性甲醛固定,逐级乙醇脱水,二甲苯透明,石蜡包埋,横断切片,免疫组织化学SABC法进行MMP-9及TIMP-1表达的免疫组化染色检测,同时计数每一高倍镜视野下血管平滑肌细胞(VSMC)和巨噬细胞占总细胞的百分比。
1.5 结果判断 MMP-9及TIMP-1阳性表达为棕黄色,采用HMIAS-200彩色医学图文分析系统进行阳性表达面积计算,每张切片选取9个视野,取每个视野的阳性面积的平均值。CD68和a-SMA分别显色于巨睡细胞的胞膜和VSMCs的胞质,计数每张切片400倍高倍视野下动脉内膜下或粥样斑块内巨嚼细胞数和平滑肌细胞数占所有细胞数的比例。
1.6 统计学方法 应用SPSS13.0统计软件进行数据分析,计量数据以均数±标准差(±s)表示,组间比较采用t检验,以P<0.05表示差异有统计学意义。
2 结 果
2.1 两组大鼠的TC和TG比较 氨氯地平组大鼠TC和TG水平均明显低于模型组,差异均有统计学意义(P<0.05),见表1。
表1 两组大鼠的TC和TG水平比较(±s)
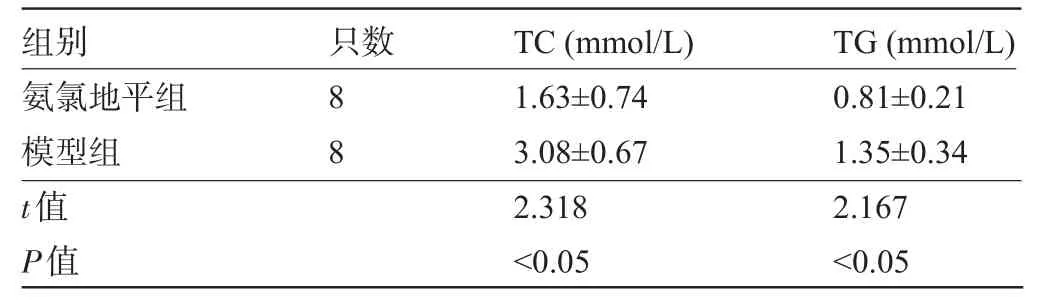
表1 两组大鼠的TC和TG水平比较(±s)
只数组别TC(mmol/L)TG(mmol/L) 8 8氨氯地平组模型组t值P值1.63±0.74 3.08±0.67 2.318<0.05 0.81±0.21 1.35±0.34 2.167<0.05
2.2 两组大鼠的MMP-9及TIMP-1表达水平比较 氨氯地平组大鼠的MMP-9表达水平明显低于模型组,TIMP-1表达水平明显高于模型组,差异均有统计学意义(P<0.05),见表2。
表2 两组大鼠的MMP-9及TIMP-1表达水平比较(±s)

表2 两组大鼠的MMP-9及TIMP-1表达水平比较(±s)
只数组别MMP-9(µm2)TIMP-1(µm2)氨氯地平组模型组t值P值8 8 266.53±32.15 351.02±45.69 2.366<0.05 305.64±36.22 230.36±25.11 2.343<0.05
2.3 两组大鼠的血管平滑肌细胞和巨噬细胞比较 氨氯地平组大鼠的血管平滑肌细胞和巨噬细胞占总细胞的百分比均明显低于模型组,差异均有统计学意义(P<0.05),见表3。
表3 两组大鼠的血管平滑肌细胞和巨噬细胞比较(±s)

表3 两组大鼠的血管平滑肌细胞和巨噬细胞比较(±s)
组别 只数 血管平滑肌细胞(%)巨噬细胞(%)氨氯地平组模型组t值P值8 8 88.12±3.58 100.00±0.00 2.159<0.05 90.35±5.33 100.00±0.00 2.235<0.05
3 讨论
动脉粥样硬化的形成为一个复杂的过程,涉及脂质代谢紊乱、内皮的损伤、单核细胞和血小板集聚等。此外,细胞外基质合成或降解代谢失衡等也参与了该过程,导致血管平滑肌细胞迁移和增殖,形成粥样斑块[5-6]。《中国高血压防治指南2010》明确推荐使用长效降压药,要长期平稳有效控制高血压。氨氯地平属于长效二氢吡啶类的钙离子拮抗剂降压药,每天使用1次可平稳控制高血压患者的血压水平[7]。氨氯地平主要通过阻断钙离子通道阻断钙离子进入心血管平滑肌细胞,舒张血管平滑肌,达到降低血压的目的。
近年来,氨氯地平延缓AS早期斑块的形成的作用受到广泛关注,如其对颈动脉内膜-中膜厚度的逆转作用[8]。本组数据显示,氨氯地平组大鼠TC和TG水平显著低于模型组,差异有统计学意义(P<0.05),表明氨氯地平具有良好的降脂效果。由于TC和TG水平升高受到限制,其沉积于血管内皮下的量降低,从而延缓了斑块核心的扩大,有利于动脉粥样硬化斑块的稳定。郝炎[9]对比分析了直接肾素抑制剂与钙通道阻滞剂对肾动脉狭窄性大鼠大动脉斑块稳定性的影响,发现阿利吉仑和氨氯地平均具有显著的降压降脂作用,有利于动脉粥样硬化斑块的稳定,与本文报道一致。
本组数据显示,氨氯地平组血管平滑肌细胞和巨噬细胞占总细胞的百分比均显著低于模型组,差异有统计学意义(P<0.05)。血管平滑肌细胞是血管壁的重要构成成分,高血压、高血脂可导致群殴从收缩型转化为合成型,从而获得增殖、迁移的能力,在动脉粥样硬化斑块的形成过程中具有重要作用。巨噬细胞是泡沫细胞的主要来源,其基质金属蛋白酶可降解细胞外基质,促进平滑肌细胞的增殖和迁移,促进粥样斑块进展[10]。因此,笔者推测氨氯地平可能降低了血管平滑肌细胞和巨噬细胞水平水平,从而延缓动脉粥样硬化斑块的形成过程。
MMP-9是MMPs家族中的一个亚型,具有降解细胞外基质和基底膜的主要结构蛋白-Ⅳ型胶原和层粘连蛋白的作用,在维持血管的稳定性和完整性上具有十分重要的作用。TIMP-1由巨噬细胞和结缔组织细胞产生,具有抑制MMP-9的作用。本文发现,氨氯地平组MMP-9表达水平显著低于模型组,差异有统计学意义(P<0.05),TIMP-1表达水平显著高于模型组(P<0.05),提示氨氯地平可能通过抑制MMP-9的表达起到稳定动脉粥样硬化斑块的作用。
综上所述,氨氯地平可抑制MMP-9的表达,进而起到稳定动脉粥样硬化板块和降低血脂的作用。
[1]陈线茹.不同手性结构氨氯地平对高脂诱导家兔血清MMP-3, MMP-9及CRP的影响[D].石家庄:河北医科大学,2013.
[2]Scoditti E,Calabriso N,Massaro M,et al.Mediterranean diet polyphenols reduce inflammatory angiogenesis through MMP-9 and COX-2 inhibition in human vascular endothelial cells:a potentially protective mechanism in atherosclerotic vascular disease and cancer[J].Archives of Biochemistry and Biophysics,2012,527(2): 81-89.
[3]Yuan M,Zhan Q,Duan X,et al.A functional polymorphism at miR-491-5p binding site in the 3′-UTR of MMP-9 gene confers increased risk for atherosclerotic cerebral infarction in a Chinese population[J].Atherosclerosis,2013,226(2):447-452.
[4]Wågsäter D,Zhu C,Björkegren J,et al.MMP-2 and MM-9 are prominent matrix metalloproteinases during atherosclerosis development in the Ldlr-/-Apob100/100 mouse[J].International Journal of Molecular Medicine,2011,28(2):247-253.
[5]黄威,董超.血府逐瘀汤对动脉粥样硬化大鼠MMP-9及TIMP-1的影响[J].医学研究与教育,2013,30(5):8-12.
[6]Silvello D,Narvaes L B,Albuquerque L C,et al.Serum levels and polymorphisms of matrix metalloproteinases(MMPs)in carotid artery atherosclerosis:higher MMP-9 levels are associated with plaque vulnerability[J].Biomarkers,2014,19(1):49-55.
[7]于连英.联合马来酸左旋氨氯地平与福辛普利片对原发性高血压患者的疗效观察[J].中国老年保健医学,2014,12(6):49-50.
[8]Johnson JL,Dwivedi A,Somerville M,et al.Matrix metalloproteinase(MMP)-3 activates MMP-9 mediated vascular smooth muscle cell migration and neointima formation in mice[J].Arteriosclerosis, Thrombosis,and Vascular Biology,2011,31(9):e35-e44.
[9]郝炎.直接肾素抑制剂与钙通道阻滞剂对肾动脉狭窄性大鼠大动脉斑块稳定性的比较研究[D].泸州:泸州医学院,2011.
[10]李代欣.动脉粥样硬化斑块中巨噬细胞和平滑肌细胞分布的实验研究[D].扬州:扬州大学,2013.
Effect of amlodipine on the stability of atherosclerosis plague and the expression of MMP-9 and its inhibitor in mice.
SUN Jie,FENG Li,DONG Jian-ting,DENG Zhi-hua,LI Fei.Internal Medicine-Cardiovascular Department,the People's Hospital of Zhongshan City,Zhongshan 528400,Guangdong,CHINA
ObjectiveTo investigate the effect of amlodipine on the stability of atherosclerosis plague,and the expression of matrix metallopeptidase 9(MMP-9)and its inhibitor in mice.MethodsThe atherosclerosis model was built with 18 male Wistar rats,which were randomly divided into amlodipine group and model group,with 9 rats in each group. Rats in the model group was fed with high-fat diet,and those in amlodipine group were given gavage with 6 mg/(kg·d)amlodipine besylate on the basis of high-fat diet.Serum total cholesterol(TC),triglyceride(TG)were detected after continuous feeding for three months.MMP-9 and tissue inhibitor of metalloproteinase-1(TIMP-1)expression was detected by immunohistochemistry SABC method,and the percentage of vascular smooth muscle cells(VSMC)and macrophages in total cells were calculated.ResultsTC,TG levels in amlodipine group were significantly lower than those in model group[(1.63±0.74)mmol/L vs(3.08±0.67)mmol/L,(0.81±0.21)mmol/L vs(1.35±0.34)mmol/L,P<0.05].The expression level of MMP-9 in amlodipine group was significantly lower than that in model group[(266.53±32.15)µm2vs (351.02±45.69)µm2,P<0.05],and the expression level of TIMP-1 in amlodipine group was significantly higher [(305.64±36.22)µm2vs(230.36±25.11)µm2,P<0.05].The percentage of VSMC in total cells and the percentage of macrophages in total cells in amlodipine group were significantly lower than those in model group[(88.12±3.58)%vs (100.00±0.00)%,(90.35±5.33)%vs(100.00±0.00)%,P<0.05].ConclusionAmlodipine can inhibit the expression of MMP-9,and thus play a stabilizing role in the atherosclerosis plate,which can also help reduce blood lipids.
Wistar rats;Atherosclerotic plaque;Amlodipine;Matrix metallopeptidase 9(MMP-9);Tissue inhibitor of metalloproteinase-1(TIMP-1);Blood fat
R-332
A
1003—6350(2016)06—0867—03
10.3969/j.issn.1003-6350.2016.06.003
2015-11-16)
广东省中山市科技计划项目(编号:20091A088)
孙劼。E-mail:sj99363@126.com
