5种江西特色盆景植物根际微生物群落特征比较研究
2016-03-04毛坤财邹贵武邓光华
毛坤财,邹贵武,邓光华,刘 玮
(1.江西农业大学 园林与艺术学院,南昌,330045;2.江西省林业干部培训中心,南昌,330045)
5种江西特色盆景植物根际微生物群落特征比较研究
毛坤财1,2,邹贵武1,邓光华1,刘玮*
(1.江西农业大学 园林与艺术学院,南昌,330045;2.江西省林业干部培训中心,南昌,330045)
摘要:应用聚合酶链式反应-变性梯度凝胶电泳(PCR-DGGE)方法对三叶赤楠、火棘、三角枫、鸡爪槭和金边瑞香这5种江西特色盆景树种根际微生物特征进行了比较研究。结果表明:PCR-DGGE对于盆景树种根际微生物特征响应良好,DGGE图谱可以明显反映出5种盆景树种根际微生物的差异。不同树种根际微生物特征有很大区别,鸡爪槭、三角枫根际微生物多样性指数最高,为3.121和2.876,并且根际微生物群落相似程度很高;而火棘根际微生物多样性指数最低,为1.038。这种根际微生物群落的差异可能是由不同盆景植物的根系分泌物差异所造成的,鸡爪槭、三角枫根际微生物群落相似可能是由于其系统发育地位较近(槭树科槭属)所造成的。而火棘(蔷薇科)根际微生物多样性较低可能是由于蔷薇科植物根系分泌物富含三萜酸类物质,对微生物具有抑制作用的原因。
关键词:盆景树种;根际微生物多样性;PCR-DGGE分析
引文格式:毛坤财,邹贵武,邓光华,等.5种江西特色盆景植物根际微生物群落特征比较研究[J].森林工程,2016,32(1):33-36.
0引言
盆景是以植物、山石等材料,经过艺术创作和园艺栽培,将自然界的优美景色集中、典型地在盆中进行塑造,是我国优秀的传统艺术之一[1]。目前对于盆景植物的研究多集中于栽培、造型和风格鉴赏等领域[2-3],而关于盆景植物根际微生物生态学的研究只有少数报道[4]。由于根际微生物在地上植物生长、养分吸收及抗性形成方面起着重要的反馈调控作用,因此研究盆景植物根际微生物的群落特征及变化趋势对于提高盆景养护水平,促进这一古老艺术形式的继承发展有着现实的意义。传统根际微生物学研究主要采用平板涂布、氯仿熏蒸等方法来测定土壤微生物生物量、基础呼吸和可培养微生物区系等[5-6],而这些方法只能提供部分根际微生物功能、群落等信息,具有一定的局限性。近年来分子生物学技术的广泛发展、应用,为根际微生物的研究提供了更为便利和清晰的方法手段。聚合酶链式反应-变性梯度凝胶电泳(Polymerase Chain Reaction-Denaturing gradient gel electrophoresis,PCR-DGGE)技术是基于核糖体DNA的保守序列设计出不同微生物类群的特异性引物,并通过相关的分子生物学测定技术研究其群落特征[7-8]。本研究采用PCR-DGGE方法,对五种江西常见盆景植物:三叶赤楠(Syzygiumgrijsii,桃金娘科蒲桃属,后文简写为Sg)、火棘(Pyracanthafortuneana,蔷薇科火棘属,Pf)、三角枫(Acerbuergerianum,槭树科槭属,Ab)、鸡爪槭(Acerpalmatum,槭树科槭属,Ap)、金边瑞香(Daphneodora,瑞香科Thymelaeaceae瑞香属DaphneLinn.植物,Do)的根际微生物特征进行研究,这5种植物在生长习性,根系结构及根系分泌物组成方面均有很大的区别。观察盆栽条件下这几种江西特色盆景树种根际微生物的差异与变化,希望能从根际微生物调控方面找到一些改善盆景树种生长、提高观赏价值的新途径。
1材料与方法
1.1样品采集与处理
供试植物为江西农业大学花卉盆景教学基地栽培的三叶赤楠、火棘、鸡爪槭、三角枫和金边瑞香盆桩,树龄30~50a不等,但上盆栽培时间均为5a,且每树种所取个体树龄相仿。各品种盆桩管理方式一致,施用肥料以充分发酵的饼肥为主,施用量一致。
按照刘玮等[4]的方法,每树种取三株个体的根际土壤混合,拣去植物残体,在田间含水量条件下过2mm筛,在-20℃条件下冷冻保存,以备后续DNA提取及相关分子生物学分析使用。
1.2土壤DNA提取及PCR扩增
盆景植物由于其养护方式,土壤多呈褐色及棕色,腐殖质类物质含量较高,而土壤中较多的腐殖质对于后续的PCR反应具有抑制作用,因此本试验土壤样品在提取DNA前要先进行脱腐洗涤[4],洗涤后的土壤样品DNA采用FastDNA Spin Kit for Soil(Bio 101,Carlsbad,CA,USA)试剂盒按照说明书从0.5 g土壤样品中进行提取。提取后的土壤DNA采用NanoDrop ND-8000(NanoDrop,Wilmington,USA)微量分光光度计进行浓度及质量测定。在本试验中,采用细菌特异性引物GC-338F和518R进行PCR扩增[9],目标DNA片段长度约为340 bp。PCR反应体系及条件按照刘有胜等[10]以及刘玮等[4]的方法并加以改进。PCR反应产物用1 % 琼脂糖凝胶电泳进行检测,检测后具有明显目标条带的PCR产物用QIAquick PCR产物纯化试剂盒(TIANGEN,Beijing,China)纯化后保存于-20℃待用。
1.3聚合酶链式反应-变性梯度凝胶电泳分析(PCR-DGGE)
采用美国伯乐(Bio-Rad)公司的DcodeTM的基因突变检测系统对不同盆景植物根际土壤PCR反应产物在1×TAE的电泳缓冲液中进行电泳分离,凝胶变性梯度为30%~65%,电泳温度为60℃,电压130 V电泳时间12 h。电泳结束后用SYBR GreenⅠ核酸染料染色30 min,在清水中退染20 min,然后用Bio-Rad Gel Doc2000凝胶成像系统观察结果并拍照。采用Quantity One 2.0(Bio-rad,USA)软件对根际土壤微生物群落的PCR-DGGE图谱进行分析,在去除背景噪音后检测不同样品电泳条带的数量和亮度峰值,通过图像分析软件分析凝胶图像数字化后16S rRNA基因的指纹图谱。
1.4数据分析及统计
本研究中,根际土壤细菌群落的物种丰富度(S)、Shannon-Weiner多样性指数(H′)以及均匀度指数(E)用来表征样品中细菌类群的多样性状况[11]。物种丰富度S以DGGE谱图中有效条带的数量(经过校正),均匀度指数E表征不同样品根际土壤群落中条带的均匀度情况,即各细菌类群之间的分配情况。
排序分析及假设检验都用CANOCO for windows v.4.5软件完成[12],数据在进行PCA分析时没有进行转换。
2试验结果
2.1不同盆景植物根际微生物群落PCR-DGGE分析结果
经过脱腐洗涤后,减少了胞外DNA和腐殖质类物质的污染与干扰,土壤DNA的提取效果较好,所提取的土壤DNA条带明亮、清晰,经纯化后可直接用于PCR扩增。PCR扩增产物片段长度约为340 bp,无引物二聚体和非特异性扩增。变性梯度凝胶电泳图谱分析表明,PCR-DGGE方法对于盆景树种的根际细菌类群具有很高的分辨率,不同盆景树种根际土壤DNA样品经DGGE电泳后分离出不同数量、强度和位置的条带,代表着具有不同16S rDNA序列解链特性的细菌类群[13],条带越多证明细菌类群越多。经过变性梯度凝胶电泳,鸡爪槭样品分离出的条带数最多,为26条;其次是三角枫和金边瑞香,为19条;火棘样品和三叶赤楠样品的条带数较少,只有3条和5条。不同盆景植物样品根际土壤DNA的电泳条带强度及迁移率也存在一定程度差异,表明树种差异是造成盆景植物根际细菌群落种群变化的主要原因。
主成分分析(Principal Component Analysis,PCA)被用来描述不同盆景植物土壤样品中细菌类群的分布特征(如图1所示),PCA分析结果表明盆景植物种类对土壤细菌群落具有显著的影响,不同盆景植物根际土壤细菌群落出现了明显的位置分化,在横轴上主要是由槭属的鸡爪槭、三角枫和桃金娘科的三叶赤楠、蔷薇科的火棘根际微生物差异所导致,而在纵轴上的差异则主要由瑞香科的金边瑞香构成:在三叶赤楠(Sg)和火棘(Pf)周围土壤细菌条带很少,说明这些植物根际土壤中微生物的类群相对较少;鸡爪槭(Ap)和三角枫(Ab)距离相对较近,在它们周围的条带也相近,如6、7、8、9、11、13、15、16、21、25、29、30,说明这两种盆景植物的根际微生物类群组成较为接近,相同的微生物类群较多。金边瑞香(Do)的根际土壤微生物类群与其他盆景植有很大区别。说明不同盆景植物根际微生物组成有很大的差异,基本可以分为三部分,其中Ap和Ab根际微生物类群组成较为相近,Sg和Pf根际微生物类群很少,而Do的组成与这两部分也有很大差异。
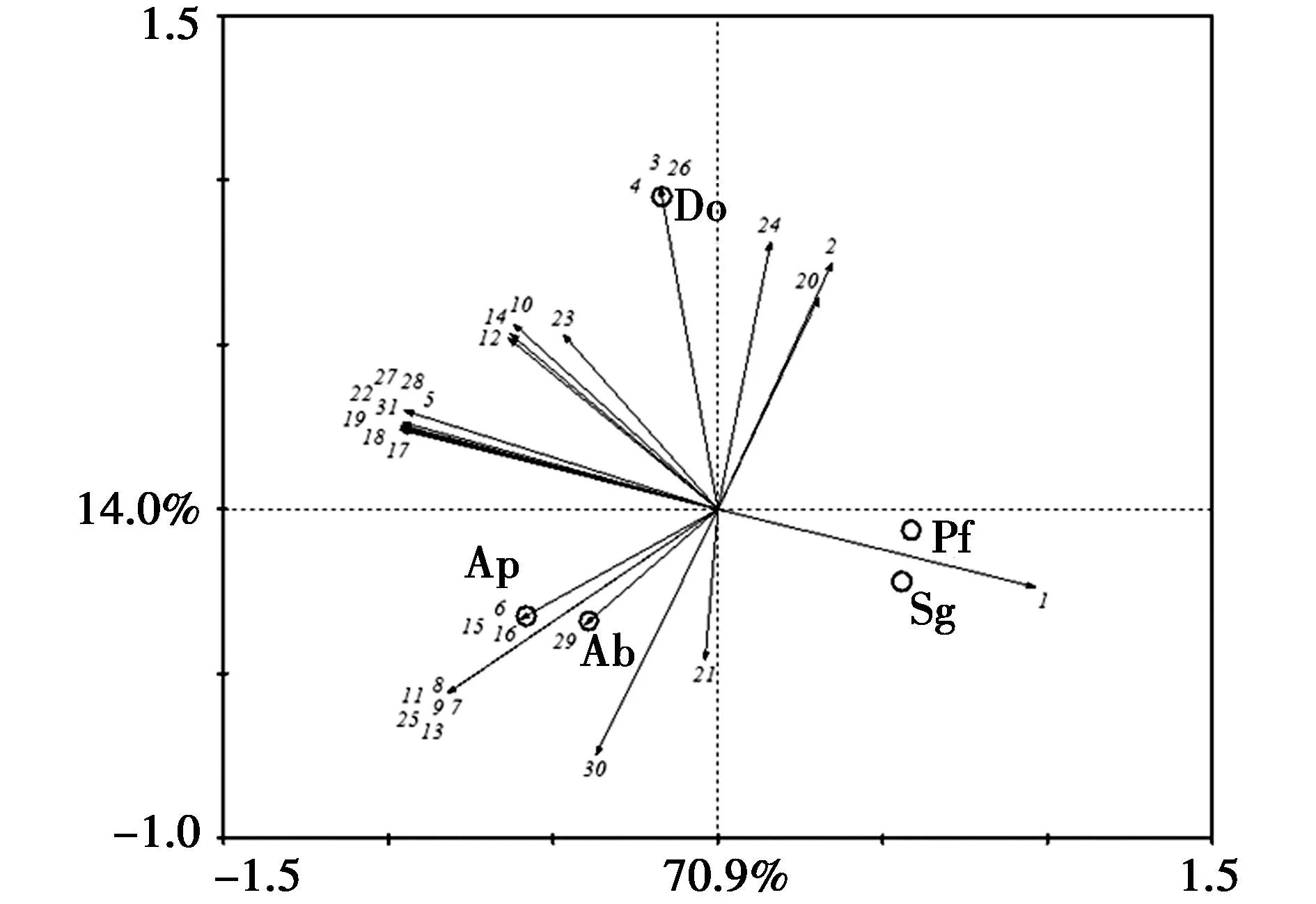
图1 微生物群落遗传多样性的主成分分析(Sg-三叶赤楠;Pf-火棘;Ab-三角枫;Ap-鸡爪槭;Do-金边瑞香);图中数字代表不同的微生物类群(不同条带类型)。Fig.1 PCA analysis of soil microbial communities(Sg-Syzygium grijsii;Pf-Pyracantha fortuneana;Ab-Acerbuergerianum;Ap-Acer palmatum;Do-Daphne odora);different microorganisms groups representby banding type were showed by numbers in figure.
2.2盆景植物对根际土壤微生物群落丰富度及多样性特征影响
盆景植物种类对根际土壤细菌群落多样性特征的影响不同(见表1):不同盆景植物根际土壤细菌群落的丰富度及多样性特征发生了明显变化,鸡爪槭(Ap)的物种丰富度及多样性指数最高,分别为26和3.121;三角枫(Ab)和金边瑞香(Do)的物种丰富度及多样性指数数值接近次之,分别为19(Ab)、19(Do)和2.876(Ab)、2.873(Do);火棘(Pf)的物种丰富度和多样性指数最低,只有3和1.038。
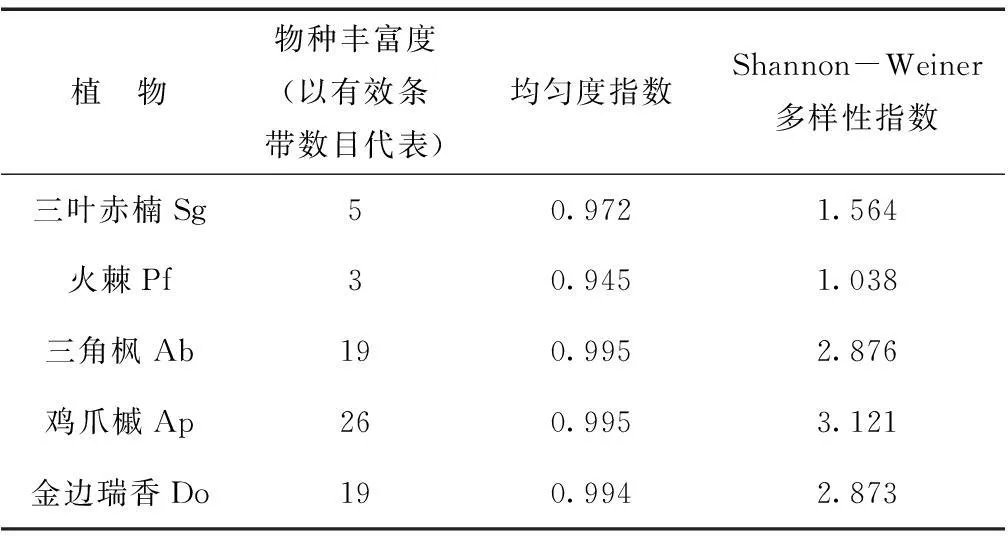
表1 不同盆景植物根际土壤细菌群落多样性特征
3讨论
以往对于盆景植物的研究多着重于造型修剪以及栽培技术,关于栽培生理方面的研究极少,而对于盆景植物根际微生态的研究几乎没有。根际微生物是植物-土壤微生态系统的重要组成部分,在植物养分循环过程中起着重要的作用[14-15]。因此通过根际微生物的研究可以了解盆景植物-土壤微生态系统的协同关系,为盆景植物的高效培育提供依据[16]。
物种多样性是指群落中物种数目的多少,它是衡量群落规模和重要性的基础。种类越多,各种个体数量分布越均匀,物种多样性指数越大。在DGGE图谱中,每一个DGGE条带代表的并不是一种微生物,而是一类微生物[17]。本研究被分离的每一个条带代表样品微生物群落中的一个细菌类群,条带的深浅则代表了这种细菌类群的多少和丰富程度[18]。不同植物类型对于根际微生物类群影响也不相同,鸡爪槭的多样性指数最高,为3.121;三角枫和金边瑞香次之,为2.876和2.873;火棘的多样性指数最低,只有1.038(表1)。鸡爪槭样品条带数最多,为26条;其次是三角枫和金边瑞香,为19条;火棘样品的条带数最少,为3条。供试样品间具有许多共同的条带,说明不同植物间存在一些共有的微生物类型。这些公共条带的强度也各不相同,表明不同植物间相同微生物类群在数量水平上也有区别。不同盆景植物的根际微生物类群及数量不同,有可能是受植物凋落物分解及植物根际分泌物的影响。在之前的一些研究中发现在盆栽试验中混入土壤的凋落物对于根际微生物的群落结构产生了显著影响[19]。但是由于盆景植物的特殊养护手段,凋落物几乎不会在土表存留,因此对盆景植物根际微生物群落来说,根系分泌物的种类和数量可能影响更大,并可能对根际微生物的生长繁殖及代谢过程产生影响[219。例如有研究表明茄科植物番茄的根际分泌物对丛枝菌根真菌Gigasporagigantean和Gigasporaintraradices的菌丝生长有很大的影响[20]。根系分泌物不但对微生物的生物量产生积极作用,并且对微生物群落的构成产生重要影响。例如随着小麦(Triticumaestivum)生长过程中根系分泌物的增加,根际环境中反硝化细菌的数量明显增加[21],另外小麦根系分泌物中的酚酸还具有抗菌性,对于根际微生物还具有一定的筛选作用[22]。
根际微生物群落物种丰富度及多样性指数最高的鸡爪槭(Ap,26和3.121)、三角枫(Ab,19和2.876)都是槭树科槭属植物,而最少的火棘(Pf,3和1.038)是蔷薇科火棘属植物,因此不同植物种属间根系分泌物的差异可能是造成根际微生物群落差异的原因,相近种属植物间根际微生物相似性较高。有研究对蔷薇科4种灌木:Adenostomcisparsifolium(下文简称As)、Cowaniamexicanavar.glaber(Com)、Cercocarpusmontanusvar.glaber(Cem)、Fallugiaparadoxa(Fp)的根系分泌物进行研究发现它们共同的主要分泌物为三萜酸类而它们之间又各自有一些差异:其中As和Com的分泌物主要为黄酮苷,As还分泌齐墩果酸;Cem和Fp的分泌物主要为类黄酮化合物[23]。有研究表明冬青科植物细叶冬青(Ilexintegra)中的三萜酸类化合物对细菌和真菌具有抑制作用[24]。火棘的根际微生物的生物类群少的特性可能和三萜酸的分布有关。鸡爪槭和三角枫为亲缘关系较近的树种,它们之间的根际分泌物在某种程度上,具有一定的相似性,这也导致二者之间的根际微生物相度较高。
根际微生物群落的动态变化也对根际生态系统的物质循环和能量流动产生着反馈作用,从而影响植物的生长发育及植被多样性变化[25]。不同的盆景树种,其地上的生长和地下微生物之间存在着不同的互动规律,有研究表明三叶赤楠随着栽培时间的增加,土壤微生物多样性增加,在第4年时其地下微生物多样性最高,在第8年时又有所降低,这就能为三叶赤楠养护期间的换盆时间提供更多的依据[4]。更多的盆景植物的地上部分和地下微生物之间互动的关系和规律还有待进一步的探索。如果能够充分了解其规律,且对盆景植物的栽培管理时能把其地下微生物的情况纳入到考虑的因素之中,则能够使植物的生长更加健壮,使其观赏效果大大提高,达到事半功倍的效果。
【参考文献】
[1]贾祥云,李峰,贾曼.中国盆景起源研究--中国盆景艺术形成于魏晋南北朝[J].中国园林,2004(7):51-53.
[2]胡挺进,彭春生.盆景风格因子初探[J].北京林业大学学报(社会科学版),2003,2(3):54-57.
[3]范鹤鸣.桂花盆景不开花或开花少的原因及对策[J].花木盆景(花卉园艺),2014(8):42-44.
[4]刘玮,张嘉超,邓光华.不同栽培时间三叶赤楠根际微生物多样性及其PCR-DGGE分析[J].植物研究,2010,30(5):582-587.
[5]Brookes P C,McGroth S P.Effects of metal toxicity on the size of soil microbial biomass[J].Journal of Soil Science,1984,35:341-346.
[6]Faam D L,Whipps J M,Lynch J M.The use of colony development for the characterization of bacterial communities in soil and on roots[J].Microbial Ecology,1993,27:81-97.
[7]Muyzer G.DGGE/TGGE:a method for identifying genes from natural ecosystems[J].Current Opinion in Microbiology,1999,2:317-322.
[8]Tian H,Drijber R A,Zhang J L,et al.Impact of long-term nitrogen fertilization and rotation with soybean on the diversity and phosphorus metabolism of indigenous arbuscular mycorrhizal fungi within the roots of maize(Zea mays L)[J].Agriculture Ecosystems & Environment,2013,164:53-61.
[9]Li A J,Yang S F,Li X Y,et al.Microbial population dynamics during aerobic sludge granulation at different organic loading rates[J].Water Research,2008,42:3552-3560.
[10]刘有胜,杨朝晖,曾光明,等.PCR-DGGE技术对城市餐厨垃圾堆肥中细菌种群结构分析[J].环境科学学报,2007,27(7):1-6.
[11]Magurran A E.Ecological Diversity and its Measurement[M].Princeton:Princeton University Press,1988.
[12]Braak C J,Smilauer P.CANOCO Reference Manual and CanoDraw for Windows user’s guide:software for canonical community ordination(version 4.5)[M].Biometris,Wageningen,2002.
[13]Konstantinov S R,Zhu W Y,Williams B A,et al.Effects of fermentable carbohydrates on piglet facial bacterial communities as revealed by 16S ribosomal DNA[J].Fems Microbiology Ecology,2003,43:225-235.
[14]周丽霞,丁明懋.土壤微生物学特性对土壤健康的指示作用[J].生物多样性,2007,15:162-171.
[15]Miah M Y,Kanazawa S,Chiu C Y,et al.Microbial distribution and function across wheat rhizosphere with oxamide and ammonium sulfate as N sources[J].Soil Science and Plant Nutrition,2000,46:787-796.
[16]吴林坤,林向民,林文雄.根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J].植物生态学报,2014,38(3):298-310.
[17]Sekiguchi H,Tomioka N,Nakahara T,et a1.A single band does not always represent single bactedal strains in denaturing gradient gel electrophoresis analysis[J].Biotechnology Letters,2001,23:1205-1208.
[18]Murray A E,Hollibaugh J T,Orrego C.Phylogenetic composition of bacterioplankton from two California estuaries compared by denaturing gradient gel electrophoresis of 16SrDNA fragments[J].Applied Environmental Microbiology,1996,62:2676-2680.
[19]Singh G,Mukerji K G.Root exudates as determinant of rhizospheric microbial biodiversity[A].In:Mukerji KG,Ma-noharachary C,Singh J eds.Microbial Activity in the Rhizosphere[M].Berlin:Springer,2006.
[20]Gadkar V,David-Schwartz R,Nagahashi G,et al.Root exudate of pmi tomato mutant M161 reduces AM fungal proliferation in vitro[J].Fems Microbiology Letters,2003,223:193-198.
[21]王树起,韩晓增,乔云发.根系分泌物的化感作用及其对土壤微生物的影响[J].土壤通报,2007:38(6):1219-1226.
[22]Wu H W,Haig T,Pratley J,et al.Allelochemicals in wheat(Triticum aestivum L.):cultivar difference in the exudation of phenolic acids[J].Journal of Agricultural & Food Chemistry,2001,49:3742-3745.
[23]Wollenweber E,Henrich B,Mann K,et al.Lipophilic exudate constituents of some Rosaceae from the Southwestern USA [J].Zeitschrift fur Naturforschung,1996,51:296-300.
[24]孙备.细叶冬青中抗微生物作用的三萜类化合物及其抗真菌作用机理[J].国际中医中药杂志,2000,22(2):102-103.
[25]Bardgett R D.The diversity of life in soil.In Bardgett RD ed.The Biology of Soil.A Community and Ecosystem Approach[M].New York:Oxford University Press,2005.
Comparison of Rhizosphere Microbial Characteristicsof Five Different Bonsai Plants
Mao Kuncai1,2,Zou Guiwu1,Deng Guanghua1,Liu Wei1*
(1.College of Art and Landscape,Jiangxi Agricultural University,Nanchang 330045;
2.Training Center of Forestry Cadres,Forestry Department of Jiangxi Province,Nanchang 330045)
Abstract:The polymerase chain reaction-denaturing gradient gel electrophoresis(PCR-DGGE)method was used to determine the rhizosphere microorganism diversity of five bonsai species includingSyzygiumgrijsii,Pyracanthafortuneana,Acerbuergerianum,Acerpalmatum,andDaphneodora.The results showed that the rhizosphere microorganism had significant differences among the five bonsai species.Electrophoresis lanes obtained by PCR-DGGE were able to reflect the difference.Soil microorganism diversity were higher inAcerpalmatumandAcerpalmatum,with peak diversity index of 3.121 and 2.876,they also had a higher similarity of rhizosphere microbial community.The lowest diversity index was observed inPyracanthafortuneana,and the value was 1.038.These differences in rhizosphere microbial communities may be caused by root exudate secreted from different bonsai plants.Higher similarity of rhizosphere microbial community fromAcerpalmatumandAcerpalmatummay be due to their close phylogenetic position(Aceraceae,Acer).A lower rhizosphere microbial diversity inPyracanthafortuneanamay be due to the root exudate secreted by Rosaceae plant,which contained substances triterpene acids and had inhibitory effect on microorganism.
Keywords:bonsai species;rhizosphere microorganism diversity;PCR-DGGE analysis
*通信作者:刘玮,讲师,博士,E-mail: w_liu08@163.com
作者简介:第一毛坤财,工程师,硕士研究生,主要从事园林植物与观赏园艺学相关研究工作。
基金项目:国家自然科学基金(31400528);江西省自然科学基金(20151BAB214018)资助
收稿日期:2015-10-11
中图分类号:S 688.1;S 154.3
文献标识码:A
文章编号:1001-005X(2016)01-0033-04
