严重脓毒症患者CRRT治疗中护理干预及细胞因子的预测价值
2016-03-02陈芳秦雪兰蔡坤伶赖军华谭鹤长
陈芳 秦雪兰 蔡坤伶 赖军华 谭鹤长
(广西医科大学第四附属医院柳州市工人医院,广西 柳州 545005)
严重脓毒症患者CRRT治疗中护理干预及细胞因子的预测价值
陈芳 秦雪兰 蔡坤伶 赖军华 谭鹤长
(广西医科大学第四附属医院柳州市工人医院,广西 柳州 545005)
目的 探讨细胞因子对严重脓毒症患者CRRT治疗结局的预测价值,并总结护理干预方法。方法 选择我院ICU收治的因严重脓毒症行CRRT治疗的62例患者,按照治疗后随访28 d时结局分成死亡组和生存组。CRRT治疗前及治疗72 h 后收集血气、肝肾功能检验指标,同时采用ELISA方法测定IL-1β、IL-6、IL-10、TNF-α等数据。结果 62例患者中,随访至28 d死亡27例(43.5%),存活35例(56.5%),无失访病例。死亡组患者乳酸、AST、IL-1β、IL-6及TNF-α降低值低于存活组(P<0.05),而PH、IL-10的升高值低于存活组患者(P<0.05)。COX回归分析显示血乳酸(HR=1.94,P=0.018)、IL-1β(HR=1.97,P=0.005)、TNF-α(HR=1.21,P=0.007)治疗前后差值,为影响严重脓毒症患者死亡的独立风险因素。ROC曲线分析显示乳酸和TNF-α对治疗结局预测的曲线下面积分别为0.76和0.80(P<0.05)。结论 通过有效的护理干预,CRRT治疗可以安全有效地清除细胞因子,乳酸及细胞因子清除情况可以作为预测治疗结局的良好指标。
严重脓毒症; 细胞因子; 连续性肾脏替代治疗; 护理
Severe sepsis; Cytokines; Continuous renal replacement therapy; Nursing
脓毒症是由感染引起的全身炎症反应综合征,国内的研究显示严重症脓毒症病死率高达43.9%[1],国外的报道为30%~50%[2]。目前常规治疗及护理主要以抗感染和器官支持治疗为主,辅以气道护理、营养支持等综合护理措施[3]。连续性肾脏替代治疗(Continuous renal replacement therapy, CRRT)具有维持内环境稳态、调节稳定免疫功能等作用,研究显示通过有效护理的CRRT治疗可以明显提高治疗效果[4-6],但细胞因子清除情况与患者预后相关关系以及相应护理干预方法的研究较少。本研究通过分析CRRT治疗前后严重脓毒症患者感染指标、细胞因子的变化,探讨细胞因子清除与治疗结局的关系,现报告如下。
1 资料与方法
1.1 一般资料 2014年1月-2015年11月我院收治的因严重脓毒症需要行CRRT治疗的住院患者为研究对象,入组条件:(1)由ICU主治及以上职称医师根据《中国严重脓毒症/脓毒性休克治疗指南(2014)》中严重脓毒症的诊断标准确诊的患者。(2)年龄>18岁。(3)无论是否合并急性肾损伤(Acute kidney injury, AKI)[7],肾脏内科副主任及以上职称会诊后建议行CRRT 治疗,且治疗模式为 CVVH者。(4)家属同意参加,签署知情同意书。排除标准:(1)既往有慢性肾衰竭病史,需要进行常规透析治疗者。(2)接受过肾移植术者以及长期服用免疫抑制剂者。(3)患有恶性肿瘤、结缔组织病、系统性红斑狼疮等自身免疫疾病者。符合入组条件的患者62例,所有患者均予机械通气治疗。62例患者28 d随访时,死亡27例(43.5%),存活35例(56.5%),无失访病例,死亡和存活患者年龄、性别及原发病比较差异无统计学意义(P>0.05),具有可比性。见表1。
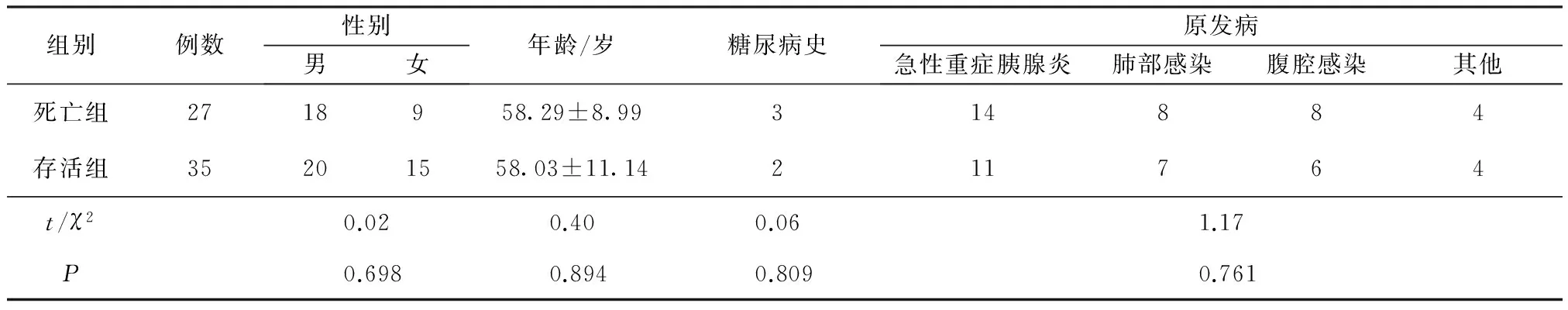
表1 死亡组和存活组患者的基本情况比较 例
1.2 方法
1.2.1 治疗方法 所有患者进入ICU后均按照严重脓毒症治疗指南给予镇静、液体复苏、使用血管活性药物、抗生素控制感染,清除感染灶、补液维持电解质及酸碱平衡及控制血糖等治疗,同时积极治疗原发病,保护重要脏器功能。根据血气分析结果及临床症状必要时行机械通气治疗。肾内科医师会诊后即开始CRRT治疗,血管通路采用中心静脉留置导管,均在ICU内行床边CRRT治疗,治疗模式均为CVVH,置换液采取前稀释,流量为2 500~4 000 mL/h,血流量为200~250 mL/min。机器使用德国生产的BRAUN Dipact CRRT机,滤器为贝朗Hips15聚砜膜,连续治疗72 h,置换液采用南京军区总医院配方[8]。抗凝方法包括普通肝素,低分子肝素钙抗凝。
1.2. 护理干预措施
1.2.2.1 密切观察患者生命体征变化 可以通过降低透析液温度参数,使流经透析器的高温血液与低温透析液存在温度差而降低血温,达到降温效果。另一方面需要积极分析引起的发热原因,严格遵守无菌操作原则。疑为细菌感染者,及时通知医生进行血培养并调整抗生素治疗方案。护士每15~30 min测血压并登记在CRRT治疗记录单,当血压降低时,及时通知医生,必要时应用血管活性药物。本次研究每个上机患者均配备有5年以上血液净化护理经验的护士,开始时血流速度较慢,判断血流动力学稳定后,逐渐调整血流速度和脱水量,所有患者均顺利完成CRRT治疗。
1.2.2.2 关注机器的工作状态 护理人员充分掌握贝朗CRRT机的工作原理及故障处理,严密观察各种管道压力参数,如动脉压、静脉压、滤前压、跨膜压、废液压力等,正确理解各参数的意义,出现异常及时处理各项报警。治疗过程中,始终保持足够的血流量,尽量减少机器报警,以免血泵停止运转。由于患者治疗时间长,当更换体位或进行护理各项操作时,机器出现静脉压、动脉压低报警,可能导管管口紧贴血管壁,应当停止调整导管的位置,至血流通顺后使用胶布固定。本次研究的护理人员均经过多个层次的培训,所有患者上机过程均未出现因机器故障停止治疗的情况。
1.2.2.3 做好管路护理 为了避免治疗中管路及滤器内凝血,在上机前用4%的肝素盐水2 000 mL进行充分预充管路及滤器,排净滤器及管道中的气泡。密切观察各接口连接,严防脱落,每次交接班过程均进行管路检查。发现导管出血流速不佳,有血栓形成,及时采取干预措施,遵医嘱应用尿激酶溶栓。三腔中心静脉导管的细管可用于抢救性药物输注,每次使用结束后及时进行消毒,用无菌敷料覆盖,胶布固定,防止扭曲、污染。
1.3 观察指标
1.3.1 生命体征 治疗前及治疗72 h后记录患者的体温(℃)、心率(bmp)等。
1.3.2 常规检验指标 CRRT治疗前及治疗后72 h抽取动脉血10 mL,5 mL常规送检血气、肝肾功能等。
1.3.3 细胞因子 另外5 mL动脉血经3 000 r/min离心15 min后取上清液,置于-80 ℃冰箱保存。采用酶联免疫吸附法(ELISA),检测IL-1β、IL-10、TNF-α等细胞因子。
1.3.4 生存情况 随访至自开始CRRT治疗后28 d,记录患者存活情况及生存时间。
1.4 统计学方法 应用 SPSS 16.0软件进行统计分析,计量资料用(均数±标准差)进行统计描述,计数资料采用频数(%)进行统计描述,采用t或者χ2检验进行基线情况统计比较。治疗前后指标对比采用配对t检验,采用协方差分析比较组间差值。对于协方差分析有统计学意义的变量纳入COX回归分析,探讨患者治疗结局独立影响因素。采用ROC曲线分析其诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 治疗结局的协方差分析 配对t检验结果分析,死亡组和存活组的患者经CRRT治疗72 h后,体温、心率、乳酸、肌酐、尿酸氮、ALT、AST以及IL-1β、IL-6、TNF-α均较之前降低(P<0.05),而pH值、IL-10较治疗升高(P<0.05),治疗后的APACHEⅡ评分也较治疗前降低(P<0.05)。以治疗后与治疗前各指标差值作为分析变量,治疗前指标数值作为协变量,采用协方差分析比较指标差值,见表2。
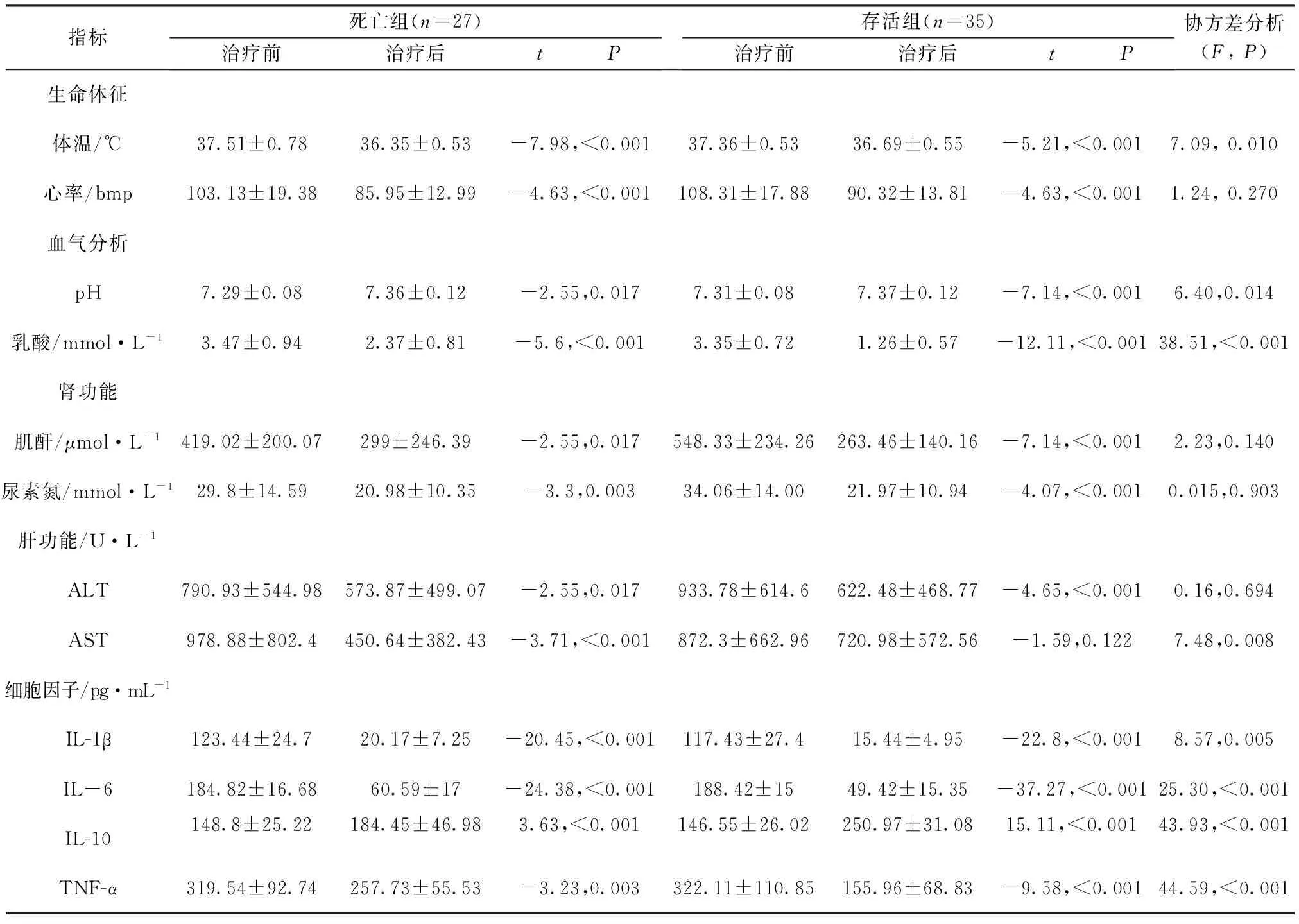
表2 死亡组及存活组患者治疗前后检验指标及炎症因子比较
2.2 治疗结局的多因素分析 将协方差因素分析有统计学意义的指标纳入多因素分析,COX回归分析结果显示血乳酸(HR=1.94,P=0.018)、IL-1β(HR=1.97,P=0.005)以及TNF-α(HR=1.21,P=0.007)的治疗后与治疗前差值,为患者治疗结局的独立影响因素,见表3。以死亡为结局,治疗后与治疗前乳酸、TNF-α以及IL-1β为分析变量进行ROC曲线分析,结果显示乳酸、TNF-α的AUC值统计学意义(P<0.001,P<0.001),截断点分别为-2.16 mmol/L和-163.9 pg/ml,见表4。
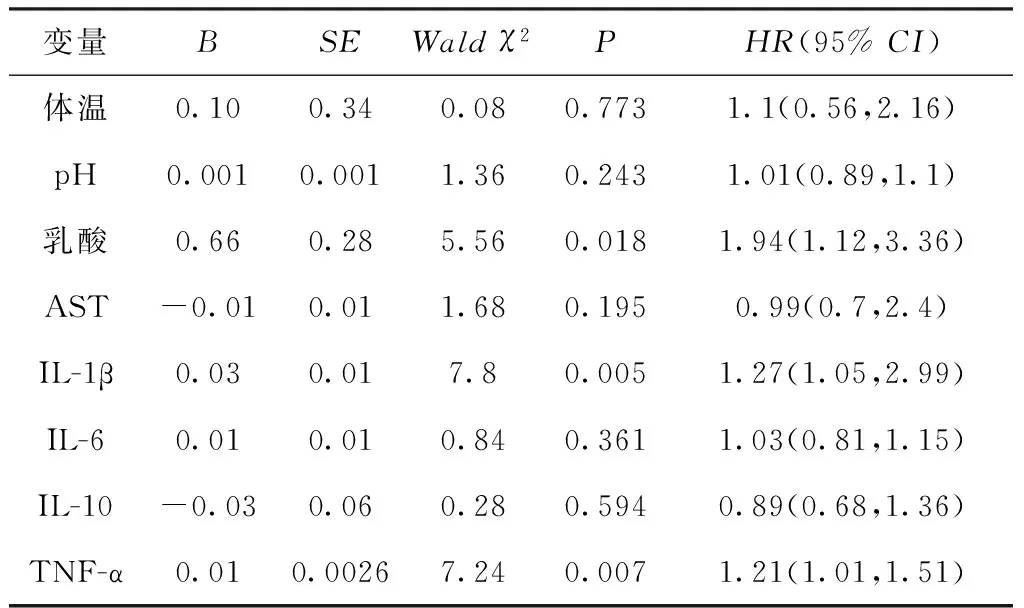
表3 严重脓毒症死亡风险的COX回归分析

表4 以死亡/存活为结局的ROC曲线分析
3 讨论
本研究结果显示,28 d存活的患者CRRT治疗后乳酸、AST、IL-1β、IL-6、TNF-α的清除情况明显高于死亡组患者,提示CRRT溶质的清除越高治疗效果越好。乳酸是糖酵解过程的最终产物,乳酸增加提示血流灌注不足,研究[9]证实,血乳酸水平升高与病死率有相关性。本文COX回归分析结果显示CRRT治疗后,乳酸降低水平是患者治疗结局的独立预测因素。研究显示TNF-α是脓毒症导致炎症递质失控性释放的关键性促进因子,IL-1可增强TNF-α对机体的损伤,另外IL-10为负性的调节炎症调节因子,疾病的转归主要取决于免疫的平衡状态的恢复[10]。本次研究结果显示:CRRT治疗后患者的细胞因子IL-1β、IL-6、TNF-α水平均较之前降低,而IL-10较治疗前有明显增加,与国内其他研究结果一致[11-12]。COX回归分析显示,血清TNF-α的清除情况是患者死亡的独立预测指标,推测在严重脓毒症行CRRT治疗过程中定期监测两项指标,有助于评估治疗以及护理措施的效果。
综上所述,在脓毒血症休克的患者中,CRRT治疗可以纠正电解质及酸碱平衡紊乱、清除相关细胞因子,对恢复免疫平衡有重要作用。同时结合血乳酸以及TNF-α的清除情况可以作为预后判断的重要指标。
[1] 林瑾,刘培,庄海舟,等. 重症监护病房419例重度脓毒症患者的临床分析[J]. 中华危重病急救医学,2014,26(3):171-174.
[2] Rhodes A, Phillips G, Beale R, et al. The surviving sepsis campaign bundles and outcome: results from the international multicentre prevalence study on sepsis[J]. Intensive Care Med,2015,41(9):1620-1628.
[3] 中华医学会重症医学分会. 中国严重脓毒症/脓毒性休克治疗指南(2014)[J]. 中华内科杂志,2015,54(6):557-581.
[4] 郭蕾,陈建时,戴凌燕,等. 持续血液滤过治疗脓毒血症患者急性肾衰竭临床疗效[J]. 中华医院感染学杂志,2014,24(13):3250-3252.
[5] Honore PM, Jacobs R, Joannes-Boyau O, et al. Newly designed CRRT membranes for sepsis and SIRS-a pragmatic approach for bedside intensivists summarizing the more recent advances:a systematic structured review[J]. ASAIO J,2013,59(2):99-106.
[6] 李旭兰. 静脉-静脉血液透析滤过治疗严重脓毒症患者的护理[J]. 护士进修杂志,2011,26(19):1779-1780.
[7] 中华医学会重症医学分会. 中国严重脓毒症/脓毒性休克治疗指南(2014)[J]. 中华内科杂志,2015,54(6):557-581.
[8] 龚德华,季大玺. 个体化透析液配方的临床应用[J]. 肾脏病与透析肾移植杂志,2009,18(1):76-80.
[9] 李真玉,刘毅,柴艳芬. 血清降钙素原、C反应蛋白、乳酸、细胞因子及危重疾病评分对脓毒症预后分析[J]. 临床荟萃,2011,26(16):1381-1384, 1387.
[10]Lv S, Han M, Yi R, et al. Anti-TNF-alpha therapy for patients with sepsis: a systematic meta-analysis[J]. Int J Clin Pract,2014,68(4):520-528.
[11]陈海丽,林肖琴,潘云芳. 早期CRRT对重症急性胰腺炎患者细胞因子的影响[J]. 现代实用医学,2013,25(4):367-368, 371.
[12]梅海峰. CRRT在脓毒症患者中的治疗疗效及时机探讨[D]. 苏州大学,2014.
广西壮族自治区卫生厅计划课题(编号:Z2013616)
陈芳(1975-),女,广西蒙山,本科,主管护师,从事肾内科护理工作
谭鹤长,E-mail:418664939@qq.com
R473.5
B
10.16821/j.cnki.hsjx.2016.19.018
2016-04-26)
