NO2-源的NO对镉胁迫下玉米幼苗生理的影响
2016-03-01徐一馨范文强胡景江慕自新
贾 佳,徐一馨,李 佳,范文强,胡景江,慕自新
(西北农林科技大学,黄土高原土壤侵蚀与旱地农业国家重点实验室, 陕西 杨凌 712100)

NO2-源的NO对镉胁迫下玉米幼苗生理的影响
贾佳,徐一馨,李佳,范文强,胡景江,慕自新
(西北农林科技大学,黄土高原土壤侵蚀与旱地农业国家重点实验室, 陕西 杨凌 712100)
摘要:采用亚硝酸钠(NaNO2)在酸性条件下与还原剂还原型谷胱甘肽(GSH)反应生成S-亚硝基谷胱甘肽(GSNO),GSNO能够释放出NO,合成不同浓度的GSNO(0、50、125、250 μmol·L-1和350 μmol·L-1)溶液处理受CdCl2胁迫的玉米(ZeamaysL.)幼苗,以未用CdCl2处理的玉米幼苗作为对照(Control),探究GSNO对玉米幼苗Cd胁迫的缓解作用及其抗氧化机制。结果表明:GSNO处理使Cd胁迫下玉米幼苗的株高、茎粗和叶面积与对照组相比显著增加,其中250 μmol·L-1浓度的GSNO处理效果最佳;在350 μmol·L-1GSNO处理下玉米幼苗各类光合色素含量在胁迫组均达到最大值,有效缓解了叶片黄化;GSNO处理(最适浓度在125~250 μmol·L-1之间)也显著增强了Cd胁迫下玉米幼苗的抗氧化酶活性,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和过氧化物酶(POD)的活性,相应地降低了过氧化氢(H2O2)和超氧阴离子)含量的积累;GSNO还可以显著提高玉米幼苗螯合重金属离子的能力,其中250 μmol·L-1浓度的GSNO处理效果最佳。
关键词:NO;S-亚硝基谷胱甘肽;镉胁迫;玉米;生理
随着含有重金属的灌溉水、农药和化肥的大量使用, 农田土壤中重金属污染日趋严重[1]。镉(Cd)是一种强毒性重金属,当叶片中Cd浓度大于5~10 μg·g-1时,就会导致植物死亡[2]。Cd容易被植物根部吸收,其被运输到植物地上部分后,易进入到食物链中,最终影响动物和人类的健康[3]。Cd对植物的毒害作用表现为:植物生长发育迟缓、叶片失绿、改变叶绿体的超微结构、抑制光合作用、使CO2固定过程中的酶失活、诱导脂质过氧化、抑制花粉萌发和花粉管的生长以及导致N和S代谢紊乱等[4]。植物体具有不同的Cd耐受机制,包括:诱发抗氧化系统;将Cd束缚在细胞壁上;与植物螯合肽(PCs)络合并区域化于液泡中,或在叶表皮富集等[2]。因此探索生产上易行的缓解重金属污染的措施势在必行,而化学分子的调控是理想的方法之一。
一氧化氮(NO)是植物应答Cd胁迫的一种同步多功能信号分子,植物受Cd胁迫后,在体内能激发内源NO的形成[5]。外施NO可以缓解Cd对植株生长发育和生理代谢的抑制作用,这种促进效应可被NO清除剂或合成酶抑制剂所消除[6-7]。植物体内NO的来源途径多样,包括:酶促及非酶途径,氧化途径(以L-精氨酸为底物),以及还原途径(以NO2-或NO3-为底物)[8]。非酶促条件下由NO2-体外还原形成的NO具有合成底物来源方便、合成容易的特点,因此具有潜在的应用价值[9]。
酸性条件下,亚硝酸盐(NO2-)在有还原剂存在时会进行非酶促反应,生成NO[10]。而还原型谷胱甘肽(GSH)是一种很好的还原剂,可与NO2-反应生成S-亚硝基化谷胱甘肽(GSNO),GSNO能够快速释放NO,可以作为一种来源方便的外源NO供体。目前对这种来源的NO的研究主要围绕在打破种子休眠、抑制植物体内乙烯(C2H4)的产生等方面,而对其抵抗重金属Cd胁迫等方面的研究还未见报道[11]。因此,本文以玉米为材料,利用GSH和NO2-反应形成的NO,研究其在提高玉米抵抗重金属Cd毒害性的作用,以期为NO用于Cd污染土壤的修复提供理论依据。
1材料与方法
1.1幼苗培养及处理
以‘郑单958’玉米为试验材料,种子购于杨凌金诺种业公司。GSH购于Sigma公司,现用现配;NaNO2购于西陇制药公司。
GSNO溶液的制备:等体积的10 mmol·L-1NaNO2(在100 mmol·L-1HCl中)与等体积的10 mmol·L-1GSH(在100 mmol·L-1pH7.4的Na2HPO4-NaH2PO4磷酸缓冲液中)反应,即可形成5 mmol·L-1GSNO(混合液包含5 mmol·L-1GSNO)[12]。GSNO母液贮存在冰上,使用时稀释成特定的浓度。室温下,在100 mmol·L-1pH7.4的磷酸缓冲液中(内含50 μmol·L-1DTT),GSNO就可以释放出NO,其中500 μmol·L-1GSNO 30 min约释放NO 3.25μmol·L-1[12]。
幼苗培养:挑选饱满且胚完整的种子,用3% H2O2消毒15 min,蒸馏水反复冲洗后在蒸馏水中浸泡过夜,使其充分吸胀。然后将种子搁在底部铺有湿润滤纸的培养皿中,培养皿放于28℃恒温培养箱中使种子发芽;待芽长到2~3 cm(约3~4 d)后,选取发芽势一致的幼苗移栽到盛有自来水的培养钵中,置于光照培养间培养(光照强度为800 μmol·m-2·S-1,光周期14 h/10 h,昼夜温度28℃/20℃,空气相对湿度70%)。自来水中适应培养3 d后,将除对照组(control)以外的幼苗移栽至含有80 mg·L-1Cd(用CdCl2配制)(预实验发现此浓度足以产生胁迫效果,且可逆)的1/2 Hoagland营养液中培养,并将上述合成的5 mmol·L-1GSNO母液添加到含Cd的营养液中,使之形成0、50、125、250 μmol·L-1和350 μmol·L-1GSNO浓度梯度处理。因此,本研究共计6个处理,处理如下:Control,GSNO0+Cd80,GSNO50+Cd80,GSNO125+Cd80,GSNO250+Cd80,GSNO350+Cd80。对照一直培养在1/2 Hoagland营养液中。含Cd营养液每3天更换一次,而GSNO按浓度梯度每天进行补充。Cd处理7 d后开始测量,每处理分两部分,一部分用于形态指标和光合色素含量的测定;另一部分将根和叶片组织液氮速冻后用于其它生理指标的测定。
1.2指标测定方法
(1) 幼苗地上部分株高、茎粗和叶面积采用Francis[13]的方法进行测量。
(2) 光合色素含量的测定采用丙酮浸提法,用UV-2450型紫外可见分光光度计检测,分别在波长663、645 nm和470 nm处测定吸光度值。按公式分别计算叶绿素a、叶绿素b和类胡萝卜素的浓度,叶绿素a和叶绿素b的浓度相加即得叶绿素总浓度[9]。
(3) 抗氧化酶活性的测定采用Elavarthi和Martin[14]的分光光度法。
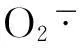
(5) 络合素(PCs)的含量为酸溶性硫醇含量(TAST)与GSH含量的差值。TAST的提取和含量测定:称取0.5 g左右的样品,加入0.02 mol·L-1EDTA溶液5 mL冰上研磨,12 000 g离心10 min,所得上清即为TAST。取2 ml上清与0.4 mol·L-1Tris缓冲液(pH8.2)和0.1 mL 0.01 mol·L-1DTNB混合,加入3.95 mL甲醇,20℃保温10 min,测定412 nm下的光吸收。
(6) GSH含量测定参照高俊凤等[17]的方法。
1.3统计分析
数据为3次试验的平均值±标准差。显著性差异分析用DPS软件进行方差分析和新复极差法比较,用Excel软件做图。
2结果与分析
2.1GSNO处理对Cd胁迫下玉米幼苗生长发育的影响
用不同浓度的GSNO处理Cd(80 mg·L-1)胁迫下的玉米幼苗,7 d后发现GSNO0+Cd80处理下玉米幼苗叶片黄化程度明显,甚至有发黑现象,且伸展不完全,叶片发育缓慢,植株矮小,根系发育也受到明显抑制(图1)。而GSNO对缓解CdCl2胁迫有显著作用,表现在根系和地上部生长的抑制均被缓解,叶片发育恢复正常,叶片黄化程度明显减弱甚至消失,侧根发育甚至优于对照,表现出部分的补偿效应。在≤ 250 μmol·L-1GSNO浓度范围内,GSNO缓解Cd胁迫的效果随GSNO浓度的增加而增加,GSNO250+Cd80处理达到最佳效果,随后随着浓度的增大,效果开始下降。表1表明:与GSNO0+Cd80处理相比,GSNO250+Cd80处理使Cd胁迫下玉米幼苗的株高、茎粗和叶面积分别增加了39.53%、42.11%和51.97%。

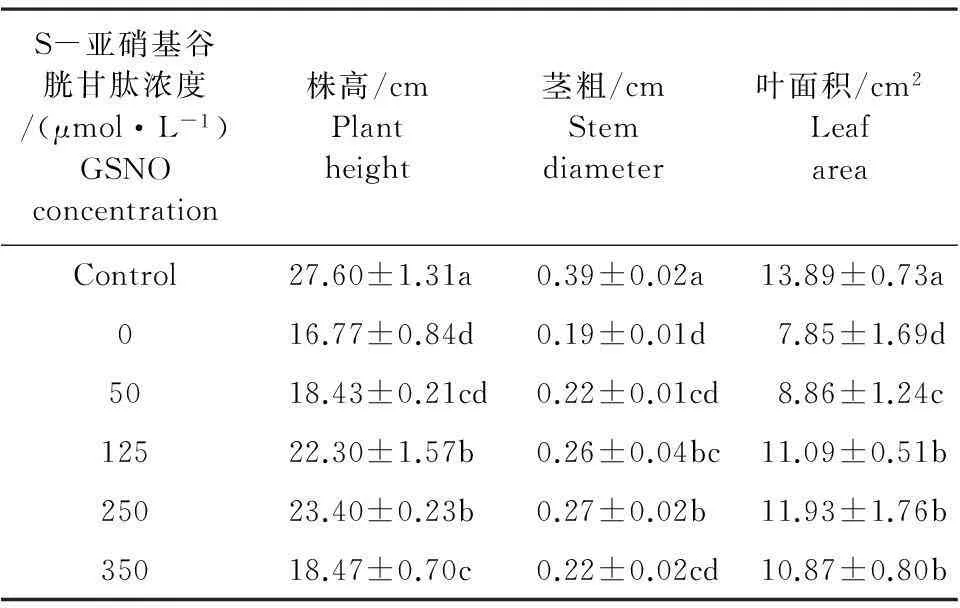
图1 不同浓度GSNO处理对80 mg·L-1Cd胁迫7 d后
注:不同小写字母表示各处理间差异显著(P<0.05)。下同。
Note: Different lowercase letters indicated significant differences (P<0.05) among different treatments. The same below.
2.2GSNO处理对Cd胁迫下玉米叶片光合色素含量的影响
与对照相比,GSNO0+Cd80处理使玉米幼苗叶绿素总量、叶绿素a、叶绿素b和类胡萝卜素的含量都显著降低(图2)。与GSNO0+Cd80处理相比,>50 μmol·L-1的GSNO处理使Cd胁迫玉米幼苗各光合色素含量的抑制作用被显著缓解(P<0.05),且随着GSNO处理浓度的升高,缓解作用逐渐增大。GSNO350+Cd80处理使叶绿素总量、叶绿素a、叶绿素b和类胡萝卜素含量分别比GSNO0+Cd80处理增加了267.74%、180.86%、731.01%和109.31%,类胡萝卜素的含量甚至达到了对照的水平,即抑制作用完全被解除。在GSNO350+Cd80处理时,并没有观察到GSNO处理的饱和效应,说明从保护光合色素含量的稳定性方面来讲,GSNO的处理浓度还能继续增加,同时表明Cd胁迫玉米幼苗的生长发育和光合色素对GSNO的敏感性不同。
2.3GSNO处理对Cd胁迫下玉米幼苗抗氧化酶活性的影响
由图3可见,无论在根系还是叶片组织上,GSNO0+Cd80处理都显著地抑制了几种抗氧化酶的活性。与对照组相比,GSNO0+Cd80处理使玉米根系的SOD、CAT、APX和POD活性分别下降了69.30%、81.97%、90.91%和71.93%,叶片的SOD、CAT、APX和POD活性分别下降了34.86%、78.68%、53.16%和57.90%。而Cd胁迫幼苗抗氧化酶活性对GSNO的响应与GSNO的浓度、酶蛋白自身特性和组织特异性都有关。总的规律是无论何种处理,叶片组织中SOD、APX活性均显著高于根系组织,而POD的活性在根系组织显著高于叶片组织,CAT的活性在组织间差异不显著。

图2不同浓度GSNO处理对Cd胁迫下玉米幼苗光合色素含量的影响
Fig.2Effects of GSNO treatments with different concentrations on the chloroplast pigments
content under 80 mg·L-1Cd stress in maize seedlings
与GSNO0+Cd80处理相比,适宜浓度的外源GSNO处理使Cd胁迫下的玉米幼苗根系和叶片中几种抗氧化酶活性均显著增加(P<0.05)。在叶片组织中,SOD、APX活性均随GSNO浓度增加而增加,前者GSNO125+Cd80处理达到峰值,后者GSNO250+Cd80处理达到峰值,处理浓度再次增加后均维持在这一水平。CAT和POD活性各自在GSNO125+Cd80处理和GSNO250+Cd80处理时达到峰值,然后当GSNO添加量达到350 μmol·L-1时,均下降到处理GSNO0+Cd80水平。在根系组织中,与处理GSNO0+Cd80相比,4种抗氧化酶活性均先增加后降低,只是其最大值出现的GSNO处理浓度不同。SOD和POD活性均在250 μmol·L-1GSNO浓度达到峰值,而CAT和APX活性在125 μmol·L-1GSNO时达到峰值。说明就GSNO诱导的对Cd胁迫的抗氧化防御来讲,不同的抗氧化酶在根系和叶片中的敏感性不同,对GSNO浓度的敏感性也不同。
2.5GSNO处理对Cd胁迫下玉米幼苗TAST、GSH和PCs含量的影响
与对照相比,GSNO0+Cd80处理使根系组织中的酸溶性硫醇(TAST)和络合素(PCs)含量都显著增加,而谷胱甘肽(GSH)含量显著降低(P<0.05);使叶片组织中PCs含量增加,TAST含量不变,GSH含量降低(表2)。与GSNO0+Cd80处理相比,≤250 μmol·L-1的GSNO均显著增加了根系和叶片组织中TAST、GSH、和PCs含量,且都在GSNO250+Cd80处理下达到峰值。此时根系中TAST、GSH和PCs含量分别比GSNO0+Cd80胁迫组提高了58.75%、78.53%和55.07%,而叶片中分别提高了19.52%、108.67%和6.90%。在GSNO350+Cd80处理后,不论是叶片还是根系这3个指标的值都开始下降。总之,外源GSNO处理能够明显缓解Cd对GSH的抑制作用,同时提高PCs含量,从而增强玉米组织尤其是根系鳌合Cd的能力,减小了Cd对植物组织的毒害作用。
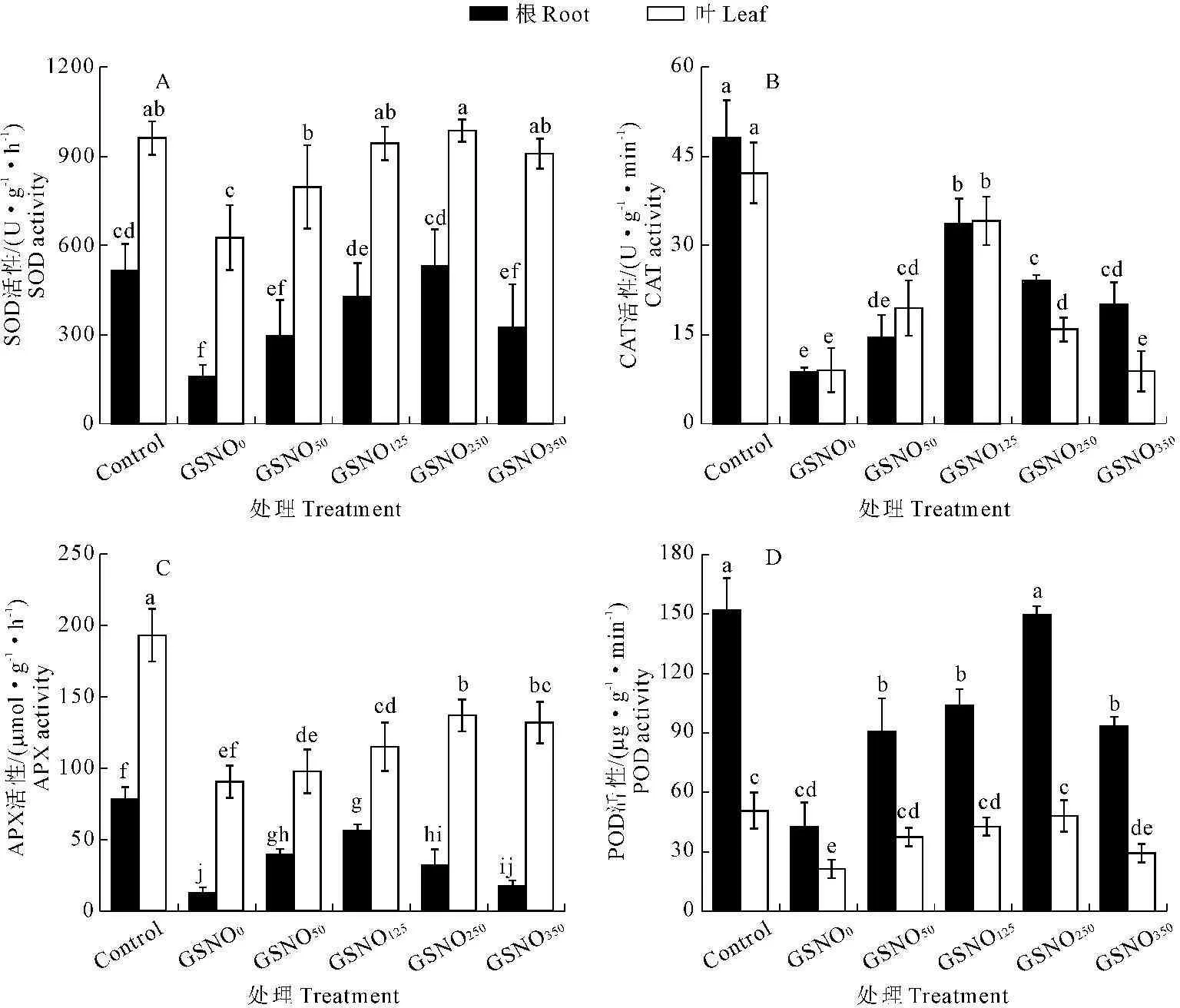
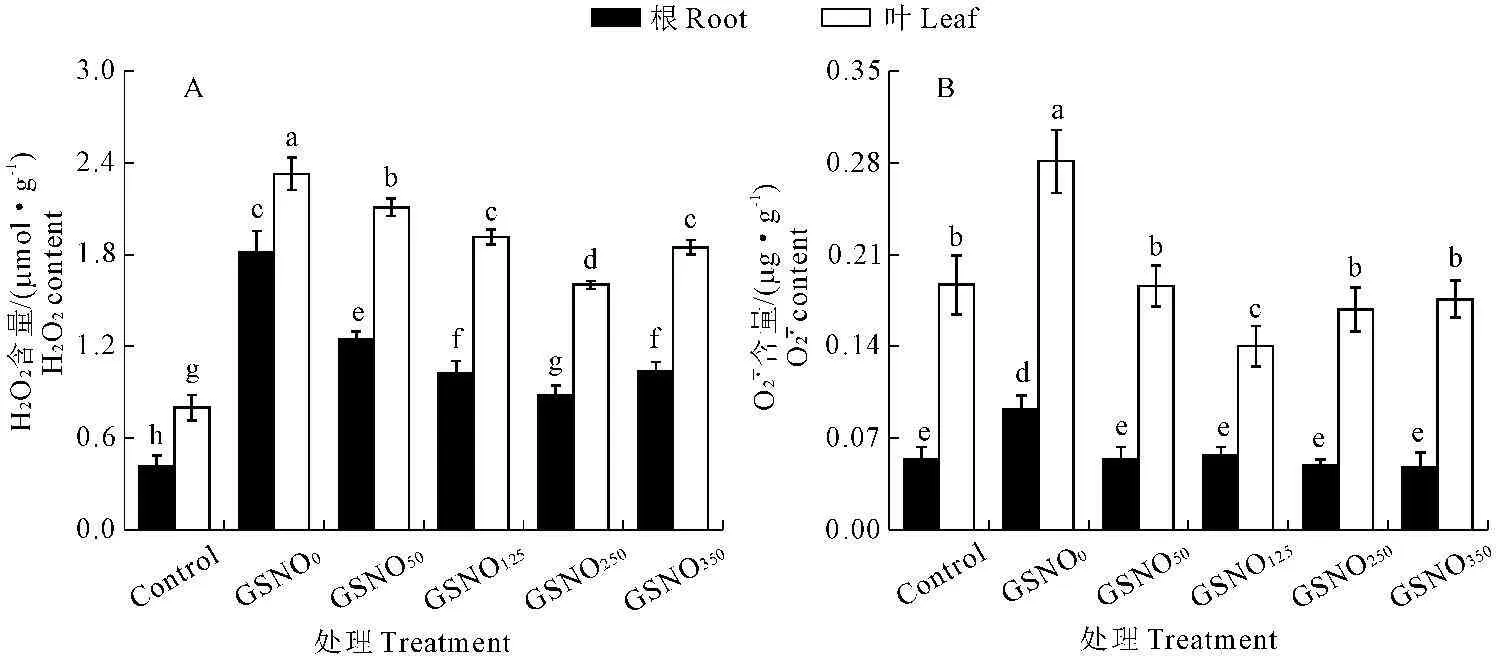
图3 不同浓度GSNO处理对80 mg·L-1Cd胁迫下玉米幼苗抗氧化酶活性的影响
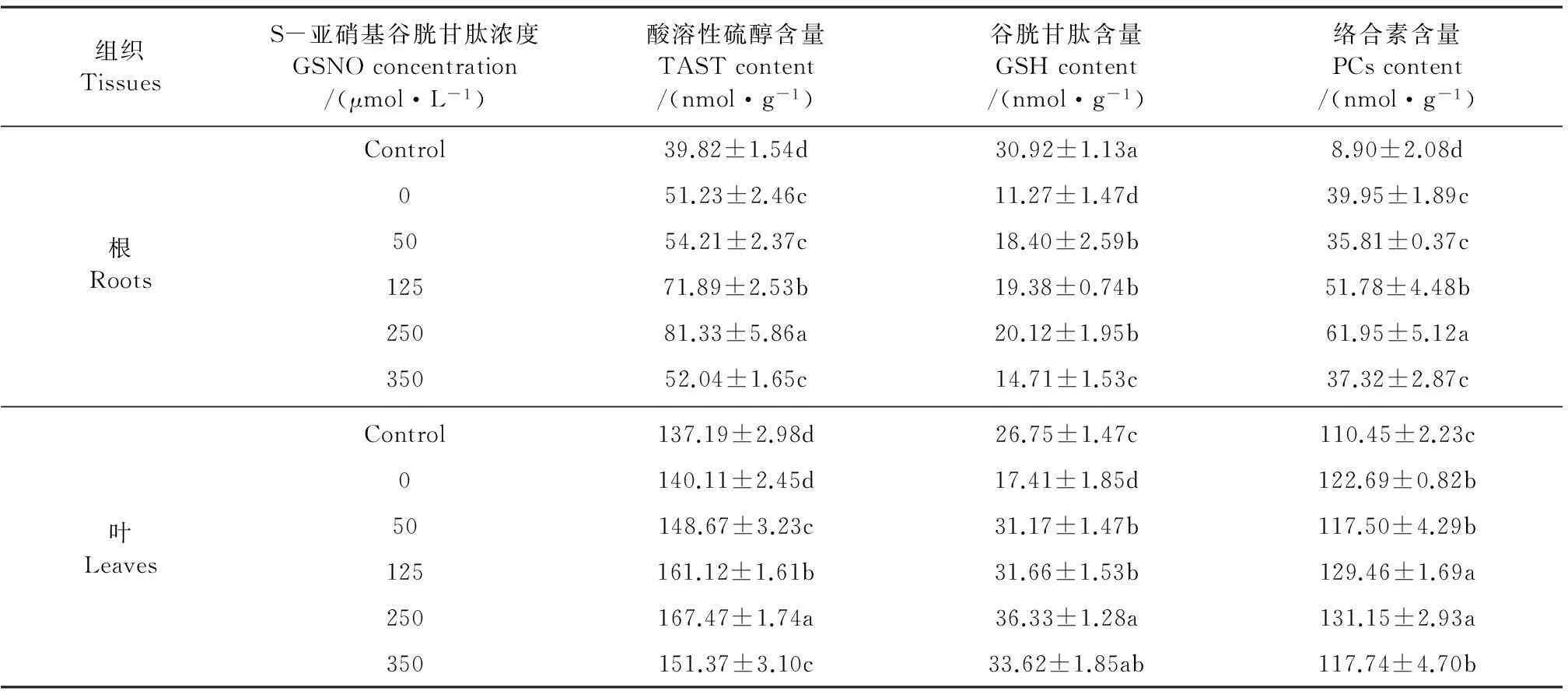
图4 不同浓度GSNO处理对Cd胁迫下玉米幼苗根系和叶片ROS含量的影响
3讨论
研究表明,Cd污染不仅抑制种子的萌发、种胚的生长,而且还会干扰植株的生理过程,降低光合速率[18]。Hsu和Kao[19]研究NO对Cd胁迫下水稻叶片光合色素含量的影响时认为,适量的NO可通过调节气孔的运动,减轻氧化胁迫和诱导胁迫应答基因的表达来行使抗逆功能。外源施加硝普钠(SNP)也明显地对Cd胁迫下玉米幼苗有保护作用,如增加玉米幼苗生物量以及提高各种抗氧化酶活性[20]。本研究中玉米幼苗在GSNO0+Cd80处理下,植株矮小,叶片卷曲黄化,根系生长发育受到显著抑制,而用NO2-源的NO处理后,光合色素含量显著增加,植株的生长状况也逐渐得到恢复。且在一定浓度阈值内,GSNO释放的NO可以显著提高玉米根系和叶片组织中抗氧化酶SOD、CAT、POD和APX的活性,消除组织中多余的ROS(H2O2和O2-),减少氧化伤害。我们推测,玉米体内NO2-源的NO对Cd胁迫的缓解作用,可能与提高植物清除ROS的能力(图3,图4,表2),降低ROS对叶绿素的损伤(图2),提高光合速率,促进植株的生长发育有关(表1)。NO提高植物抗逆性的一个重要机制是诱导抗氧化防御系统,减小氧化胁迫。如向Cd胁迫处理的苎麻幼苗施加外源NO(SNP)后,相比较于单独Cd胁迫处理的植株,SOD活性、APX活性以及GSH含量在短时间内大幅提高,从而缓解了Cd对植株的毒害作用[21]。盐胁迫会严重抑制芥末幼苗抗氧化酶的活性,而施加外源NO(SNP)则会使CAT活性、SOD活性以及APX活性迅速升高[22]。Singh[23]发现Cd胁迫处理的水稻幼苗中H2O2以及O2-含量是无胁迫处理对照组的近两倍,而外源NO处理后,ROS含量几乎接近于对照组。这些结果都表明NO抗氧化功能可能是通过清除体内多余的ROS来发挥作用。植物在细胞内通过螯合作用将重金属固定以降低其生物毒性是植物缓解重金属胁迫的一种重要方式,而植物螯合素(PCs)是植物体内主要的金属螯合物质[24]。PCs具有较低的分子量,可以与各种金属离子形成硫醇结合蛋白[20]。D’Alessandro[25]等通过质谱分析的方法测定Cd胁迫下芥菜幼苗的PC含量,发现一定浓度的Cd处理确实会引起PC2和PC3在植物体内的积累。除了螯合重金属之外,有研究者证实PCs还能够降低植物体内Cd胁迫诱导产生的ROS含量,提高重金属耐受力[26]。GSH是一种三肽,是PCs合成的前体物质,PCs的合成是从GSH的γ-谷氨酰半胱氨酰二肽转肽而来,Cd胁迫会使ROS含量上升,从而扰乱抗坏血酸和GSH的正常代谢,使得GSH含量降低[27]。而GSH本身又是一种抗氧化剂,可以抵抗逆境,NO能够启动植物体抗胁迫机制,从而促进GSH含量的增加[28]。本文通过研究NO2-源的NO对Cd胁迫下玉米幼苗TAST、GSH和PCs含量的影响,发现此来源的NO对三者的含量都有促进作用,只不过它们在根系和叶片组织中对Cd抗性的贡献不同。从对NO的响应程度看,PCs(螯合机制)可能主要在根系中起作用,而GSH(抗氧化防御机制)主要在叶片中起作用。这对应于叶片组织中活性氧的含量和抗氧化酶的活性大都高于根系组织。这就说明NO2-来源的NO能够在重金属胁迫下增强植物螯合和固定重金属离子的能力,避免伤害延续,对胁迫起到了缓解作用。而且与化学合成的重金属螯合剂或络合剂相比,NO作用更迅速,半衰期更短,二次污染更小[2]。
本研究中也明显观察到了NO2-源的NO在增强玉米Cd胁迫耐受中的浓度依赖性,如并非随施加GSNO供体的浓度增大而成比例地提高玉米幼苗对Cd的耐受性,高浓度GSNO甚至使一些指标如PCs含量和部分抗氧化酶活性降低到胁迫水平。这可是能因为低浓度NO作为抗氧化剂,除了直接清除ROS之外,还诱导了抗氧化防御系统的活性;而高浓度的NO作为活性氮,对植株产生了硝化胁迫(Nitrosative stress)有关[29-30]。本研究设置的GSNO的浓度上限为350 μmol·L-1,随着GSNO浓度的增加,硝化胁迫现象可能更加显著。关于NO在植物应答非生物逆境中的双面性已有大量的报道[31]。因此要使其应用在大田生产中,将来的研究重点需集中在其对大田作物、蔬菜或果品等的农艺性状的影响,合理的使用浓度及其环境安全性(如残留情况)方面。
4结论
NO2-源生成的NO对Cd胁迫下玉米幼苗地上部和根系的生长均具有显著的促进作用,缓解了Cd的毒害作用。并且通过维持光合色素含量的相对稳定,有效地缓解了Cd胁迫下叶片的失绿黄化现象。还通过优化玉米幼苗酶促抗氧化防御系统,进而降低ROS的迸发而抵御Cd胁迫。增加了玉米幼苗尤其是根系PCs的含量,进而通过增加对重金属的螯合来减轻Cd的危害。
参 考 文 献:
[1]Uraguchi S, Fujiwara T. Cadmium transport and tolerance in rice: perspectives for reducing grain cadmium accumulation[J]. Rice, 2011,5(1):1-8.
[2]Verbruggen N, Hermans C, Schat H. Mechanisms to cope with arsenic or cadmium excess in plants[J]. Current Opinion in Plant Biology, 2009,12(3):364-372.
[3]White P J, Brown P H. Plant nutrition for sustainable development and global health[J]. Annals of Botany, 2010,105(7):1073-1080.
[4]Gill S S, Tuteja N. Cadmium stress tolerance in crop plants: probing the role of sulfur[J]. Plant signaling & behavior, 2011,6(2):215-222.
[5]Gill S S, Khan N A, Anjum N A. Amelioration of cadmium stress in crop plants by nutrients management: morphological, physiological and biochemical aspects[J]. Plant Stress, 2011,5(1):1-23.
[6]Xiong J, An L, Lu H, et al. Exogenous nitric oxide improves antioxidative capacity and reduces auxin degradation in roots of Medicago truncatula seedlings under cadmium stress[J]. Plant and Soil, 2010,326(1/2):321-330.
[7]Singh H P, Batish D R, Kaur G, et al. Nitric oxide(as sodium nitroprusside) supplementation ameliorates Cd toxicity in hydroponically grown wheat roots[J]. Environmental and Experimental Botany, 2008,63(1-3):158-167.
[8]Gupta K J, Fernie A R, Kaiser W M, et al. On the origins of nitric oxide[J]. Trends in Plant Science, 2011,16(3):1360-1385.
[9]徐一馨,王飞,范文强,等.抗坏血酸存在条件下NO2-对玉米植株镉胁迫的缓解作用[J].环境科学学报,2014,34(7):1874-1883.
[10]Yamasaki H, Sakihama Y. Simultaneous production of nitric oxide and peroxynitrite by plant nitrate reductase: in vitro evidence for the NR-dependent formation of active nitrogen species[J]. FEBS Lett, 2000,468:89-92.
[11]David R R, James P M. Nitric oxide and nitrite treatments reduce ethylene evolution from apple fruit disks[J]. HortScience, 2006,41(6):1462-1465.
[12]Sebastia J, Marcela S, Carlos G B, et al. Chloroplasts as a nitric oxide cellular source. effect of reactive nitrogen species on chloroplastic lipids and proteins[J]. Plant Physiology, 2006,142(3):1246-1255.
[13]Francis C A, Rutger J N, Plamer A F E. A rapid method for plant leaf area estimation in maize (ZeaMaysL.)[J]. Crop Science, 1969,9(5):537-539.
[14]Elavarthi S, Martin B. Spectrophotometric assays for antioxidant enzymes in plants[J]. Methods in Molecular Biology, 2010,639:273-280.
[15]Zhan A, Jiang M, Zhang J, et al. Nitric oxide induced by hydrogen peroxide mediates abscisic acid-induced activation of the mitogen-activated protein kinase cascade involved in antioxidant defense in maize leaves[J]. New Phytologist, 2007,175(1):36-50.
[16]Brennan T, Frenkel C. Involvement of hydrogen peroxide in the regulation of senecence in pear[J]. Plant Physiology, 1977,59:411-416.
[17]高俊凤.植物生理试验指导[M].北京:高等教育出版社,2006:192-201.
[18]Feng S J, Yang T X, Zhang Y J, et at. Effects of cadmium on photosynthetic gas exchange and chlorophyll fluorescence of two species of poplar[J]. Journal of Agro-Environment Science, 2013,32(3):539-547.
[19]HSU Y T, KAO C H. Cadmium toxicity is reduced by nitric oxide in rice leaves[J]. Journal of Plant Growth Regulation, 2004,42(3):227-238.
[20]王芳,常盼盼,陈永平,等,外源NO对镉胁迫下玉米幼苗生长和生理特性的影响[J].草业学报,2013,22(2):178-186.
[21]WANG D, LIU Y, TAN X, et al. Effect of exogenous nitric oxide on antioxidative system and S-nitrosylation in leaves ofBoehmerianivea(L.) Gaud under cadmium stress[J]. Environmental Science and Pollution Research, 2015,22(5):3489-3497.
[22]Khan M N, Siddiqui M H, Mmhammad F, et al. Interactive role of nitric oxide and calcium chloride in enhancing tolerance to salt stress[J]. Nitric Oxide, 2012,27(4):210-218.
[23]Singh P, Shah K. Evidences for reduced metal-uptake and membrane injury upon application of nitric oxide donor in cadmium stressed rice seedlings[J]. Plant Physiology and Biochemistry, 2014,83:180-184.
[24]谭万能,李志安,邹碧.植物对重金属耐性的分子生机理[J].植物生态学报,2006,30(4):703-712.
[25]D'alessandro A, Taamalli M, Gevi F, et al. Cadmium stress responses in Brassica juncea: hints from proteomics and metabolomics[J]. Journal of Proteome Research, 2013,12(11):4979-4997.
[26]Mishra S, Srivastava S, Tripathi R D, et al. Lead detoxification by coontail (CeratophyllumdemersumL.) involves induction of phytochelatins and antioxidant system in response to its accumulation[J]. Chemosphere, 2006,65(6):1027-1039.
[27]Koffler B E, Polanschutz L, Zechmann B. Higher sensitivity of pad2-1 and vtc2-1 mutants to cadmium is related to lower subcellular glutathione rather than ascorbate contents[J]. Protoplasma, 2014,251:755-769.
[28]Yu Q, Sun L, Jin H, et al. Lead-induced nitric oxide generation plays a critical role in lead uptake by Pogona-therum crinitum root cells[J]. Plant Cell Physiol, 2012,53(10):1728-1736.
[29]Saxena I, Shekhawath G S. Nitric oxide (NO) in alleviation of heavy metal induced phytotoxicity and its role in protein nitration[J]. Nitric Oxide, 2013,32:13-20.
[30]Corpas F J, Leterrier M, Valderrama R, et al. Nitric oxide imbalance provokes a nitrosative response in plants under abiotic stress[J]. Plant Science, 2011,181(5):604-611.
[31]Siddiqui M H, Ai-whaibi M H, Basalah M O. Role of nitric oxide in tolerance of plants to abiotic stress[J]. Protoplasma, 2011,248(3):447-455.
Effects of nitric oxide, an indirect reaction production of NO2-, on the
physiological functions of maize under cadmium stress
JIA Jia, XU Yi-xin, LI Jia, FAN Wen-qiang, HU Jing-jiang, MU Zi-xin
(StateKeyLaboratoryofSoilErosionandDrylandFarmingontheLoessPlateau,
NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
Abstract:Gaseous signaling molecule nitric oxide (NO) is proven in many plants to be able to alleviate cadmium (Cd) stress. Under acidic conditions, glutathione (GSH) can react with sodium nitrite (NaNO2) to generate S-nitroso-glutathione (GSNO), which can release NO. The present work was to study whether this type of NO could help maize seedlings (ZeamaysL.) to resist Cd stress. Different concentrations of GSNO (50, 125, 250 μmol·L-1, and 350 μmol·L-1) were applied to maize seedlings that had been subjected to 80 mg·L-1CdCl2for 7 d. The results showed that GSNO could significantly improve maize seedlings plant height, stem diameter, and leaf area, especially at the 250 μmol·L-1GSNO concentration; The addition of 350 μmol·L-1GSNO couldmaintain photosynthetic pigment maximization, effectively alleviate leaf yellowing; The benificial effects of GSNO (optimum concentration was in the range of 150~250 μmol·L-1) on Cd-stressed maize might be related to the enhanced antioxidant enzyme activity, such as superoxide dismutase (SOD), catalase (CAT), ascorbate peroxidase (APX) and peroxidase (POD), and decreased levels of H2O2and; Furthermore, GSNO greatly enhanced the capacity of maize seedlings to chelate heavy metal ions which optimal GSNO concentration was 250 μmol·L-1.
Keywords:NO; S-nitroso-glutathione; cadmium stress; maize; physiological functions
中图分类号:S513.01
文献标志码:A
通信作者:慕自新(1972—),硕士生导师,主要从事材料逆境生理与分子方向的研究。 E-mail: muzx810@126.com。
作者简介:贾佳(1989—),女,山东德州人,硕士,主要从事植物逆境生理方面的研究。 E-mail: 646343281@qq.com。
基金项目:黄土高原土壤侵蚀与旱地农业国家重点实验室基金(K318009902-14)
收稿日期:2015-03-02
doi:10.7606/j.issn.1000-7601.2016.01.25
文章编号:1000-7601(2016)01-0159-07
