国庆菊试管苗的生根移栽
2016-03-01袁丽伟
袁丽伟, 殷 果
(河北旅游职业学院, 河北 承德 067000)
国庆菊试管苗的生根移栽
袁丽伟, 殷 果
(河北旅游职业学院, 河北 承德 067000)
为国庆菊试管苗在组织培养上的操作技术及试管苗移栽后的管理提供理论依据,将国庆菊无根试管苗接种到含NAA(0.5 mg/L)的1/2MS、1/2N6和脱水MS 3种不同基本成分的培养基中,观察试管苗在3种不同基本培养基中的生根情况。再将已诱导生根的健壮试管苗移栽到珍珠岩、蛭石、腐殖质和纯蛭石不同组合配比的4种基质中,观察试管苗移栽成活率。结果显示:含NAA(0.5 mg/L)的3种基本培养基均有利于根的诱导,生根率达100%,但最有利于国庆菊试管苗生根的基本培养基是脱水MS培养基,其次是1/2N6培养基;国庆菊试管苗在蛭石∶腐叶土(1∶1)和纯蛭石移栽基质中移栽成活率较高,平均达94.8%。
国庆菊; 试管苗; 组织培养; 移栽; 生根; 培养基
国庆菊(ChrysanthemummorifoliumRamat.)花色鲜艳、丰富,植株低矮整齐,是从地被菊、日本小菊等品种中选育出来,用于布置国庆节日花坛的菊花种类。长期以来,国庆菊主要用嫩枝扦插繁殖,扦插繁殖的成活率受插穗母株年龄、插穗粗度和扦插时间、基质等因素的影响[1],而利用组织培养技术繁殖国庆菊则有生长环境可控制、繁殖迅速、成苗量大、脱毒及保持品种特性等优点[2],可应用于大规模的工厂化生产。我国园艺绿化已向现代化、科学化方向发展,因此运用组织培养繁殖技术促进国庆菊的发展已成为必然趋势。到目前为止,我国有关在国庆菊试管苗生根移栽方面的研究报道尚少,仅不同浓度的生长素(NAA)对菊花试管苗生根的影响[3]有报道。为此,笔者使用含有生长素为NAA(0.5 mg/L)的不同基本成分的培养基探讨对国庆菊试管苗生根及试管苗移栽技术方面的影响,以期为国庆菊试管苗在组织培养上的操作技术、试管苗移栽后的管理上提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 植物 国庆菊试管苗生根移栽的材料取自河北旅游职业学院组培实验室国庆菊无根试管苗。
1.1.2 培养基 1) 1/2MS+NAA(0.5 mg/L)+蔗糖(1.0%)+琼脂(0.75%); 2) 1/2N6+NAA(0.5 mg/L)+蔗糖(1.0%)+琼脂(0.75%); 3) 脱水MS+NAA(0.5 mg/L)+琼脂(0.2%)。3种培养基用0.1 mol/L NaOH将pH调至6.0,冷却后分装到罐头瓶内。在1.11~1.12 kg/cm2压力下高压蒸汽灭菌20 min。
1.1.3 移栽基质 1) 珍珠岩、蛭石和腐殖质(1∶1∶1); 2) 珍珠岩和蛭石(1∶1); 3) 腐叶土和蛭石(1∶1); 4) 纯蛭石。将4种基质分别装入耐高压聚丙烯塑料袋,在1.11~1.12 kg/cm2压力下高压蒸汽灭菌20 min后冷却备用。
1.2 接种
在超净工作台上,选取生长健壮的国庆菊无根试管苗,在培养皿中的无菌滤纸上切取3 cm左右的无根嫩茎,分别接种到已灭菌的含有NAA(0.5 mg/L)的1/2MS、1/2N6和脱水MS 3种基本培养基中生根诱导,每瓶接种10株,每种培养基接种15瓶,并置于培养箱培养。
1.3 生根培养
接种试管苗后先在暗光下培养5 d,后以日光灯为光源,每天进行2 000 Lx光照10~12 h,培养温度为(25±2)℃,定期观察试管苗生长及生根情况。培养20 d后,统计生根率(%)、生根条数(条)和平均根长(cm)等指标。
生根率=(生根苗总数/接种试管苗总数)×100%
平均生根数=生出的总根数/生根苗总株数
平均生根长度=生根累计总长度/生根的总数
1.4 炼苗
移栽前,将试管苗生根的培养瓶移至种苗移栽培养室内,常温下炼苗7 d,前4 d将瓶口打开一半,后3 d将瓶口完全打开,以使芽苗逐步适应培养室环境。
1.5 移栽
炼苗后,用镊子小心将试管苗从培养瓶中取出,放在盛有20℃左右的温水中,轻轻洗净附着在根上的培养基,以防止移栽后出现因细菌感染而导致试管苗烂根现象,并对过长的根适当修剪,再放入温水中清洗1次。然后将去除培养基的试管苗放入500~800倍多菌灵水溶液中浸泡10~15 min,进行试管苗消毒后准备移栽。
分别取在3种不同生根培养基中经诱导生根数相同的健壮试管苗,分别移栽到准备的4种基质中。移栽过程中为保护试管苗幼嫩的根系免受损害,先用小木棍或竹签在穴盘的基质中心打孔,然后手持镊子夹住试管苗,轻轻放入孔穴内,并舒展根系,轻轻压四周基质,并采用细喷雾器喷水方式浇透水1次。
1.6 栽后管理及移栽存活率的计算
刚移栽的幼苗,由于根系供水缓慢,开始要搭荫棚并及时喷水或喷雾,以增加叶表面和环境的湿度,避免强光照。但这一时期不宜维持时间过长,长时间的高湿度有利于猝倒病菌的繁殖,幼嫩的菊苗最易受到病菌侵害,因此在移栽2 d后要逐步适当增加光照,每天浇水1~2次,夏天高温浇水2~3次[4],以保持小苗的水分供需平衡。
由于国庆菊喜凉爽,忌炎热,怕积水雨涝,水分管理要坚持不干不浇的原则,要适时适量,切不能过干或过湿,又不可半干半湿,即浇半截水。试管苗移栽成活后逐渐移入向阳地[5]。每天要保持环境的湿度,控制浇水量和浇水时间,并定期观察其生长状况。20 d后统计移栽苗移栽存活率。
移栽存活率=(移栽存活的株数/移栽苗的总株数)×100%
2 结果与分析
2.1 不同基本培养基试管苗的生根状况
由图示和表1可见,国庆菊试管苗在添加NAA(0.5 mg/L)的3种不同成分基本培养基中能生根,且生根率均为100%。但不同成分的基本培养基对国庆菊试管苗的根质量、平均生根数及平均根长度都有影响。总体上看,在1/2MS培养基中的国庆菊试管苗生根较慢,在16 d后试管苗才全部生根,且根质量较差,缺少根毛,根少,根短。而在1/2N6和脱水MS 2种基本培养基中国庆菊试管苗生根均良好,根毛丰富。在1/2N6培养基中试管苗的根短粗,12 d后全部生根;脱水MS培养基中试管苗的根细长,平均根长度1.4 cm。条数最多,平均生根数13个,生根最快,试管苗在7 d后全部生根。
由此可知,国庆菊试管苗虽在3种不同基本成分的培养基中均能生根,生根率均为100%,但试管苗的生长状况差距很大,在脱水MS培养基中的试管苗生长最健壮,生根质量与数量也最佳,所以最有利于国庆菊试管苗生根的基本培养基是脱水MS培养基,其次是1/2N6培养基。

图示 移栽前3种培养基试管苗的生长情况
Fig. Growth status ofC.morifoliumtube plantlets cultured on three different media before transplanting

表1 不同基本培养基国庆菊试管苗的生根情况
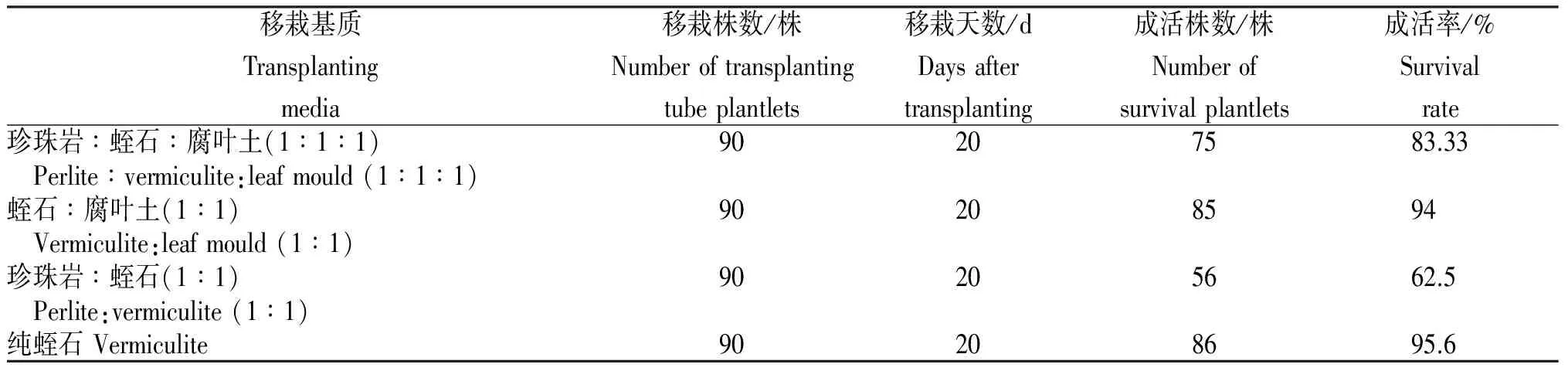
表2 不同基质国庆菊试管苗移栽的成活率
2.2 不同移栽基质移栽苗的成活率
从3种培养基中生长的试管苗在4种移栽基质中成活情况(表2)可知,国庆菊在纯蛭石基质中,移栽苗株高增长幅度和苗的质量均属最佳,移栽成活率达95.6%。另外,蛭石∶腐叶土(1∶1)的基质也比较适合国庆菊试管苗的移栽,移栽成活率达95.6%。
3 结论与讨论
试验结果表明,国庆菊试管苗虽然在1/2MS、1/2N6和脱水MS 3种不同基本成分的培养基中都能生根,生根率均为100%,但根据生根时间与根质量得出,最有利于国庆菊试管苗生根的基本培养基是脱水MS培养基,其次是1/2N6培养基。
比较(蛭石∶腐叶土)、(珍珠岩∶蛭石∶腐叶土)、(蛭石∶腐叶土)以及纯蛭石4种移栽基质,国庆菊试管苗在(蛭石∶腐叶土)和纯蛭石移栽基质中移栽成活率较高,平均达94.8%,而试管苗总的移栽成活率为83.86%,未达到成活率为90%的预想效果。究其原因有以下几方面:首先由于试管苗一直在比较优越的培养室环境下生长,幼苗抗病和抗干旱等能力较弱,一旦出瓶种植,环境发生了较大的变化,幼苗的成活率将直接受到影响,试管苗是否移栽成功,除要求试管苗生长健壮,移栽初期的养护管理也是移栽成功的关键[3];其次,移栽后期管理可能存有漏洞,空气湿度太大,导致植株叶片有水珠凝结,叶片难以负重,最终出现倒伏,萎蔫致死;再者是移栽时操作不够小心,可能对某些植株的根系造成一定的机械损伤,延缓了根部恢复吸收功能的时间,致使其未能及时获得需要的水分最后死亡[6]。虽然移栽成活率未达到预期效果,但本试验为国庆菊试管苗组织培养、移栽等相关试验提供参考依据。
[1] 李彦梅,武荣花,袁秀芳.国庆菊扦插繁殖技术研究[J].河南林业科技,1999,6(2):37-39.
[2] 袁丽伟.国庆菊继代增殖培养技术初探[J].贵州农业科学,2014,42(11):36-38.
[3] 蒋细旺,赵慧娟.菊花试管苗的生根及移栽研究[J].江汉大学学报,2003,12(4):73-75.
[4] 周瑞玲,吴雨龙.菊花的组织培养及移栽技术初探[J].江苏林业科技,2001,28(2):23-24.
[5] 赵 伟,赵立红.浅谈国庆菊的繁殖、栽培与管理技术[J].淮北职业技术学院学报,2005,1(1):87-88.
[6] 王振龙.植物组织培养[M].北京:中国农业大学出版社,2007.
(责任编辑: 刘忠丽)
Rooting and Transplanting ofChrysanthemummorifoliumTube Plantlets
YUAN Liwei, YIN Guo
(HebeiTourismVocationalCollege,Chengde,Hebei067000,China)
C.morifoliumplantlets without roots were cultured on 1/2 MS with 0.5 mg/L NAA, 1/2 N6with 0.5 mg/L NAA and dehydration MS with 0.5 mg/L NAA respectively to observe the rooting status of culturedC.morifoliumplantlets and then the healthyC.morifoliumplantlets with roots transplanted to four different substrate combinations of perlite, vermiculite, humus and pure vermiculite to study the survival rate of transplantedC.morifoliumplantlets with roots and to provide the theoretical basis for tissue culture technique ofC.morifoliumplantlets and management of transplantedC.morifoliumplantlets.Results:Three tested media all are beneficial to root induction ofC.morifoliumplantlets and their rooting rate reaches 100%. The optimum medium for root induction ofC.morifoliumplantlets is dehydration MS with 0.5 mg/L NAA, followed by 1/2 N6with 0.5 mg/L NAA. The survival rate ofC.morifoliumplantlets with roots transplanted in vermiculite∶leaf mould (1∶1) substrate and pure vermiculite substrate can be up to 94.8%.
Chrysanthemummorifolium; tube plantlet; tissue culture; transplanting; rooting; medium
2015-07-16; 2016-02-21修回
2015年承德市科学技术研究与发展计划项目“生态园林城市导向下节约型园林绿地规划设计研究”阶段性研究成果(20151115)
袁丽伟(1983-),女,讲师,从事园林植物等教学与科研工作。E-mail:yuanliwei@163.com
1001-3601(2016)03-0129-0129-03
S682.1+1
A
