猪流行性腹泻病毒的分离及其M基因的生物信息学分析
2016-03-01代振江梁海英曾智勇汤德元王伟丞
代振江, 梁海英, 曾智勇*, 汤德元, 王伟丞, 刘 钊
(1.贵州大学 动物科学学院, 贵州 贵阳 550025; 2.贵州省动物疫病控制中心, 贵州 贵阳 550025)
猪流行性腹泻病毒的分离及其M基因的生物信息学分析
代振江1, 梁海英1, 曾智勇1*, 汤德元1, 王伟丞2, 刘 钊1
(1.贵州大学 动物科学学院, 贵州 贵阳 550025; 2.贵州省动物疫病控制中心, 贵州 贵阳 550025)
为了解贵州猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)的变异情况,对分离PEDV的M基因进行了克隆测序和生物信息学分析。结果表明:分离的PEDV株(用N-GZ表示)与贵州省动物疫病研究室曾报道的PEDV株(用GZ表示)位于同一进化分支,与疫苗株CV777处于不同进化分支。N-GZ株与GZ株M基因的核苷酸序列相似性为98.5%,表明其亲缘关系较近,与CV777疫苗株的亲缘关系稍远。多重比较发现,N-GZ株与CV777株M蛋白的抗原表位区存在3个氨基酸的差异,与GZ株相比存在2个氨基酸的突变。M基因是PEDV的保守基因,但N-GZ株M基因在抗原表位区存在一定程度突变。
PEDV; M蛋白; 变异; 生物信息学分析
猪流行性腹泻是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)引起的一种接触性肠道传染病,主要以引起初生仔猪腹泻、呕吐和脱水为基本特征[1-3]。PEDV是冠状病毒科冠状病毒属的线性单股正链RNA病毒,PEDV全基因组长为27 000~33 000个核苷酸,其中含有6个开放性阅读框(ORF)[4-6],包括6个基因,分别为复制酶基因(Rep)、纤突蛋白基因(S)、ORF3基因、囊膜蛋白基因(E)、膜蛋白基因(M)和核衣壳蛋白基因(N)[7-10]。其中,PEDV的M基因负责编码PEDV的膜糖蛋白,该蛋白对病毒的装配和成熟起重要作用,同时也是病毒刺激机体产生免疫保护抗体的重要结构蛋白,在PEDV膜蛋白的组装过程中发挥重要作用,M蛋白可以介导细胞融合,能诱导宿主产生无中和活性的特异性抗体,同时还能间接诱导α-干扰素的表达,研究M基因有助于了解各PEDV毒株间M基因的差异和PEDV的流行变异情况[11-13],但贵州的PEDV毒株间M基因是否存在差异和PEDV的流行变异情况尚无报道。笔者对N-GZ株的M全基因进行了克隆和序列分析并与NG株和CV777株进行分析比较,了解其变异情况,以期为猪场对PEDV的免疫防控提供参考。
1 材料与方法
1.1 材料
病毒材料采自贵阳市某猪场腹泻仔猪的大、小肠及其内容物,DL2000 Marker、Prime Script One Step RT-PCR Kit VER 2.0、PMD19-T Simple Vector 购于大连宝生物公司,Gel Extraction Kit 购自北京庄盟国际生物有限公司,Plasmid Miniprep Kit 采购于OMEGA公司,其余试剂皆为国产分析纯。
1.2 RNA的提取
将采集的病毒材料充分研磨,反复冻融3次后匀浆,4℃ 12 000 r/min 离心10 min,取上清,根据Prime Script One Step RT-PCR Kit VER 2.0说明书提取RNA,保存于-20℃备用。
1.3 引物的设计与合成
用王伟丞等[14]设计的引物对目的片段进行扩增,预计扩增片段大小为681 bp,上游引物为5′-TCGGAATTCATGTCTAACGGTTCT-3′,下游引物为5′-ACGCTCGAGTTAGACTAAATGAAG-3′。
1.4 RT-PCR 扩增
以提取的核酸为模版,用上述引物对目的片段进行扩增,反应体系为25 μL:模版3 μL,2×1 Buffer 12.5 μL,上下游引物各0.5 μL,One Step Enzyme Mix 1 μL,RNase Free H2O 8 μL。反应条件为50℃反转录40 min;94℃预变性5 min;94℃变性 30 s,55℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。用1.5%的琼脂糖凝胶对其进行电泳检测。
1.5 目的基因的克隆与序列分析
用Gel Extraction Kit胶回收试剂盒对目的产物进行回收纯化,将纯化产物用常规方法连接至pMD19-T载体,并转化到Top10感受态细胞,在37℃恒温箱过夜培养后挑取阳性菌落于含有氨苄的LB营养液中,于37℃摇床中培养10 h,用试剂盒提取质粒,通过质粒PCR对其进行鉴定。将鉴定为阳性的克隆质粒送至大连宝生物公司进行测序。用DNA Star 软件对N-GZ、GZ和M基因进行氨基酸序列的多重比对,用DNA Star软件对M基因进行核酸序列相似性分析,用SignalP在线软件分别对N-GZ株、GZ株和CV777株的M蛋白信号肽进行预测,用KinasePhos软件预测其磷酸化位点,用ProtParam预测M蛋白的亲疏水性,用Protean软件对M蛋白的二级结构预测,用TMHMM Server v. 2.0对其跨膜螺旋区预测。
2 结果与分析
2.1 目的片段的扩增与克隆质粒的鉴定
琼脂糖凝胶电泳结果显示,通过RT-PCR获得与目的片段大小一致的681 bp片段,表明成功扩增M基因,通过质粒PCR对克隆的质粒进行鉴定,结果显示克隆成功(图1)。测序结果表明,克隆的目的片段大小为681 bp,说明成功克隆了PEDV的M基因。
2.2M基因的生物信息学
2.2.1 PEDVM基因的相似性 新分离株(用N-GZ表示)与王伟丞等[14]分离的PEDV株(用GZ表示)M基因的核苷酸序列相似性为98.5%,与CV777株的相似性为96.7%,GZ株与CV777相似性为98.2%,与NCBI上公布的其他PEDV分离株M基因相似性为95.8%~98.5%,说明M基因较为保守。
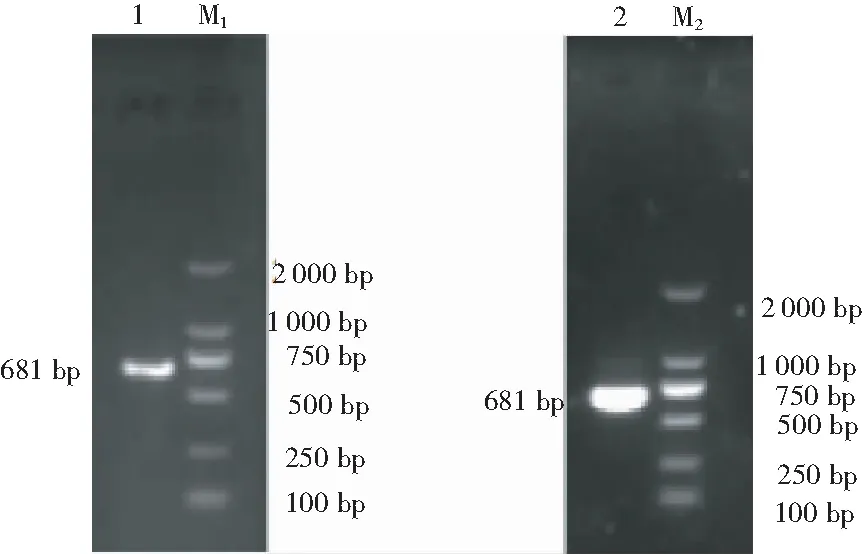
注:1:扩增的目的片段;2:质粒PCR产物;M1, M2:DL2000 Marker
Note: 1: Amplification product of purpose segment; 2: Plasmid PCR product; M1, M2: DL2000 Marker.
图 1M基因的扩增产物和克隆质粒的PCR 鉴定图谱
Fig.1 Amplification product ofMgene and PCR identification of cloned plasmid
2.2.2 遗传进化树的构建 基于PEDVM基因的核苷酸序列,用MEGA5.0软件构建遗传进化树(图2)。构建的进化树显示,N-GZ株与GZ株位于同一进化分支,N-GZ与CV777株位于不同进化分支且遗传进化关系较远。

图2 基于M基因核酸序列构建的遗传进化树
Fig.2 Phylogenetic tree constructed according to the nucleotide sequence ofMgene

图3 M基因氨基酸序列的多重比对
Fig.3 Multiple alignment of amino acid sequence forMgene
2.2.3 目的基因的多重序列比对 如图3所示,N-GZ株与CV777株M基因编码的第3、11、13、16、32、42、214、225位氨基酸有差异,与GZ株的第3、11、16、32、225位氨基酸有差异。
2.2.4M基因序列翻译后的加工修饰预测 3株毒株均不存在信号肽,3株PEDV毒株M基因编码的膜糖蛋白存在19个丝氨酸磷酸化位点、18个苏氨酸磷酸化位点、9个酪氨酸磷酸化位点。3株毒株均为疏水蛋白质。
2.2.5 目的蛋白二级结构的预测 对N-GZ、GZ和CV777毒株的M蛋白的二级结构预测表明,N-GZ株的M蛋白存在10个α螺旋、16个β折叠、9个T-转角、9个无规卷曲;GZ株的M蛋白存在10个α螺旋、16个β折叠、10个T-转角、10个无规卷曲;CV777毒株的M蛋白存在10个α螺旋、18个β折叠、10个T转角、9个无规卷曲。3株毒株的M蛋白皆存在3个跨膜螺旋区。
3 结论与讨论
为了解贵州省PEDV的遗传变异情况,对N-GZ株的M基因进行了克隆测序和生物信息学分析。基于核酸序列进行的相似性分析发现,N-GZ株与其他毒株的相似性为95.8%~98.5%,与GZ株的相似性为98.5%,与CV777毒株的相似性为96.7%。基于M基因核酸序列构建的进化树显示,CV777与2株贵州PEDV毒株均不在同一进化分支,从进化树看,二者与疫苗株遗传距离较远。N-GZ株与GZ株位于同一进化分支,说明在2个不同猪场暴发的PEDV为同一毒株。有资料表明,M蛋白N端的第1~19位氨基酸为有效表位抗原区,其核心序列为第5~16位氨基酸[15]。对M基因氨基酸序列进行多重序列比对发现,与CV777株在M蛋白N端的抗原表位区存在3个氨基酸的差异,与GZ株相比存在2个氨基酸的突变,这些差异和突变可能致使B细胞对PEDV的识别和处理能力发生改变,由此影响机体针对PEDV抗体的产生。除此之外,N-GZ与GZ株还存在3个氨基酸的差异,与CV777株存在5个氨基酸的差异。针对这些差异,预测3株毒株的二级结构发现,仅β折叠、无规卷曲和T-转角的数目有差异,但该差异是否会导致M蛋白功能的变化还有待进一步研究。
[1] Jun-Li Yang, Basanta Dhodary, Thi Kim Quy Ha, et al. Three new coumarins from Saposhnikovia divaricata and their porcine epidemic diarrhea virus (PEDV) inhibitory activity[J]. Tetrahedron, 2015, 71: 4651-4658.
[2] 郑逢梅,霍金耀,赵 军,等.2010—2012年华中地区猪流行性腹泻病毒分子特征和遗传进化分析[J].病毒学报,2013(2):197-205.
[3] 秦毅斌,卢冰霞,赵 武,等.猪流行性腹泻病毒变异毒株与经典毒株RT-PCR鉴别检测方法的建立及应用[J].中国兽医科学,2014(5):509-514.
[4] 吴玉璐,程 群,虞凌雪,等.猪流行性腹泻病毒RT-PCR鉴别诊断方法的建立[J].中国农业科学,2013(20):4370-4377.
[5] 陈申秒,牛成明,何福庆,等.猪流行性腹泻病毒研究进展及疫苗应用前景[J].中国畜牧兽医,2014(3):223-229.
[6] 胡青松,李吕木,张小飞,等.猪流行性腹泻病毒COE基因在毕赤酵母中的表达及生物活性分析[J].畜牧兽医学报,2014(8):1342-1347.
[7] 付梦瑾,朱 玲,吴云飞,等.猪流行性腹泻病毒的分离鉴定及增殖规律[J].中国兽医科学,2013(11):1133-1139.
[8] 王隆柏,林裕胜,车勇良,等.猪流行性腹泻病毒S、N和ORF3基因的遗传变异分析[J].畜牧兽医学报,2014(11):1830-1836.
[9] 杨德全,鞠厚斌,葛菲菲,等.猪流行性腹泻病毒研究现状[J].畜牧与兽医,2013(8):110-113.
[10] 施 标,董世娟,朱于敏,等.中国猪流行性腹泻病毒分子流行病学研究进展[J].中国农业科学,2013(20):4362-4369.
[11] 牛俊超,黄复深,胡佩佩.猪流行性腹泻研究进展[J].动物医学进展,2014(10):107-110.
[12] 高君恺,刘浩飞,杨 倩.猪流行性腹泻病毒的研究进展[J].南京农业大学学报,2014(1):1-5.
[13] 赵梦姣,陈书民,成 岩,等.山东省部分地区猪流行性腹泻流行病学调查及其M基因遗传变异分析[J].中国兽医学报,2013(10):1504-1508.
[14] 王伟丞,曾智勇,梁海英,等.猪流行性腹泻病毒贵州株的分离及M基因序列分析[J].贵州农业科学,2014(6):101-103.
[15] 高慎阳,王 珅,周铁忠,等.PEDVM蛋白N端的1~20aa的序列结构与功能分析[J].黑龙江畜牧兽医,2010(15):119-120
(责任编辑: 刘忠丽)
Separation and Bioinformatics Analysis of PEDVMGene
DAI Zhenjiang1, LIANG Haiying1, ZENG Zhiyong1*, TANG Deyuan1, WANG Weicheng2, LIU Zhao1
(1.CollegeofAnimalScience,GuizhouUniversity,Guiyang,Guizhou550025; 2.GuizhouAnimalEpidemicDiseaseControlCenter,Guiyang,Guizhou550025,China)
In order to know the mutation of Guizhou PEDV, theMgene was cloned, sequenced and analyzed by bioinformatics software in this study. Results: Phylogenetic tree showed that the current separated PEDV strain (N-GZ) and the previous separated PEDV (NG ) were in the same branch, the N-GZ and the vaccine strain CV777 were in the different branches.The similarity of the N-GZ and GZ was 98.5%, it suggested that the two PEDV strains appeared in two different pig farms were the same PEDV strain. The result of sequence alignment showed that there were three amino acids to be different in the M protein epitope domain of N-GZ and CV777 and two amino acids to be different with GZ. TheMgene is a conserved gene of PEDV, but a certain extent mutation appeared in epitope domain ofMgene from N-GZ strain.
PEDV; M protein; mutation; bioinformatics
2015-08-19; 2016-03-01修回
贵州省农业科技攻关项目“贵州省规模化猪场猪繁殖障碍性疫病防控体系的研究与示范”[黔科合NY字(2010)3042];贵州省动物疫病防控与兽医公共卫生保障科技创新人才团队[黔科合人才团队(2015)4016]
代振江(1991-),男,在读硕士,研究方向:动物传染病病原分子生物学。E-mail:792128405@qq.com
*通讯作者:曾智勇(1978-),男,教授,博士,从事动物传染病病原分子生物学研究。E-mail:as.zyzeng@gzu.edu.cn
1001-3601(2016)04-0152-0028-03
S828
A
