cAMP反应元件结合蛋白基因与中国北方汉族人群精神分裂症关联研究
2016-02-24白丽娟王继禹张克让武克文
白丽娟,王继禹,徐 勇,王 艳,张克让,武克文*
(1.山西省荣军精神康宁医院,山西 太谷 030800;2.山西医科大学第一医院,山西 太原 030001
论著·临床
cAMP反应元件结合蛋白基因与中国北方汉族人群精神分裂症关联研究
白丽娟1,王继禹1,徐 勇2,王 艳1,张克让2,武克文1*
(1.山西省荣军精神康宁医院,山西 太谷 030800;2.山西医科大学第一医院,山西 太原 030001
目的 探讨cAMP反应元件结合蛋白基因多态性与中国北方汉族人群精神分裂症之间的关系。方法 据《精神障碍诊断与统计手册(第4版)》(DSM-IV)诊断标准收集山西省荣军精神康宁医院和山西医科大学第一医院精神卫生科门诊及住院部符合精神分裂症诊断标准的患者为研究组,同期收集符合入组标准且不符合排除标准的健康成年人为对照组,运用连接酶检测-聚合酶连锁反应(LDR-PCR)方法检测1 230例精神分裂症患者和1 120例健康成年人的CREB基因上单核苷酸多态性(SNP)rs6740584及rs10932201的等位基因和基因型分布情况,确定其与精神分裂症是否相关。结果 rs6740584位点的基因型和等位基因在研究组和对照组间差异均无统计学意义(χ2=1.236,P=0.266;χ2=2.720,P=0.257);rs10932201位点的基因型和等位基因在研究组和对照组间差异均无统计学意义(χ2=2.017,P=0.156;χ2=3.779,P=0.151);两组rs6740584与rs10932201在不同模型下的频率分布均无统计学意义(P均>0.05)。结论 CREB基因rs6740584及rs10932201多态性与中国北方汉族人群精神分裂症无关联。
cAMP反应元件结合蛋白;精神分裂症;基因多态性
精神分裂症病因复杂,到目前为止其发病危险因素尚未完全阐明,有研究认为大脑神经发育障碍导致脑内存在微小的病理变化是发病的基础;遗传和环境因素在精神分裂症的发病过程中起重要作用[1]。尽管病因复杂,但识别其可疑遗传因素及生物环路仍显得尤为重要。
转录因子环磷腺苷反应元件结合蛋白(Cyclic adenosine monophosphate response element binding protein,CREB)于1986年被Montminy等[2-3]发现,并从未分化的PC12细胞及小鼠脑组织中获取[4]。磷酸化的CREB可增强多种靶基因的表达[5],CREB基因位于2q34,是DNA活性转录因子家庭中的成员,被认为是神经元总的存活程序的可能调节物,在中枢神经系统中起着关键作用,动物研究显示CREB在长时记忆形成中发挥重要作用[6]。1999年Kawanishi等[7]发现精神分裂症患者CREB基因存在两个突变位点(-933T→C和-413G→A),这两个位点分别位于启动子区域,携带-933T→C位点的患者除具有一般临床表现外,还具有一些特殊症状,说明该突变位点可能会影响基因功能。Forero等[8]综合各种生物实验和证据识别可能参与cAMP/PKA/CREB功能环路的可疑基因,通过对CREB等7种基因的48个单核苷酸多态性(Single nucleotide polymorphism, SNP)进行分析发现,CREB基因与精神分裂症无关联,但目前有研究发现在双相障碍及精神分裂症患者中CREB功能异常,Ren等[9]对大脑前额叶皮层及扣带回区域的CREB蛋白、mRNA的表达及功能进行了研究,结果显示精神分裂症患者大脑扣带回CREB蛋白、mRNA的表达及功能均低于对照组,提示大脑扣带回CREB异常可能与精神分裂症有关。由此推测CREB基因也可能参与了CREB功能异常过程,可能与精神分裂症相关。目前关于CREB基因多态性与精神分裂症关联的研究报道很少,为进一步探讨CREB基因多态性与精神分裂症的相关性进行本研究。
1 对象与方法
1.1 对象
研究组为2012年1月-2014年6月在山西省荣军精神康宁医院住院部、山西医科大学第一医院门诊及住院部就诊的精神分裂症患者。入组标准:①符合《精神障碍诊断与统计手册(第4版)》(Diagnostic and Statistical Manual of Mental Disorders, fourth edition, DSM-IV)精神分裂症诊断标准;②年龄18~55岁;③中国汉族;④阳性和阴性症状量表(Positive and Negative Syndrome Scale,PANSS)评分≥60分;⑤患者本人及其监护人对本研究知情同意并签署知情同意书。排除标准:①有严重的躯体或神经系统疾病者;②躯体疾病或神经系统疾病所致精神障碍者;③物质滥用或依赖者。符合入组标准且不符合排除标准共1 230例,其中男性739例(60.08%),女性491例(39.92%);平均年龄(47.3±11.6)岁。对照组为2012年1月-2013年12月在山西省荣军精神康宁医院及山西医科大学第一医院招募的健康成年人,包括正常志愿者、与患者无血缘关系的家属、实习生及医院职工。入组标准:①年龄18~55岁;②对本研究知情同意并签署知情同意书。排除标准:①有精神疾病史者;②有重大躯体疾病史以及药物滥用史者。符合入组标准且不符合排除标准共1 120例,其中男性633例(56.52%),女性487例(43.48%);平均年龄(45.2±10.1)岁。两组性别(t=-1.941,P>0.05)差异无统计学意义,年龄(t=-4.682,P<0.01)差异有统计学意义。本研究经山西省荣军精神康宁医院伦理委员会审核批准。
1.2 方法
1.2.1 DNA提取
所有受试者的血样标本全部采用K2EDTA导管进行收集。使用血样DNA提取工具(Tiangen Biotech,中国北京)从150 uL外周血中提取基因组DNA,提取结束后将DNA标本保存于-80°超低温冰箱用于基因型分析。
1.2.2 选择检测位点
通过查询NCBI网站(http://www.ncbi.nlm.nih.gov),查到CREB中等位基因频率>0.30的SNP(rs6740584、rs10932201),且该位点在中国人群中已有研究。
1.2.3 SNP基因分型
每个SNP的基因型使用上海Biowing Applied Biotechnology Co.Ltd(www.biowing.com.cn) 连接酶检测-聚合酶连锁反应Ligase Detection Reaction-Polymerase Chain Reaction(LDR-PCR)方法。从临床样本中提取的DNA首先通过多样化的PCR方法获得PCR产物,包含所要测序的SNP位点。PCR产物和LDR探针被用于进行多样化的LDR反应,之后通过DNA序列分析仪检测得到产物。为了检测这个操作的有效性,大约10%的样本被随机抽取后使用相同的步骤进行重测,结果显示重测样本与大样本的结果一致。
1.3 统计方法
采用PLINK统计学软件(http://pngu.mgh.harvard.edu/purcell/plink)进行Hardy-Weinberg equilibrium(HWE)检测、病例组和对照组基因型及等位基因频率计算,采用SPSS 17.0软件对病例组及对照组多态性位点不同模型进行比较。
2 结 果
2.1 H-W平衡检验
rs6740584(χ2=2.174、χ2=0.048)、rs10932201(χ2=0.523、χ2=0.838)多态性在研究组和对照组均符合H-W平衡(P均>0.05)。
2.2 两组rs6740584基因型和等位基因频率比较
研究组与对照组rs6740584位点的基因型比较差异无统计学意义(P>0.05),等位基因频率两组比较差异也无统计学意义(P>0.05)。见表1。
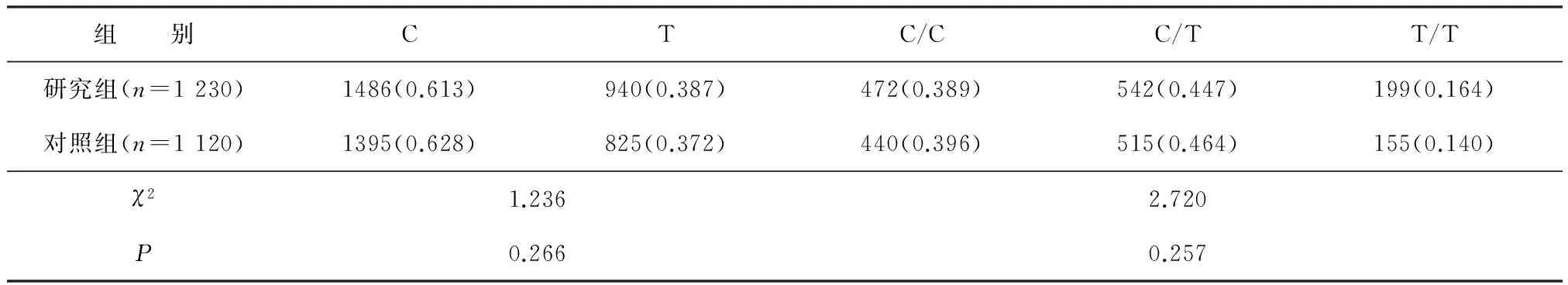
表1 两组CREB rs6740584基因型和等位基因频率比较
注:C为胞嘧啶,T为胸腺嘧啶
2.3 两组rs6740584显性及隐性模型下频率比较
研究组与对照组CC+CT/TT模型频率比较差异无统计学意义(P>0.05),CC/CT+TT模型频率两组比较差异也无统计学意义(P>0.05)。见表2。
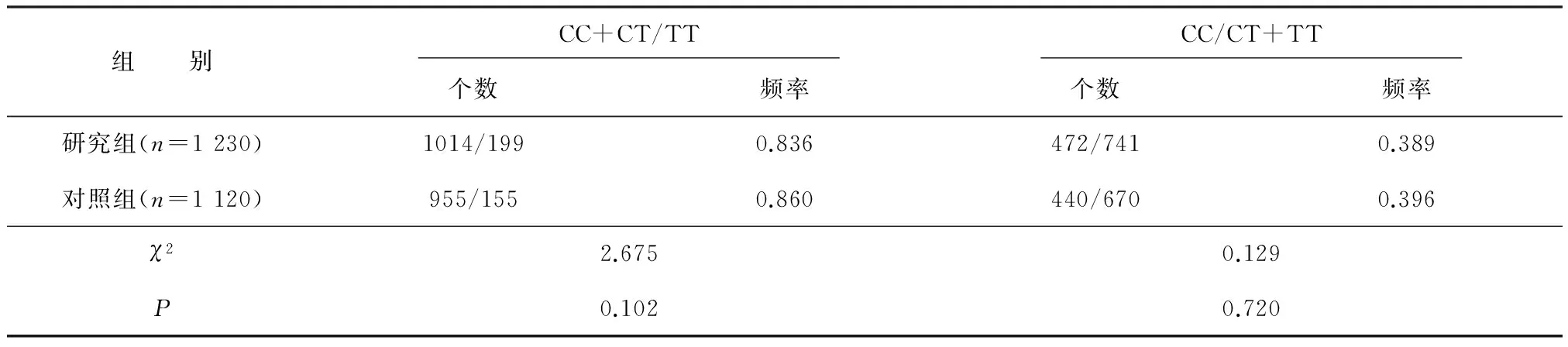
表2 两组CREB rs6740584不同模型下比较
注:C为胞嘧啶,T为胸腺嘧啶
2.4 两组rs10932201基因型和等位基因频率比较
研究组与对照组rs10932201位点的基因型比较差异无统计学意义(P>0.05),等位基因频率两组比较差异也无统计学意义(P>0.05)。见表3。

表3 两组CREB rs10932201基因型和等位基因频率比较
注:A为腺嘌呤,G为鸟嘌呤
2.5 两组rs10932201显性及隐性模型下频率比较
研究组与对照组AA+AG/GG模型频率比较差异无统计学意义(P>0.05),AA/AG+GG模型频率两组比较差异也无统计学意义(P>0.05)。见表4。
3 讨 论
CREB是胞内与抑郁相关的几个信号转导通路中的一个交汇点[10-11],环磷酸腺苷(cAMP)通路、丝裂原活化蛋白激酶(MAPK)通路、钙依赖蛋白激酶(CaMK)通路和葡萄糖合激酶3(GSK-3)通路形成了CREB的4条上游通路,这4条通路最终调节其下游通路的脑源性神经营养因子(brain derived neurotrophic factor,BDNF)等基因的表达,影响神经元的可塑性及神经递质的合成[12]。CREB作为一种真核生物细胞核内调控因子,在神经元再生、突触可塑性及学习记忆等方面具有重要调节作用,CREB被认为与早期海马祖细胞分化、存活和迁移有关[20-21]。
1999年Kawanishi等[7]发现携带CREB-933T→C突变位点的精神分裂症患者除具有一般临床表现外,还具有一些特殊症状。本研究结果发现无论是rs6740584还是rs10932201,其基因型和等位基因频率均无统计学差异,之后研究人员建立显性模型与隐性模型进行比较,同样未发现任何阳性结果,这与Forero等[8]的研究结果基本一致。本研究在一定程度上表明中国北方汉族人群精神分裂症可能与CREB基因多态性无关,而与发病过程中的其他影响因素有关,由于本研究设计之初是为了证实CREB基因多态性是否与精神分裂症自杀行为相关,经查阅文献未发现-933T→C突变位点与自杀行为相关,故未对该位点进行研究,在未来的研究中我们将进一步研究是否携带CREB-933T→C突变位点的中国人群也具有上述特殊症状。
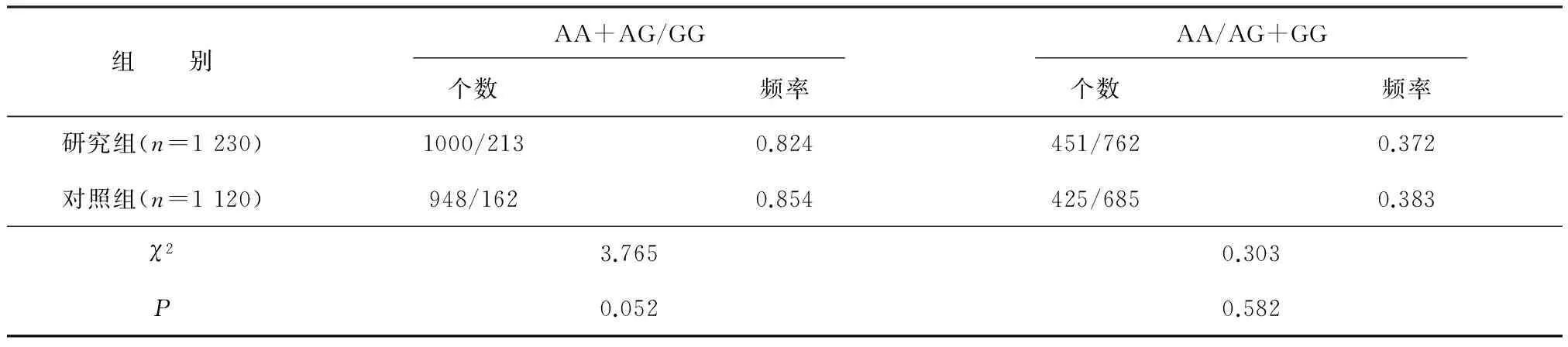
表4 两组CREB rs10932201不同模型下比较
注:A为腺嘌呤,G为鸟嘌呤
众多神经细胞内信号转导通路均能交汇并参与诱导CREB的激活,且CREB的总蛋白量能被某些外界因素调节,例如应激因素或某些人为刺激因素[13-15],而仅有磷酸化的CREB(phospho-CREB,pCREB) 方能作为转录激活因子发挥作用。CREB蛋白含有许多磷酸化位点,其中Ser-133的磷酸化位点尤为重要,当CREB蛋白的Ser-133点突变时,将导致CREB蛋白的失活[16]。除此之外Lee等[17]研究发现抗抑郁药对CREB磷酸化也有影响。CREB分子中与其转录活性相关的功能结构域包括KID区、X区、α区、Q1区、Q2区,其中KID区含有大量蛋白激酶磷酸化位点,因此,KID区的磷酸化是CREB活化的关键,并且仅在CREB活化后通过暴露Q1和Q2区,才能诱导相关目的基因转录的发生[22]。
既往研究发现精神分裂症及双相情感障碍患者CREB蛋白功能存在异常,Ren等[9]在既往研究基础上对CREB在精神分裂症及双相情感障碍患者背外侧前额叶皮质和扣带回区域的mRNA及CREDNA表达及功能进行研究,发现精神分裂症患者扣带回CREB、mRNA及CREDNA表达下降。动物模型显示DISC1(Disrupted in Schizophrenia 1)作为内表型与精神分裂症相关[18],进一步研究显示敲除DISC1后使CREB蛋白活性增强[19]。
综上所述,CREB活化受许多因素影响,精神分裂症脑区蛋白表达下降可能与应激、外界刺激和DNA甲基化等因素有关,今后将进一步了解可能影响CREB表达及信号转导通路的因素,深入了解其内在机制,继续探索精神分裂症发病机理,为其早期预防奠定基础。
[1] Owen MJ. Implications of genetic findings for understanding schizophrenia[J]. Schizophr Bull, 2012, 38(5): 904-907.
[2] Montminy MR, Bilezikjian LM. Binding of a nuclear protein to the cyclic-AMP response element of the somatostatin gene[J]. Nature, 1987, 328(6126): 175-178.
[3] Yamamoto KK, Gonzalez GA, Biggs WH, et al. Phosphorylation-induced binding and transcriptional efficacy of nuclear factor CREB[J]. Nature, 1988, 334(6182): 494-498.
[4] 宋海龙, 郑焱, 王晓民. CREB信号通路在神经系统中的调控及功能[J]. 中国生物化学与分子生物学学报, 2013, 29(9): 797-804.
[5] 余瑞元, 王燕峰, 徐长法. CREB研究进展[J]. 中国生物工程杂志, 2003, 23(1): 39-42.
[6] 葛军, 张玉, 郑增长, 等. CREB转录因子及其磷酸化信号通路的研究进展[J]. 安徽农业科学, 2010, 38(30): 16769-16771, 16774.
[7] Kawanishi Y, Harada S, Tachikawa H, et al. Novel variants in the promoter region of the CREB gene in schizophrenic patients[J]. J Hum Genet, 1999, 44(6): 428-430.
[8] Forero DA, Herteleer L, De Zutter S, et al. A network of synaptic genes associated with schizophrenia and bipolar disorder[J]. Schizophr Res, 2016, 172(1-3): 68-74.
[9] Ren X, Rizavi HS, Khan MA, et al. Alteration of cyclic-AMP response element binding protein in the postmortem brain of subjects with bipolar disorder and schizophrenia[J]. J Affect Disord, 2014, 152-154: 326-333.
[10] 刘纪猛, 李恒芬, 谢正. 抑郁模型大鼠中枢G蛋白的研究[J]. 中国神经精神疾病杂志, 2009, 35(2): 108-110.
[11] Nibuya M, Nestler EJ, Duman RS. Chronic antidepressant administration increases the expression of cAMP response element binding protein (CREB) in rat hippocampus[J]. J Neurosci, 1996, 16(7): 2365-2372.
[12] 卢峻, 杨秀岩, 华茜, 等. CAMP反应元件结合蛋白: 抗抑郁信号转导通路的交汇点[J].生理科学进展, 2008, 39(4): 371-374.
[13] Stern CM, Meitzen J, Mermelstein PG. Corticotropin-releasing factor and urocortin I activate CREB through functionally selective G beta gamma signaling in hippocampal pyramidal neurons[J]. Eur J Neurosci, 2011, 34(5): 671- 681.
[14] 王凌霄, 彭代辉, 黄建华, 等. CREB磷酸化水平在慢性应激模型大鼠中表达研究[J]. 中国神经精神疾病杂志, 2014, 40(1): 26-30.
[15] 林栋, 赖新生, 张宏, 等. 基于多元统计分析的针刺效应对不同脑区CREB/p-CREB表达时空分布特征分析[J]. 中华中医药杂志, 2014, 29(10): 3286-3291.
[16] Lamph WW, Dwarki VJ, Ofir R, et al. Negative and positive regulation by transcription factor cAMP response element- binding protein is modulated by phosphorylation[J]. Proc Natl Acad Sci USA, 1990, 87(11): 4320-4324.
[17] Lee MG, Oh D, Choi MR, et al. NCAM140 and pCREB Expression after Tianeptine Treatment of SH-SY5Y Cells[J]. Psychiat Invest, 2014, 11(3):313-318.
[18] Kelly MP, Brandon NJ. Taking a bird's eye view on a mouse model review: a comparison of findings from mouse models targeting DISC1 or DISC1-interacting proteins[J]. Future Neurol, 2011, 6(5): 661-677.
[19] Wei J, Graziane NM, Wang H, et al. Regulation of N-Methyl-D-Aspartate Receptors by Disrupted-in-Schizophrenia-1[J]. Biol Psychiatry, 2014, 75(5): 414-424.
[20] Merz K, Herold S, Lie DC. CREB in adult neurogenesis-master and partner in the development of adult-born neurons?[J]. Eur J Neurosci, 2011, 33(6): 1078-1086.
[21] Kandel ER. The molecular biology of memory: CAMP, PKA, CRE, CREB-1, CREB-2, and CPEB[J]. Mol Brain, 2012, 5: 14.
[22] Alberini CM. Transcription factors in long-term memory and synaptic plasticity[J]. Physiol Rev, 2009, 89(1): 121-145.
(本文编辑:陈 霞)
Association between a polymorphism in the promoter region of the cAMP (response element binding protein) gene and schizophrenia in north han Chinese patients
BaiLijuan1,WangJiyu1,XuYong2,WangYan1,ZhangKerang2,WuKewen1*
(1.ShanxiRongjunPsychiatricCorelleHospital,Taigu030800,China; 2.FirstHospitalofShanxiMedicalUniversity,Taiyuan030001,China
*Correspondingauthor:WuKewen,E-mail:sxtgwkw@126.com)
Objective To explore the association between a polymorphism in the promoter region of the cAMP (response element binding protein) gene and schizophrenia in north han Chinese patients.Methods Recruited inpatients and outpatients who conform to the diagnostic criteria of schizophrenia with DSM-IV from Shanxi Rongjun Psychiatric Corelle Hospital and First Hospital of Shanxi Medical University were study group, at the same time, collected health adults formed the control group. Ligase Detection Reaction-Polymerase Chain Reaction (LDR-PCR) was used to detect the rs6740584 and rs10932201 polymorphism of CREB in 1 230 schizophrenia patients and 1 120 health adults. The allele, genotype distribution and different model of CREB gene SNP were detected to determine the association between CREB and schizophrenia.Results No significant distribution difference of the genotype and allele of rs6740584 and rs10932201 of CREB were found between two groups (χ2=1.236,P=0.266;χ2=2.720,P=0.257;χ2=2.017,P=0.156;χ2=3.779,P=0.151).Conclusion No association is found between CREB SNP rs6740584 or rs10932201 and schizophrenia in north han Chinese population sample.
Cyclic adenosine monophosphate response element binding protein; Schizophrenia; Gene polymorphism
优抚医院部级课题(2012MZBAJ030);山西省卫生厅课题(201302054)
R749.3
A
10.11886/j.issn.1007-3256.2016.06.006
2016-10-10)
*通信作者:武克文,E-mail:sxtgwkw@126.com)
