玉米秸秆与废弃白菜的混贮品质及乳酸菌多样性研究
2016-02-23任海伟赵拓李金平李雪雁徐娜王永刚王晓力高晓航
任海伟,赵拓,李金平,李雪雁,徐娜,王永刚,王晓力,高晓航
(1.兰州理工大学西部能源与环境研究中心,甘肃 兰州 730050;2.兰州理工大学生命科学与工程学院,甘肃 兰州 730050;
3.西北低碳城镇支撑技术协同创新中心,甘肃 兰州 730050;4.中国农业科学院兰州畜牧与兽药研究所,甘肃 兰州 730050)
玉米秸秆与废弃白菜的混贮品质及乳酸菌多样性研究
任海伟1,2,3,赵拓2,李金平1,3*,李雪雁2,徐娜2,王永刚2,王晓力4,高晓航2
(1.兰州理工大学西部能源与环境研究中心,甘肃 兰州 730050;2.兰州理工大学生命科学与工程学院,甘肃 兰州 730050;
3.西北低碳城镇支撑技术协同创新中心,甘肃 兰州 730050;4.中国农业科学院兰州畜牧与兽药研究所,甘肃 兰州 730050)
摘要:为研究玉米秸秆和废弃白菜混合青贮可行性,考查二者在不同质量比时的混贮品质,设计了6个不同的混贮比例,分别为29∶19,27∶21,25∶23,23∶25,21∶27和19∶29。混合青贮30 d后对其化学组分和发酵品质进行分析,筛选品质最佳的混贮比例,并进一步研究了品质最佳混贮组的乳酸菌多样性。结果表明,质量比为21∶27的混贮5(ME5)组的pH和氨态氮/总氮显著低于其余混贮组(P<0.05),乳酸含量显著高于其余混贮组(P<0.05)。ME5组的干物质和能源组分综纤维素含量较高,而酸性洗涤木质素含量较低,综合判定该组的混贮品质优于其他5组。乳酸菌多样性结果显示,从ME5组中共分离出10株乳酸菌,分属于3个属,4个种。3个属分别是乳杆菌属、肠球菌属和明串珠菌属。4个种分别是2株短乳杆菌、1株屎肠球菌、5株肠膜明串珠菌肠膜亚种和2株植物乳杆菌,其中同型发酵乳酸菌乳杆菌属和肠球菌属为该青贮体系的关键乳酸菌。
关键词:玉米秸秆;废弃白菜;混合青贮;乳酸菌
青贮不仅是一种传统的动物饲草贮存方式,还可用于能源植物的贮存[1]。青贮是在厌氧条件下,利用原料表面附生微生物,以可溶性碳水化合物为底物转化为乳酸等有机酸,降低pH从而抑制有害微生物繁殖,达到长期贮存原料的目的[2-4]。玉米(Zeamays)秸秆多用作青贮饲料和沼气发酵原料,但因其季节性收获和农民耕作习惯等因素,秸秆大量收获时已变干黄或枯蔫,水分和营养物质大量流失,无法直接青贮。另一方面,废弃蔬菜富含水分和糖分,若能将其与秸秆进行混合贮存,则不仅能有效解决玉米秸秆的贮存问题,还能减少蔬菜废弃引发的环境污染。
有关玉米秸秆与其他原料的混合青贮研究已十分深入。杨道兰等[5]认为花椰菜(Brassicacapitata)茎叶与玉米秸秆混贮(质量比7∶3)能显著提高青贮料的可溶性碳水化合物、乳酸和丙酸含量,降低pH、丁酸含量。李树成等[6]认为随着白花草木樨(Melilotusalbus)比例增大,其与玉米秸秆混贮过程中的pH、氨态氮/总氮和粗蛋白含量呈升高趋势,乳酸、中性洗涤纤维和酸性洗涤纤维含量呈降低趋势。黄晓辉等[7]将苦豆子(Sophoraalopecuroides)和玉米秸秆混贮后发现,混贮料的pH、氨态氮/总氮和粗蛋白含量随苦豆子比例的升高而增加。究其原因,混贮品质的提高有赖于乳酸菌发酵作用,因此乳酸菌多样性研究对解析青贮品质变化具有重要意义。
近年来,16S rDNA序列分析技术被认为是乳酸菌分类鉴定和多样性研究的有效方法[4,8]。有学者从玉米、意大利多花黑麦草(Loliummultiflorum)、水稻(Oryzalatifolia)和尖叶胡枝子(Lespedezahedysaroides)的青贮料中分离得到植物乳杆菌(Lactobacillusplantarum)、短乳杆菌(Lactobacillusbrevis)、乳酸乳球菌(Lactococcuslactis)、肠膜明串珠菌(Leuconostopseudomesenteroides)、乳酸片球菌(Pediococcusacidilactici)、戊糖片球菌(Pediococcuspentosaceus)和粪肠球菌(Enterococcusfaecalis)[9-11]。也有学者从其他青贮料中鉴定出一些鲜见的乳酸菌。Cai等[12]从苏丹草(Sorghumvulgare)中分离了新种那须乳杆菌(Lactobacillusnasuensissp.nov.)。杨杨等[13]从藏北嵩草(Kobresialittledalei)中分离得到17株乳酸菌,其中6株为食窦魏斯氏乳酸菌(Weissellaconfusa),其余均为融合魏斯氏乳酸菌(Weissellacibaria)。司丙文等[14]从山竹岩黄芪(Hedysarumfruticosum)中分离得到1株乳酸菌为蒙氏肠球菌(Enterococcusmundtii)。
本研究以干玉米秸秆与废弃白菜(Brassicapekinensis)混合青贮为原料,旨在从化学组分和发酵品质角度分析不同质量比对二者混合青贮品质的影响,并利用传统培养法和16S rRNA序列分析技术相结合的方法对品质最佳混贮组的乳酸菌进行分离鉴定,为该混贮模式的实践推广奠定理论基础。
1材料与方法
1.1试验材料
干玉米秸秆取自甘肃省陇西县,玉米品种为豫玉,采集时间2013年10月,摘穗后田间留置1个月后收集,水分含量为28.47%;废弃白菜叶取自兰州市七里河区菜市场,水分含量为94.42%。细菌基因组DNA提取试剂盒购自美国Biomiga公司。2×Taq MasterMix购自上海美吉生物医药科技有限公司。DNA Marker-D购自上海生工生物工程股份有限公司。
1.2试验设计
根据青贮含水量为65%~75%的基本要求,将干玉米秸秆与废弃白菜按不同质量比(依次为29∶19,27∶21,25∶23,23∶25,21∶27和19∶29)进行混贮,混贮体系对应的水分含量为65%,67%,69%,71%,73%和75%,分别编号为ME1、ME2、ME3、ME4、ME5和ME6。每个试验组3个重复。
1.3青贮调制
将玉米秸秆切断至1~2 cm后与长宽为2 cm×2 cm废弃白菜按一定质量比例进行混合,混匀后装入1.5 L青贮瓶中。为减少原料空隙一边装填一边压实,25℃恒温密封贮存30 d。贮存时间为2013年11月至12月。
1.4分析方法
1.4.1理化指标分析准确称取50 g青贮料,按1∶10比例加入蒸馏水混合打浆,过滤后对滤液和滤渣进行分析。干物质(dry matter,DM)测定采用105℃烘干法;中性洗涤纤维(neutral detergent fiber,NDF)、酸性洗涤纤维(acid detergent fiber,ADF)和酸性洗涤木质素(acid detergent lignin,ADL)测定采用ANKOMA200i全自动纤维分析仪;纤维素(cellulose,CL)、半纤维素(hemicellulose,HC)和综纤维素(holocellulose,HoC)含量由公式计算,CL=ADF-ADL,HC=NDF-ADF,HoC=CL+HC;氨态氮(ammonia nitrogen,AN)测定采用苯酚-次氯酸钠比色法[15];可溶性碳水化合物(water soluble carbohydrates,WSC)测定采用蒽酮硫酸法[16];乳酸(lactic acid,LA)测定采用SBA-40X生物传感器;总氮(total nitrogen,TN)测定采用凯氏定氮法[17];乙酸(acetic acid,AA)、丁酸(butyric acid,BA)等有机酸分析采用GC9790Ⅱ气相色谱仪,测试条件为进样口温度200℃,载气为高纯氮气(99.999%),不分流进样,升温程序:40℃保持2 min,以2℃/min升至100℃后保持5 min,再以10℃/min升至200℃,保持5 min。
1.4.2微生物分析无菌环境称取ME5组青贮料25 g加入到225 mL无菌生理盐水中,37℃恒温振荡2 h,将菌悬液进行梯度稀释,取10-3, 10-4和10-5三个稀释度液体各0.2 mL分别涂布于MRS(Man Rogosa Sharpe,乳酸细菌培养基)固体平板上,每个稀释度分别做3个重复, 37℃厌氧培养72 h。根据菌落的大小、光泽、透明程度等挑取MRS固体平板上不同的典型菌落分离纯化2~3次后,观察记录菌落形态并进行革兰氏染色和过氧化氢酶试验。
生理生化试验包括明胶液化、吲哚试验、硝酸盐还原、H2S产气、精氨酸水解、0.1%美兰还原、10和45℃生长、pH 4.5和pH 9.6生长、6.5% NaCl生长试验等[18]。采用糖微量发酵管法进行糖发酵试验。
参考乳酸菌通用引物进行细菌16S rDNA基因扩增,正向引物为27f:AGAGTTTGATCCTGGCTCAG[19];反向引物为1492r:CTACGGCTACCTTGTTACGA[20],上述引物由上海桑尼生物技术有限公司合成。细菌基因组DNA提取按照试剂盒说明进行,采用DYY11电泳仪进行DNA检测,并在MG96+PCR仪中进行PCR扩增,扩增体系为50 μL:2×Taq MasterMix 25 μL、上下游引物各2 μL、模板DNA 1 μL、RNase-Free Water 20 μL。反应条件为:94℃预变性2 min;94℃ 30 s,55℃ 30 s,72℃ 1 min 30 s,30个循环;72℃延伸10 min,4℃保存。预计扩增片段长度约为1600 bp。将未纯化PCR产物送上海生工生物工程技术服务有限公司测序。
同源性与系统发育分析:将测序结果利用DNAstar进行序列拼接处理,并与NCBI上Microbes Nucleotide数据库进行同源性比对分析,同时采用MEGA 5.1软件中的Clustal W对序列进行多重比较,利用邻位相连法构建系统发育树,采用Bootstrap法对进化树进行1000次重复统计验证,获得分类或系统发育地位。
1.5统计分析
利用SPSS 18.0软件对试验数据进行统计分析,对不同混合比例处理进行单因素方差分析,P<0.05代表数据存在显著性差异。
2结果与分析
2.1青贮原料的化学成分分析
由表1可知,玉米秸秆中干物质含量为71.53%,WSC含量为28.04%,CL和HC含量丰富,二者之和高达为53.76%。废弃白菜中水分含量丰富,高达94.42%,WSC含量为23.74%。因此,玉米秸秆与废弃白菜混贮能实现水分含量的互补性,弥补干秸秆水分缺失,达到青贮基本要求。

表1 青贮原料的化学成分(干物质基础)
由表2可知,玉米秸秆与废弃白菜按照不同比例混贮30 d后,与表1中原料相比,所有混贮组中的WSC含量显著下降(P<0.05),WSC被青贮过程中的乳酸菌等微生物繁殖代谢所利用。ME2组的DM含量显著高于其他混贮组(P<0.05),且DM高于50%,但该组ADL含量相对较高,仅次于ME6组。从能源物质组分HoC角度来看,ME1和ME5组的HoC含量显著高于其他组(P<0.05),但ME1和ME5组之间无显著差异。尽管6个混贮组之间的组分变化规律不明显,但总体上看ME5组的DM损失小,且HoC保存较好,ADL含量相对较低。
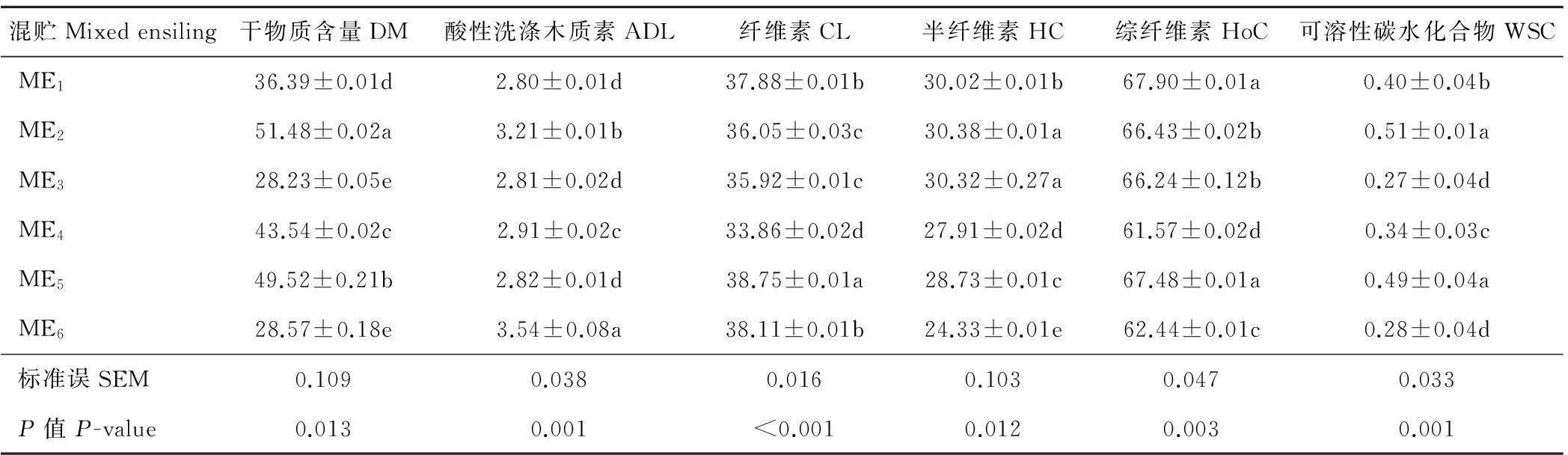
表2 不同质量比对混贮中化学组分的影响(干物质基础)
注:表中同列不同小写字母表示差异显著(P<0.05),下同。
Note: The means in the same column with different small letters indicate significant difference atP<0.05. The same below.
2.2发酵品质分析
由表3可知,6个试验组的pH均处于发酵品质优良的青贮pH 范围3.5~4.5,且随着废弃白菜比例的增加,混贮组中pH总体呈现先增加后减少的趋势。其中,ME5组中的pH和AN/TN最低,显著低于其他混贮组(P<0.05);且LA含量最高,显著高于其他组(P<0.05)。说明混贮过程中白菜的适当增加有利于乳酸菌的快速繁殖和pH快速下降。另一方面,6个混贮组中的AA和BA含量微弱,浓度均小于0.01%,推测玉米秸秆与废弃白菜的混贮过程以同型发酵为主,有利于减少干物质的损失。综合分析化学组分和发酵品质的结果,确定ME5组的贮存品质优于其他混贮组。
2.3乳酸菌的多样性分析
2.3.1形态学鉴定挑取MRS固体平板上直径2~3 mm、 白色或乳白色、 表面光滑凸起、 大小不一的菌落,经革兰氏染色为阳性,过氧化氢酶试验为阴性的菌株标记为乳酸菌,共分离到10株,编号为CSCWL1-2、CSCWL1-4、CSCWL1-6、CSCWL1-7、CSCWL1-11、CSCWL1-14、CSCWL1-16、CSCWL1-17、CSCWL1-18和CSCWL1-19。
2.3.2 生理生化鉴定 如表4可知,菌株CSC-WL1-2、CSCWL1-7、CSCWL1-17和CSCWL1-18为革兰氏阳性杆菌,过氧化氢酶试验、硝酸盐还原试验、明胶液化试验为阴性,不产生吲哚和硫化氢,pH4.5条件下能够正常生长,初步认定为乳杆菌属(Lactobacillus)。

表3 不同质量比对青贮发酵品质的影响Table3 Effectsofmixedproportiononfermentationcharacteristicsofsilages%DM混贮MixedensilingpH值pHvalue乳酸LA氨态氮/总氮AN/TN乙酸AA丁酸BAME13.85±0.03d18.62±0.05b1.60±0.02d<0.01<0.01ME24.03±0.15b14.69±0.03f2.65±0.10c<0.01<0.01ME33.96±0.06c16.37±0.02d1.12±0.15e<0.01<0.01ME43.94±0.08c17.81±0.06c2.81±0.19b<0.01<0.01ME53.72±0.03e20.76±0.11a1.11±0.19e<0.01<0.01ME64.32±0.05a15.87±0.05e3.24±0.27a<0.01<0.01标准误SEM0.0770.0570.161<0.001<0.001P值P-value0.0060.0030.026<0.001<0.001
从表5可知,菌株CSCWL1-4为革兰氏阳性球菌,过氧化氢酶试验、硝酸盐还原试验为阴性,0.1%美兰还原试验、pH 9.6和6.5% NaCl生长试验为阳性,在15和45℃条件下生长,符合肠球菌属(Enterococcaceae)的特征,初步确定为肠球菌属;菌株CSCWL 1-6、CSCWL 1-11、CSCWL 1-14、CSCWL 1-16和CSCWL 1-19为革兰氏阳性球菌,过氧化氢酶试验和硝酸盐还原试验为阴性, pH 9.6生长试验为阳性,0.1%美兰还原试验为阴性,在15℃条件下生长,45℃条件下不生长,根据以上结果暂不能在属水平上做出准确判断。

表4 乳杆菌属的鉴定结果
+:阳性Positive; -:阴性Negative. 下同The same below.

表5 球状乳酸菌的鉴定结果
由表6可知,菌株CSCWL 1-2和CSCWL 1-17在15℃条件下生长,45℃条件下不生长,能利用葡萄糖产酸产气,可发酵果糖产酸,水解精氨酸,显微镜下为短杆状,初步确定为异型发酵短乳杆菌(Lactobacillusbrevis)。菌株CSCWL 1-7和CSCWL 1-18能利用葡萄糖产酸但不产气,可发酵阿拉伯糖、麦芽糖、果糖、半乳糖、乳糖、麦芽糖、甘露醇、甘露糖、蜜二糖、棉籽糖、蔗糖和纤维二糖产酸,不能水解精氨酸,初步确定为植物乳杆菌(Lactobacillusplantarum)。结合表5和6结果,球状菌株CSCWL 1-4能在15℃、45℃、pH 9.6和6.5% NaCl条件下生长,0.1%美兰还原试验为阳性,精氨酸产氨,利用葡萄糖产酸但不产气,可发酵阿拉伯糖、果糖、半乳糖、蜜二糖、海藻糖、麦芽糖、纤维二糖和乳糖产酸,不能发酵松三糖和山梨醇,暂无法对其在种水平上进行判断。菌株CSCWL 1-6、CSCWL 1-11、CSCWL 1-14、CSCWL 1-16和CSCWL 1-19能利用葡萄糖产酸但不产气,所以均为同型发酵乳酸菌,不能发酵利用松三糖、鼠李糖和山梨醇,精氨酸产氨试验为阴性,符合明串珠菌属(Leuconostocaceae)的特征,暂无法在种水平上做出判断。故菌株CSCWL 1-4、CSCWL 1-6、CSCWL 1-11、CSCWL 1-14、CSCWL 1-16和CSCWL 1-19的鉴定结果需要结合16S rRNA序列分析技术进行准确判断。

表6 乳酸菌糖发酵试验结果
2.3.316S rRNA序列同源性分析提取10株乳酸菌的基因组DNA,电泳检测结果为单一清晰条带(图1),能满足PCR扩增条件,如图2所示,所扩增的目的片段条带清晰,长度约为1500 bp,满足测序要求。
将测序结果利用DNAstar软件进行拼接处理,并与Microbes Nucleotide数据库中已发表的细菌16SrRNA序列进行比对分析,找出与目的序列同源性最高的菌种,如表7所示。

图1 基因组DNA检测电泳图Fig.1 Electrophoresis picture of genome DNA detection

图2 PCR产物检测电泳图Fig.2 Electrophoresis picture of PCR products

菌株Strain登记号Accession最大分Maxscore总分Totalscore覆盖度Querycover(%)期望值E-value相似度Ident(%)相似性比对结果BlastresultCSCWL1-2NC_008497.1259712982990.099短乳杆菌LactobacillusbrevisCSCWL1-4NC_017960.1261415601990.099屎肠球菌EnterococcusfaeciumCSCWL1-6NC_008531.1261410456990.099肠膜明串珠菌肠膜亚种Leuconostocmesenteroidessubsp.mesenteroidesCSCWL1-7NC_004567.2255112740990.099植物乳杆菌LactobacillusplantarumCSCWL1-11NC_008531.1261010441990.099肠膜明串珠菌肠膜亚种Leuconostocmesenteroidessubsp.mesenteroidesCSCWL1-14NC_008531.12593103751000.099肠膜明串珠菌肠膜亚种Leuconostocmesenteroidessubsp.mesenteroidesCSCWL1-16NC_008531.1256610264990.099肠膜明串珠菌肠膜亚种Leuconostocmesenteroidessubsp.mesenteroidesCSCWL1-17NC_008497.12641132031000.099短乳杆菌LactobacillusbrevisCSCWL1-18NC_004567.2263813174990.099植物乳杆菌LactobacillusplantarumCSCWL1-19NC_008531.1262310493990.099肠膜明串珠菌肠膜亚种Leuconostocmesenteroidessubsp.mesenteroides
由表7可知,菌株CSCWL 1-2和CSCWL 1-17与短乳杆菌的同源性最高;菌株CSCWL 1-4与屎肠球菌的同源性最高;菌株CSCWL 1-6、CSCWL 1-11、CSCWL 1-14、CSCWL 1-16和CSCWL 1-19与肠膜明串珠菌肠膜亚种的同源性最高;菌株CSCWL 1-1和CSCWL 1-18与植物乳杆菌的同源性最高。
构建10株乳酸菌的系统发育树如图3所示。菌株CSCWL 1-7和CSCWL 1-18聚为第1类群,同时与其他乳杆菌属标准菌株亲缘关系较近;菌株CSCWL 1-2和CSCWL 1-17单独聚为一类,且与第1类群相似性达100%;菌株CSCWL 1-4聚为第2类群,且与其他肠球菌属标准菌株相似性达100%;菌株CSCWL 1-6、CSCWL 1-11、CSCWL 1-14、CSCWL 1-16和CSCWL 1-19聚为第3类群,且与其他明串珠菌属标准菌株亲缘关系较近。故确定菌株CSCWL 1-7和CSCWL 1-18为植物乳杆菌(Lactobacillusplantarum);菌株CSCWL 1-2和CSCWL 1-17为短乳杆菌(Lactobacillusbrevis);菌株CSCWL 1-4为屎肠球菌(Enterococcusfaecium);菌株CSCWL 1-6、CSCWL 1-11、CSCWL 1-14、CSCWL 1-16和CSCWL 1-19为肠膜明串珠菌肠膜亚种(Leuconostocmesenteroidessubsp.mesenteroides)。将分离的10株乳酸菌序列提交GenBank,所得注册号按菌株编号依次为KM985449~KM985458。

图3 16S rRNA序列系统进化树Fig.3 Phylogenetic tree based on the 16S rRNA sequence 图中分支数字表示Bootstrap验证中该分支可信度百分数;标尺表示序列差异度。Numbers in tree branch represent percentage of confidence for each branch; scale represent difference in sequence.
3讨论
原料中WSC和水分是青贮发酵的必备条件,适宜的WSC和水分含量有利于乳酸生成和pH的快速下降。本研究中玉米秸秆与废弃白菜的水分含量具有良好互补性,且WSC含量较高,二者混贮可实现水分含量的互补,从而达到青贮基本要求[21]。另一方面,CL是由β-(1→4)-D-葡聚糖链聚合形成的亚晶体聚合物,HC则包括木葡聚糖、木聚糖、甘露聚糖、葡甘露聚糖以及β-(1→3,1→4)葡聚糖等多糖。玉米秸秆中的CL和HC含量高达53%以上,这2种组分是生物能源转换过程中微生物或酶降解的重要底物。因此,CL和HC的高保存率是评价混贮过程中化学组分变化的主要指标之一,即HoC含量越高意味着可转化为生物能源的潜力越大。另一方面,CL与HC和ADL相互交联形成木质纤维网络结构,ADL的存在对CL和HC的生物降解有屏障作用[22]。表2中显示,ME5组的DM含量为49.52%,且DM和HoL含量较高,ADL相对较低,贮存过程中的能源组分损失少,这对提高玉米秸秆的生物能源转化量具有积极意义。
乳酸菌的快速繁殖和pH迅速降低是青贮成功与否和品质高低的关键所在。因此,pH可间接反映青贮品质的高低。pH快速降低能够抑制不利于青贮的厌氧微生物如肠细菌和梭菌的生长,减少蛋白质等营养成分的损失。高pH(>4.5)是发酵失败的标志之一[23]。试验中6个混贮组的pH均低于4.5,低pH能使青贮发酵过程停滞,减少DM损失。当pH低于4.5时,蛋白质分解成较为稳定的氨基酸,对青贮料不会造成损失,同时可以抑制蛋白质水解微生物的生长[24-25],故6个混贮组的AN/TN均较低,说明蛋白质分解较少。青贮料中有机酸的种类和浓度可以反映青贮发酵过程的好坏,其中最重要的是AA、BA和LA。LA有利于pH降低,减少发酵过程中DM损失。AA能有效抑制酵母菌生长,是抑制酵母等真菌生长的主要物质。BA是梭菌等不良微生物分解青贮料中蛋白质或氨基酸等生成的产物。LA含量越高意味着pH下降越迅速,其DM和能量组分流失少,发酵品质越好[26]。同时,本试验中6个混贮组的AA和BA含量均小于0.01%,推测同型发酵乳酸菌占主导地位,梭菌等有害微生物被有效抑制。综合考虑混贮过程中的化学组分和发酵品质,ME5组的混贮效果优于其余5组,故确定ME5组为贮存品质最佳的混贮比例,即玉米秸秆和废弃白菜的质量比为21∶27。
采用传统的分离培养法从ME5组中分离得到10株乳酸菌,利用16S rDNA序列分析技术鉴定发现,这10株乳酸菌分属于乳杆菌属(Lactobacillus)、肠球菌属(Enterococcus)和明串珠菌属(Leuconostoc)3个属和4个种。4个种分别是短乳杆菌(Lactobacillusbrevis)2株、屎肠球菌(Enterococcusfaecium)1株、肠膜明串珠菌肠膜亚种(Leuconostocmesenteroidessubsp.mesenteroides)5株和植物乳杆菌(Lactobacillusplantarum)2株。其中,乳杆菌属和肠球菌属均为同型发酵乳酸菌,对青贮发酵品质起着关键作用。
然而,由于传统微生物学分离培养方法的不足,若要全面准确了解混贮料中的乳酸菌群落多样性,还需要借助高通量测序技术等方法从分子水平研究其多样性,这也是今后工作的研究内容。
4结论
干玉米秸秆与废弃白菜的混合比例为21∶27时混贮品质最佳,二者混合青贮不仅可以实现干秸秆的长期保存,还能使白菜在贮存期间得到降解。该混贮模式的提出为干黄秸秆的长时间贮存和尾菜污染防治提供了一条新途径,方法可行,也具有实际利用价值。
References:
[1]Weiland P. Biogas production: current state and perspectives. Applied Microbiology Biotechnology, 2010, 85(4): 849-860.
[2]Weinberg Z G, Chen Y. Effects of storage period on the composition of whole crop wheat and corn silages. Animal Feed Science and Technology, 2013, 185(3-4): 196-200.
[3]Zheng Y, Yu C W, Cheng Y S,etal. Effects of ensilage on storage and enzymatic degradability of sugar beet pulp. Bioresource Technology, 2011, 102(2): 1489-1495.
[4]Stevenson D M, Muck R E, Shinners K J,etal. Use of real time PCR to determine population profiles of individual species of lactic acid bacteria in alfalfa silage and stored corn stover. Applied Microbiology Biotechnology, 2006, 71(3):329-338.
[5]Yang D L, Wang J X, Feng W H,etal. Effects of broccoli stems and leaves and maize straw mix-ensiling on silage quality. Pratacultural Science, 2014, 31(3): 551-557.
[6]Li S C, Huang X H, Wang J,etal. Effects of different mixed ratio and fermenting period on efficiency of mixed silage of melilotus albus and corn straw. Pratacultural Science, 2014, 31(2): 321-327.
[7]Huang X H, Li S C, Li D H,etal. Fermentation quality and content of poisonous substances inSophoraalopecuroidesand corn straw mixed silage. Pratacultural Science, 2013, 30(10): 1633-1639.
[8]Zhang F Q, Bao H F, Cui W D,etal. Dynamic changes of lactic acid bacteria during a 15-day ensilage of corn. Microbiology China, 2010, 37(6): 834-838.
[9]Tohno M, Kobayashi H, Nomura M,etal. Genotypic and phenotypic characterization of lactic acid bacteria isolated from Italian ryegrass silage. Journal of Animal Science, 2012, 83(2): 111-120.
[10]Ennahar S, Cai Y, Fujita Y. Phylogenetic diversity of lactic acid bacteria associated with paddy rice silage as determined by 16S ribosomal DNA analysis. Applied Environmental Microbiology, 2003, 69(1): 444-451.
[11]Si B W, Wang Z L, Sun Q Z,etal. Fermentation characteristics and changes of lactic acid bacteria isolated from ensilingLespedezahedysaroides. Pratacultural Science, 2012, 29(4): 650-657.
[12]Cai Y M, Pang H L, Kitahara M,etal.Lactobacillusnasuensissp. nov., a lactic acid bacterium isolated from silage, and emended description of the genusLactobacillus. International Journal of Systematic and Evolutionary Microbiology, 2012, 62(5): 1140-1144.
[13]Yang Y, Shi C, Guo X S. Characterization and identification ofWeissellaspecies isolated fromKobresialittledaleigrowing in alpine meadows. Acta Prataculturae Sinica, 2014, 23(1): 266-275.
[14]Si B W, Wang Z L, Sun Q Z,etal. Isolation and identification of high-quality lactic acid bacteria inHedysarumfruticosumpall. silage. Acta Agrestia Sinica, 2012, 20(1): 166-170.
[15]Weatherburn M. Phenol-hypochlorite reaction for determination of ammonia. Analytical Chemistry, 1967, 39(8): 971-974.
[16]Owens V N, Albrecht K A, Muck R E,etal. Protein degradation and fermentation characteristics of red clover and alfalfa silage harvested with varying levels of total nonstructural carbohydrates. Crop Science, 1999, 39(6): 1873-1880.
[17]Shao T, Zhang Z X, Shimojo M,etal. Comparison of fermentation characteristics of Italian ryegrass (LoliummultiflorumLam.) and guineagrass (PanicummaximumJacq.) during the early stage of ensiling. Asian-Australasian Journal of Animal Science, 2005, 18(22): 1727-1734.
[18]Guo X H, Ling D W. Modern Experiment Technology of Lactic Acid Bacteria[M]. Beijing: Science Press, 2013: 285-286.
[19]Mora D, Fortina M G, Nicastro G,etal. Genotypic characterisation of thermophilic bacilli: a study on new soil isolates and several reference strains. Research Microbiology, 1998, 149(10): 711-722.
[20]Jensen M A, Webster J A, Strauss N. Rapid identification of bacteria on the basis of polymerase chain reaction-amplified ribosomal DNA spacer polymorphisms. Applied Polymerase Environmental Microbiology, 1993, 59(4): 945-952.
[21]Xu C C. Silage Science and Technology[M]. Beijing: Science Press, 2013.
[22]Wang X J, Yang Y, Zhang X Q,etal. To make biofuel: cutting the lignin or loosening lignin’s grip. Scientia Agricultura Sinica, 2015, 48(2): 229-240.
[23]Liu J J, Gao L J, Shi J F,etal. Lactic acid bacteria community andLactobacillusplantarumimproving silaging effect of switch grass. Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(9): 295-302.
[24]Kondo M, Kita K, Yokota H. Feeding value to goats of whole-crop oat ensiled with tea waste. Animal Feed Science and Technology, 2004, 113(1-4): 71-81.
[25]Ge J, Yang C J, Yang Z M,etal. Quality of mixed naked oats (Avenanuda) and alfalfa (Medicagosativa) silage. Acta Prataculturae Sinica, 2015, 24(4): 104-113.
[26]Jiang H, Fang L, Zhou X L,etal. Improve alfalfa silage quality by adding alhagi sparsifolia shap in initial bloom stage. Transactions of the Chinese Society of Agricultural Engineering, 2014, 30(17): 328-335.
参考文献:
[5]杨道兰, 汪建旭, 冯炜弘, 等. 花椰菜茎叶与玉米秸秆的混贮品质. 草业科学, 2014, 31(3): 551-557.
[6]李树成, 黄晓辉, 王静, 等. 白花草木樨与玉米秸秆混合青贮的发酵品质及有毒成分分析. 草业科学, 2014, 31(2): 321-327.
[7]黄晓辉, 李树成, 李东华, 等. 苦豆子和玉米秸秆的混合青贮. 草业科学, 2013, 30(10): 1633-1639.
[8]詹发强, 包慧芳, 崔卫东, 等. 玉米青贮过程中乳酸菌动态变化. 微生物学通报, 2010, 37(6): 834-838.
[11]司丙文, 王宗礼, 孙启忠, 等. 尖叶胡枝子青贮微生物数量变化及发酵特性. 草业科学, 2012, 29(4): 650-657.
[13]杨杨, 石超, 郭旭生. 高寒草甸魏斯氏乳酸菌的分离鉴定及理化特性研究. 草业学报, 2014, 23(1):266-275.
[14]司丙文, 王宗礼, 孙启忠, 等. 山竹岩黄芪青贮中优质乳酸菌的分离和鉴定. 草地学报, 2012, 20(1): 166-170.
[18]郭兴华, 凌代文. 乳酸细菌现代研究实验技术[M]. 北京: 科学出版社, 2013: 285-286.
[21]徐春城. 现代青贮理论与技术[M]. 北京: 科学出版社, 2013.
[22]王晓娟, 杨阳, 张晓强, 等. 木质素与生物燃料生产: 降低含量或解除束缚. 中国农业科学, 2015, 48(2): 229-240.
[23]刘晶晶, 高丽娟, 师建芳, 等. 乳酸菌复合系和植物乳杆菌提高柳枝稷青贮效果. 农业工程学报, 2015, 31(9): 295-302.
[25]葛剑, 杨翠军, 杨志敏, 等. 紫花苜蓿和裸燕麦混贮发酵品质和营养成分分析. 草业学报, 2015, 24(4): 104-113.
[26]蒋慧, 方雷, 周小玲, 等. 添加初花期骆驼刺改善苜蓿青贮品质. 农业工程学报, 2014, 30(17): 328-335.
*Quality and lactic acid bacteria of mixed corn stalk and cabbage waste silage
REN Hai-Wei1,2,3, ZHAO Tuo2, LI Jin-Ping1,3*, LI Xue-Yan2, XU Na2, WANG Yong-Gang2, WANG Xiao-Li4, GAO Xiao-Hang2
1.WesternChinaEnergy&EnvironmentResearchCenter,LanzhouUniversityofTechnology,Lanzhou730050,China; 2.SchoolofLifeScienceandEngineering,LanzhouUniversityofTechnology,Lanzhou730050,China; 3.ChinaNorthwesternCollaborativeInnovationCenterofLow-carbonUrbanizationTechnologies,Lanzhou730050,China; 4.AnimalandVeterinaryPharmaceuticsScienceofChineseAcademyofAgriculturalSciences,Lanzhou730050,China
Abstract:Silage made with a mixture of corn stalk (CS) and cabbage waste (CW) were mixed and ensilaged at different ratios, 29∶19 (ME1), 27∶21 (ME2), 25∶23 (ME3), 23∶25 (ME4), 21∶27 (ME5) and 19∶29 (ME6), respectively. The chemical composition and fermentation traits were measured after 30 days (d) to identify the optimal ratio of corn stalk and cabbage waste and the diversity of lactic acid bacteria in each mixture. The pH and the ratio of ammonia nitrogen to total nitrogen (AN/TN) of the ME5silage was significantly lower than the other mixes (P<0.05). The lactic acid content (LA) of ME5was significantly higher than the other mixes (P<0.05) whereas the ammonia nitrogen/total nitrogen ratio (AN/TN) of ME5was significantly lower than other mixes. Analysis of lactic acid bacteria showed that a total of 10 lactic acid bacteria strains were isolated from the ME5group, belonging to three different genera;Lactobacillus,EnterococcusandLeuconostoc. Two strains ofLactobacillusbrevis, one strain ofEnterococcusfaecium, five strains ofLeuconostocmesenteroidessubsp.mesenteroidesand two strains ofLactobacillusplantarumwere identified. Among these isolates,LactobacillusandEnterococcuswere homofermentative lactic bacteria, which are able to produce more lactic acid than heterofermentative lactic bacteria.LactobacillusandEnterococcusplayed a key role in the fermentation of these silages. In conclusion, mixed silages of CS and CW were found to be feasible with an optimum ratio of 21∶27 respectively.
Key words:corn stalk; cabbage waste; mixed silage; lactic acid bacteria
*通信作者Corresponding author. E-mail:lijinping77@163.com
作者简介:任海伟(1983-),男,山西孝义人,副教授。 E-mail:rhw52571119@163.com
基金项目:国家自然科学基金(51366009),国家高技术研究发展计划(863)(2014AA052801),甘肃省自然科学基金(145RJZA064),兰州市人才创新创业专项(2014-2-20)和兰州理工大学“红柳青年教师培养计划”(Q201207)资助。
*收稿日期:2015-02-20;改回日期:2015-05-29
DOI:10.11686/cyxb2015095
http://cyxb.lzu.edu.cn
任海伟, 赵拓, 李金平, 李雪雁, 徐娜, 王永刚, 王晓力, 高晓航. 玉米秸秆与废弃白菜的混贮品质及乳酸菌多样性研究.草业学报, 2016, 25(1): 197-206.
REN Hai-Wei, ZHAO Tuo, LI Jin-Ping, LI Xue-Yan, XU Na, WANG Yong-Gang, WANG Xiao-Li, GAO Xiao-Hang. Quality and lactic acid bacteria of mixed corn stalk and cabbage waste silage. Acta Prataculturae Sinica, 2016, 25(1): 197-206.
