不同生长期枸杞多糖变化规律及特性研究
2016-02-18刘敦华李世瑶赵宇慧
段 月 刘敦华 李世瑶 赵宇慧 房 想
(宁夏大学,宁夏 银川 750021)
不同生长期枸杞多糖变化规律及特性研究
段 月 刘敦华 李世瑶 赵宇慧 房 想
(宁夏大学,宁夏 银川 750021)
以不同生长期枸杞为研究对象,采用液相色谱分析多糖组成;以Vc为对照,比较分析不同生长期枸杞中枸杞多糖清除羟自由基、超氧阴离子、DPPH和ABTS的活力;采用流变仪分析不同生长期枸杞多糖的流变学特征。结果表明,不同生长期枸杞多糖的单糖组成相同,但其单糖摩尔比差别显著;头茬果多糖的体外抗氧最强;青果期、转色期、头茬枸杞、普通夏果和秋季果的多糖粘度分别为1.02,1.26,1.53,1.49,1.37 Pa·s。该研究为今后枸杞多糖在不同生长期积累变化及形成机理提供理论依据。
枸杞多糖;单糖组成;流变学特性;抗氧化活性
枸杞是中国传统的中草药亦可做食材,宁夏枸杞皮厚多汁,入口甘甜,驰名中外。枸杞果实是主要的入药和食用部分,枸杞多糖是枸杞果实最主要的功能活性成分之一[1-2]。研究表明,枸杞多糖具有抗衰老[3]、降血脂[4]、降血糖[5]、抗肿瘤[6-7]、提高免疫力[8]等作用,枸杞多糖具有水溶性,是一种以—O—连接的糖结合蛋白高分子聚合物,由6种中性单糖和1种酸性单糖组成[9-10]。国内外研究[11-13]较多的是以成熟干燥的枸杞果实分析某一品种或地域枸杞多糖的提取、分离、纯化、单糖组成及抗氧化活性等。还未见研究枸杞果实在不同生长期多糖变化、流变特性及清除自由基活度等。
本研究拟采用动态研究分析枸杞果实不同生长期枸杞多糖的含量积累及各个阶段多糖特性的变化,包括单糖组成、流变特性和清除羟自由基、超氧阴离子、DPPH和ABTS的活度变化,旨在探明枸杞果实不同生长期多糖的积累以及特性的变化情况,确定积累量最大的时期及特性最优生长期,为更深入研究枸杞多糖提供理论基础和参考。
1 材料与方法
1.1 采样和材料
以贺兰山脚下农场大面积种植13年生的宁杞1号为试验材料,从开花坐果到成熟,将花后第 9、15天(5月25日、6月1日)采的样称青果期;第25、30天(6月10日、6月15日)采的样称着色期(黄果期);第34、35天(6月19日、6月20日)采样称生长期;将6月19~22日采摘的枸杞称为头茬枸杞;将7月9~20日采摘的枸杞称为普通夏果;将10月2~5日采摘的枸杞称为秋季果。
1.2 主要试剂和仪器
葡萄糖、甘露糖、半乳糖、鼠李糖、半乳糖醛酸、木糖、阿拉伯糖单糖标准品:≥99%,美国Sigma-Aldrich公司;
3,5-二硝基水杨酸,1-苯基-3-甲基-5-吡唑啉酮(PMP)、三氟乙酸、磷酸二氢钾、水杨酸、硫酸亚铁、ABTS溶液、DPPH溶液、Tris—HCl缓冲液、邻苯三酚:分析纯,上海阿拉丁生化科技股份有限公司;
乙腈、甲醇:色谱纯,国药集团化学试剂有限公司;
分析天平:AL204型,梅特勒-托利多仪器有限公司;
紫外可见分光光度计:T6型,北京普析通用仪器有限责任公司;
循环水式多用真空泵:SHB-Ⅲ型,郑州长城科工贸有限公司;
旋转蒸发器仪:RE-52AA型,上海亚荣生化仪器厂;
二列八孔电热恒温水浴锅:HH•S21-Ni6型,北京长安永创科学仪器有限公司;
真空冻干试验机:JDG-0.2型,兰州科近真空冻干技术有限公司;
色谱工作站:T2100P型,上海通微分析技术有限公司;
色谱柱:VenusilXBPC18型,上海本昂科学仪器有限公司;
流变仪:AR1500ex型,美国TA公司。
1.3 方法
1.3.1 多糖、总糖和还原糖含量的测定 采用3,5-二硝基水杨酸法[14]。
1.3.2 单糖组成的测定
(1) 枸杞多糖的提取:将不同生长期鲜枸杞于热风干燥箱中45 ℃恒温干燥至恒重,粉碎过60目筛,用石油醚60 ℃水浴冷凝回流脱色,再用80%的乙醇70 ℃恒温水浴1~4 h除去还原糖,将滤渣收集到烧瓶中,加入蒸馏水250 mL,于100 ℃水浴锅中浸提1.5 h,重复4次,收集滤液。将沸水浸提得到的多糖溶液放置于1 000 mL的圆底烧瓶中,45 ℃旋转蒸发真空浓缩到100 mL。Sevag法脱蛋白,80%醇沉,冻干(预冻温度-50 ℃,压强50 Pa,加入板温度40 ℃),多糖于蒸馏水中溶解,3 μm膜过滤后注入TOYOPEARL DEAE-650M琼脂糖凝胶柱进行纯化,洗脱液分别为蒸馏水,0.5,1.0,1.5,2.0 mol/L NaCl溶液,分别洗脱5 h,洗脱速率为1.5 mL/min。蒸馏水洗脱2 h后开始收集解析液,10 min/管。合并相应的溶液,浓缩、透析后冻干得不同生长期的枸杞多糖。
(2) 枸杞多糖的水解:准确称取制得的不同阶段枸杞多糖各30 mg,分别置于10 mL具塞试管内,加入2 mol/L 三氟乙酸2 mL,于100 ℃烘箱中水解8 h,水解液用4 mol/L 氢氧化钠溶液中和至pH为7,离心,取清液,定容到10 mL。
(3) 配置单糖标品:称取葡萄糖、甘露糖、半乳糖、鼠李糖、半乳糖醛酸、木糖、阿拉伯糖单糖标准品各10 mg溶于10 mL的容量瓶中定容(用水定容)至刻度线,得对照单糖标品溶液,取单糖标品溶液各1 mL置于10 mL的容量瓶中混合,定容到10 mL,即得单糖混合标品。吸取混合单糖标品1 mL分别稀释成1,2,4,5,8,10 mL 6个浓度的单糖混合溶液,每种标品依次含有20.0,10.0,5.0,4.0,2.5,2.0 μg。
(4) 样品和单糖标品的柱前衍生化:精密吸取混合对照标品液和多糖水解溶液各1 mL与0.5 mol/L PMP甲醇溶液0.5 mL及0.3 mol/L NaOH 溶液0.5 mL 混合,充分振摇,80 ℃水浴条件下反应30 min并且不时地摇动,冷却至室温后,加入0.3 mol/L HCl 0.5 mL 进行中和,分别取1 mL衍生化的溶液置于10 mL的离心管中,加入5 mL氯仿萃取,4 500 r/min离心15 min,弃去有机层,重复萃取5次,得上层清液,经0.45 μm微孔滤膜滤过3次,准备上液相[15-16]。
(5) 色谱条件:SP-120-5C18-AP色谱柱(4.6 mm ID×150 mm);流动相:A相为0.05 mol/L 磷酸盐缓冲液(pH 6.98),B相为乙睛;洗脱梯度(0 min,0% B;10 min,18% B;20 min,25% B);紫外吸收检测器,检测波长250 nm;柱温30 ℃,流速为1 mL/min。每次进样20 μL。
(6) 标准曲线的绘制:将1.3.2(3)配置的6个浓度的单糖混合溶液按照1.3.2(4)的方法用PMP衍生化处理,以进样量(μg)为横坐标,以峰面积(mV)为纵坐标,绘制标准曲线,得各单糖的线性回归方程及其相关系数见表1。
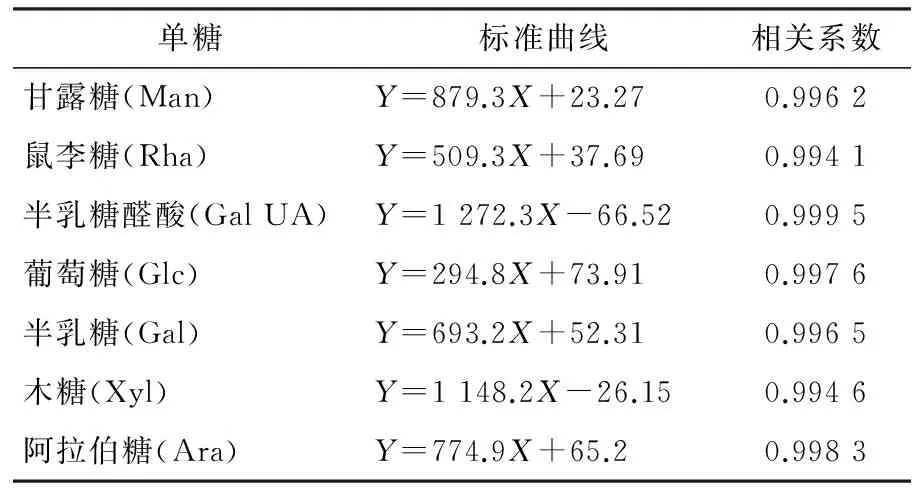
表1 7 种单糖标准曲线
1.3.3 流变性的测定 采用AR1500EX流变仪,选用直径为40 mm不锈钢锥板系统,在25 ℃下平衡20 min后,室温下测各阶段浓度为0.2 mg/mL枸杞多糖的粘度[17-18]。
1.3.4 枸杞多糖体外抗氧化活性的测定
(1) 清除羟自由基的活性:将2 mmol/L FeSO4溶液、1 mmol/L H2O2溶液和6 mmol/L的水杨酸溶液各3 mL放入25 mL比色管中,震荡摇匀,放入水浴锅中37 ℃水浴20 min。将不同生长期、不同浓度的多糖样液各1 mL加入到编号的比色管中,另取一支试管加入1 mL纯水作对照,分别定容至10 mL,在37 ℃下水浴20 min,取出后在510 nm条件下测定,样液吸光度值记作A1,对照样品的吸光度值记作A0,每个试样作3个平行样,取其平均值[19]。根据式(1)计算样液羟自由基(·OH) 的清除率。
(1)
式中:
P——·OH清除率,%;
A1——样液吸光度值;
A0——对照样品的吸光度值。
(2) 清除超氧阴离子的活性:将各个阶段枸杞多糖分别配成0.1,0.2,0.3,0.4,0.5 mg/mL溶液待测液备用。取0.05 mmol/L的Tris—HCl缓冲液4.5 mL,置于25 ℃水浴中预热,分别加入待测液1 mL和25 mmol/L的邻苯三酚溶液0.4 mL,混匀后于25 ℃水浴中反应5 min,加入8 mmol/L HCl 1 mL终止反应,299 nm处测定吸光度,空白对照组以相同体积的蒸馏水代替样品。空白的吸光度记作A0,样液的吸光度值记作A1,每个试样作3个平行样,取其平均值[20]。根据式(1)计算超氧阴离子清除率。
(3) 清除DPPH自由基的活性:取各阶段不同浓度的多糖溶液2 mL,加入0.16 mmol/L DPPH溶液2 mL在暗处室温放置反应30 min,以60%的乙醇溶液凋零,在517 nm处测定吸光度值Ai,空白试验中用蒸馏水代替试样,测得吸光度值A0。每个试样做3次平行试验,取其平均值[21]。DPPH自由基清除率按式(2)计算:
(2)
式中:
P——DPPH自由基清除率清除率,%;
Ai——加入DPPH后多糖溶液的吸光度;
Aio——未加DPPH的多糖溶液的吸光度;
Ao——未加多糖溶液的DPPH吸光度。
(4) 清除ABTS自由基的活性:将浓度为6 mmol/L ABTS+溶液10 mL和5 mmol/L K2S2O8溶液20 mL混合于阴暗处反应15 h,得ABTS自由基溶液。按照体积比为1∶20 的比例将不同样液与制得的ABTS+自由基溶液反应,静置反应5 min,在745 nm处测得吸光值A1,以蒸馏水代替样液作空白对照A0,每个样液做3次平行试验,取其平均值[22]。根据式(1)计算样液对ABTS+的清除率。
2 结果与分析
2.1 不同生长期多糖的含量
由图1可知,枸杞果实生长发育过程中,总糖、还原糖和多糖的含量呈正相关,都呈逐渐增加的趋势。果实发育的前19 d,多糖含量积累十分缓慢,总糖和还原糖积累速率渐增;19~24 d总糖和还原糖含量迅速积累,总糖的日增量为0.384 g/100 g,还原糖的日增量为0.38 g/100 g,此时多糖的含量变化仍不明显;24~29 d后,总糖和还原糖的积累速率加快,总糖的日增量为0.524 g/100 g,还原糖的日增量为0.454 g/100 g,多糖的积累量加快,日增量达到0.07 g/100 g;29~34 d总糖的日增量为0.568 g/100 g,还原糖的积累速率减小,日增量为0.384 g/100 g,多糖积累速率则达到最快,日增量为0.184 g/100 g。
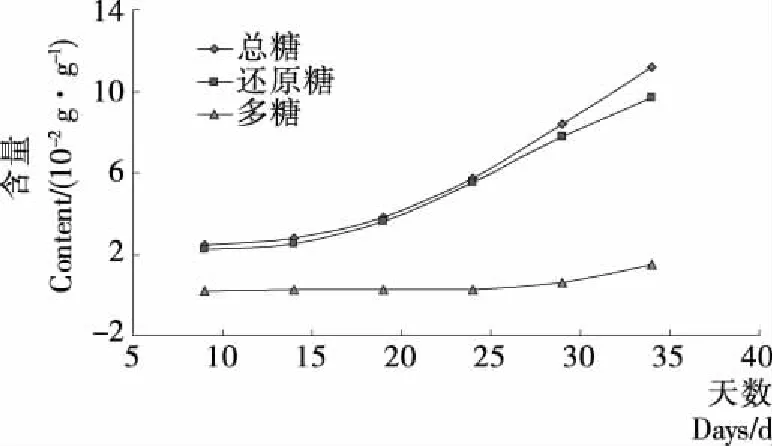
图1 不同生长期总糖、还原糖和多糖含量变化图
Figure 1 Changes of total sugar, reducing sugar and polysaccharide in different growth stages
由表2可知,普通夏果总糖和还原糖的含量最高,头茬枸杞略少,秋季果则远不入夏季果含量高。就多糖含量来看,头茬枸杞多糖含量最高,其次是普通夏果,秋季果的多糖含量最少。
在枸杞果实药用价值中,总糖、还原糖及多糖含量起重要作用。对枸杞总糖、多糖和还原糖含量的测定结果表明,糖的大量累积都是在进入转色期后。不同采收期总糖、还原糖及多糖含量也存在差异,说明不同采收期枸杞多糖结构和性质可能存在差异。如果以总糖和还原糖含量评价枸杞,以普通夏果最优,以多糖含量评价枸杞,头茬枸杞最优。
表2 不同生长期枸杞总糖、还原糖和多糖含量
Table 2 The contents of total sugar, reducing sugar and polysaccharide in different picking periods g/100 g
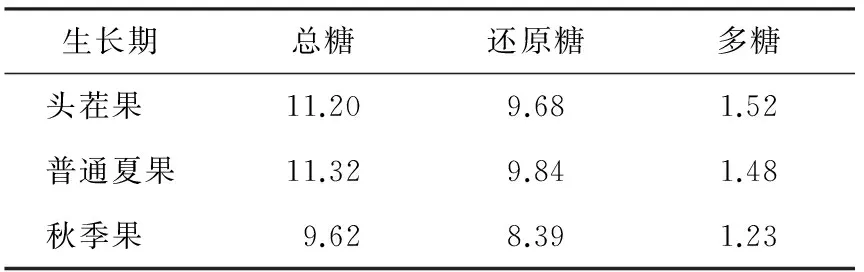
生长期总糖还原糖多糖头茬果 11.209.681.52普通夏果11.329.841.48秋季果 9.628.391.23
2.2 不同生长期枸杞多糖的单糖组成
由图2可知,7种单糖标准品得到很好的分离。以保留时间定性分析,以峰面积和进样的浓度做出标准曲线,再根据标曲和峰面积进行不同物质的定量分析。与图2对照得出,不同生长期枸杞多糖的单糖均由甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、木糖和阿拉伯糖7种单糖组成(图略)。 不同生长期枸杞多糖的7种单糖组成见表3。由表3可知,各个生长期枸杞多糖单糖组成有显著差异。各个时期单糖组成摩尔比可以得出青果期多糖主要以半乳糖和阿拉伯糖组成,转色期多糖主要以半乳糖醛酸、葡萄糖和阿拉伯糖组成,成熟枸杞多糖主要以半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成。甘露糖含量均较低,阿拉伯糖含量均较高,甘露糖、半乳糖、葡萄糖、阿拉伯糖于生长期含量达最高,鼠李糖和木糖呈现下降的趋势,半乳糖醛酸呈先增后减的趋势。
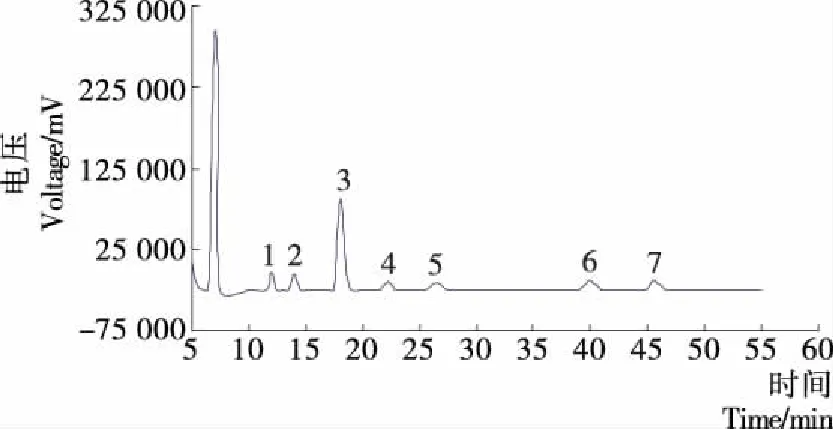
1. 甘露糖 2. 鼠李糖 3. 半乳糖醛酸 4. 葡萄糖 5. 半乳糖 6. 木糖 7. 阿拉伯糖
† 同列字母不同者差异显著(P<0.05)。
2.3 不同生长期枸杞多糖流变性的变化
由图3可知,经过相同处理不同生长期枸杞多糖的粘度区别较明显,取100~300 s的20个点的平均值,得到青果期、黄果期、头茬果、普通夏果、秋季果的粘度分别为1.02,1.21,1.53,1.49,1.46 Pa·s。对于大分子的多糖分子结构,粘度越大表明结构越伸展或分子量越大[23]。由试验结果可知,头茬果的粘度最大,表明其多糖分子量最大,或多糖结构越伸展。
2.4 不同生长期枸杞体外抗氧化活性测定
2.4.1 清除羟自由基的活性 由图4可知,不同生长期枸杞多糖清除羟自由基的活性都是随浓度的增加而增加的,且存在差异性,成熟果实多糖清除羟自由基活性达最高。3 mg/mL 浓度下的活度约为60%,较黄果多糖活度高20%,较青果多糖活度高52%。不同采收期的枸杞多糖清除羟自由基的活度也不一样,头茬果>普通夏季果>秋季果。
2.4.2 清除超氧阴离子的活性 由图5可知,不同生长期枸杞多糖清除超氧阴离子的活性都随浓度增加而增加,且存在一定的差异性。头茬枸杞多糖清除超氧阴离子的活性最高,3 mg/mL浓度下头茬果多糖活性为24%,比黄果多糖活高14%,比青果多糖活性高21%,不同采收期枸杞多糖清除超氧阴离子活性也不尽相同,头茬果>普通夏季果>秋季果。2.4.3 清除DPPH自由基的活性 由图6可知,随着枸杞果实的生长发育,其多糖清除DPPH自由基的活性不断上升,且多糖浓度与清除DPPH自由基的活性呈正相关。3 mg/mL 浓度下青果多糖活性为8%,黄果多糖比青果活性高5.25倍,成熟果多糖是黄果多糖活性的1.67倍。不同采收期多糖活性比较,头茬果>普通夏季果>秋季果。

图3 不同生长期枸杞多糖流变性
Figure 3 Rheological properties of Chinese wolfberry in different mature stages

图4 多糖清除羟自由基的活性
2.4.4 清除ABTS自由基的活性 由图7可知,不同生长阶段枸杞多糖清除ABTS自由基的活性有明显提高,且随着浓度增加,各阶段多糖活性变化显著,3 mg/mL浓度下清除ABTS自由基的活性比较,青果多糖<黄果多糖<秋果多糖<普通夏果多糖<头茬果多糖。

图5 多糖清除超氧阴离子的活性
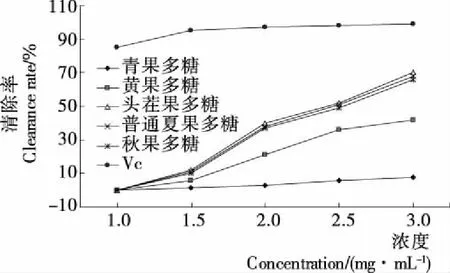
图6 多糖清除DPPH自由基的活性

图7 多糖清除ABTS自由基的活性
综上所述,不同生长期枸杞在多糖低于1 mg/mL浓度下检测不到体外抗氧化活性,随浓度升高多糖体外清除自由基活性增加。不同浓度处理的同一生长期比较,多糖以清除DPPH自由基的活性最佳,清除超氧阴离子的活性较差。相同浓度下不同生长期枸杞多糖多糖清除自由基活性,随枸杞果实生长而增加,以头茬果多糖活性最优。
3 结论
本试验以开花坐果至成熟的枸杞果实为对象,分析了不同生长期多糖的含量,研究不同生长阶段枸杞多糖的单糖组成、流变特性并分析其清除羟自由基、超氧阴离子、DPPH、ABTS自由基的体外抗氧化活性。综合试验可以得出,不同生长期多糖在单糖组成、流变性特性及体外抗氧化活性上存在很大的差异性。
以往研究枸杞多糖多见枸杞干燥中提取多糖、纯化、结构分析,并分析其功能特性,而枸杞多糖在不同生长期及加工过程变化规律及特性未见报道。本试验研究分析了不同生长期枸杞多糖组成变化、流变学特性及抗氧化活性等,至于其分子量变化规律以及与某些关键蛋白(酶)之间的关系将是以后研究的关键点和方向。
[1] HARUNOBU A, NORMAN R, FAMSWORTH. A review of botanical characteristics, phytochemistry, clinical relevance in efficacy and safety of Lycium barbarum fruit (Goji) [J]. Food Research International, 2011, 44(7): 1 702-1 717.
[2] SU Chun-xia, DUAN Xiang-guo, LIANG Li-jun, et al. Lycium barbarum polysaccharides as an adjuvant for recombinant vaccine through enhancement of humoral immunity by activating Tfh cells [J]. Veterinary Immunology and Immunopathology, 2014, 158(1/2): 98-104.
[3] HARMAN D, HEIDRICK M L, EDDY D E. Free radical theory of aging: Effect of free radical reaction inhibitors on the immune response [J]. Journal of the American Geriatrics Society, 1997, 25(9): 400-407.
[4] MA Ming, LIU Guan-hua, YU Zhan-hai, et al. Effect of the Lycium barbarum polysaccharides administration on blood lipid metabolism and oxidative stress of mice fed high-fat diet in vivo [J]. Food Chemistry, 2009, 113(4): 872-877.
[5] 唐华丽, 孙桂菊, 陈忱. 枸杞多糖的化学分析与降血糖作用研究进展[J]. 食品与机械, 2013, 29(6): 244-247.
[6] JIN Ming-liang, HUANG Qing-sheng, ZHAO Ke, et al. Biological activities and potential health benefit effects of polysaccharides isolated from Lycium barbarum L. [J]. International Journal of Biological Macromolecules, 2013(54): 16-23.
[7] 张静丽, 王宏勋, 张雯, 等. 灵芝、枸杞多糖复合抗氧化作用[J]. 食品与机械, 2004, 20(6): 11-12, 46.
[8] 齐春会, 张永祥, 赵修南, 等. 枸杞粗多糖的免疫活性[J]. 中国药理学与毒理学杂志, 2001, 15(3): 180-184.
[9] 田庚元, 王晨, 冯宇澄. 枸杞子糖蛋白的分离纯化、物化性及糖肽键特征[J]. 生物化学与生物物理学报, 1995, 27(2): 201-206.
[10] 刘源才, 孙细珍, 许银, 等. 枸杞多糖组成及含量测定方法的改进[J]. 食品科学, 2013, 34(12): 292-295.
[11] 高洪霞, 刘军海, 李广录. 枸杞多糖提取工艺的研究[J]. 食品与机械, 2008, 24(5): 60-62.
[12] 徐金楠, 刘玮, 刘春晶, 等. 不同枸杞中多糖含量与结构特征的对比研究[J]. 中国食品学报, 2015, 15(4): 233-238.
[13] 黄文书, 冯作山, 李瑾瑜. 枸杞多糖提取条件的研究[J]. 食品与机械, 2007, 23(3): 87-88, 91.
[14] 樊晓辉, 赵春玲, 张成军, 等. 3,5-二硝基水杨酸法测定枸杞提取液中多糖的含量[J]. 食品研究与开发, 2014, 35(21): 77-80.
[15] 戴军, 朱松, 汤坚. PMP柱前衍生高效液相色谱法分析杜氏盐藻多糖的单糖组成[J]. 分析测试学报, 2007, 26(2): 206-210.
[16] 王泽文, 冷凯良, 孙伟红, 等. 柱前衍生高效液相色谱法分析海带岩藻聚糖的单糖及糖醛酸组成[J]. 分析科学学报, 2011, 27(1): 26-30.
[17] 高春燕, 卢跃红, 田呈瑞. 枸杞多糖流变学特性研究[J]. 食品科学, 2009, 30(21): 28-32.
[18] 刘敦华, 谷文英. 沙蒿籽胶性质、结构及应用的研究[D]. 无锡: 江南大学, 2006: 12-26.
[19] 董周永. 荔枝多糖的提取、分离纯化及抗氧化性研究[D]. 西安: 西北农林科技大学, 2006: 10-30.
[20] 石玉平, 卢挺, 王永宁. 油菜蜂花粉中黄酮类物质清除羟基自由基的研究[J]. 食品科学, 2004, 25(11): 300-302.
[21] STOKES N J, TABNER B J, HEWITT C N. Determination of hydroxyl radical concentration in environmental using electron spin resonance[J]. Chemosphere, 1994, 28(5): 999-1 008.
[22] KAUR H, HALLINELL B. Aromatic hydroxylation of phenylanine as an assay for hydroxyl -radical[J]. Anal Biochem, 1994, 220(1): 11-15.
[23] CUI S W. Food carbohydrates: chemistry, physical properties, and applications[M]. Francisp: CRC Press, 2005: 215-225.
Study on variation regularity and characteristics of Lycium barbarum polysaccharide in different mature stage
DUAN YueLIUDun-huaLIShi-yaoZHAOYu-huiFANGXiang
(NingxiaUniversity,Yingchuan,Ningxia750021,China)
Studied the change ofLyciumbarbarumpolysaccharides (LBP) in different growth periods, by using the wolfberries in different growth periods as research objects, and analyzed the LBP composition by HPLC. Taking VC as the control sample, the LBP’s activities of scavenging hydroxyl radicals, superoxide anions, DPPH and ABTS were analyzed and compared in different growth periods. The rheological characteristics of LBP in different growth periods were analyzed by a rheometer. The results indicated that the monosaccharide composition of LBP was the same in different growth periods, but the monosaccharide molar ratios of the polysaccharides were significantly different. The antioxidant activity in vitro of the polysaccharides of the first-crop fruits was the strongest. The polysaccharides viscosities of green wolfberries, coloring wolfberries, first-crop wolfberries, summer wolfberries and autumn wolfberries were 1.02, 1.26, 1.53, 1.49 and 1.37 Pa•s, respectively. This study provided the theoretical basis for the future study on the accumulation and change of LBP and the formation principle of LBP in different growth periods.
wolfberry polysaccharide; composition of monosacchar-ides; rheological property activity; antioxidant activity
10.13652/j.issn.1003-5788.2016.12.012
国家科学自然基金(编号:31560436)
段月,女,宁夏大学在读硕士研究生。
刘敦华(1964-),男,宁夏大学教授,博士。 E-mail: dunhualiu@126.com
2016—10—03
