雨生红球藻源虾青素对糖尿病小鼠的降糖作用及其机制
2016-02-17李勇超贺青华刘瑞雪杨宗鑫
李勇超,贺青华,刘瑞雪,张 波,杨宗鑫,周 敏
(北京联合大学功能食品科学技术研究院,北京联合大学应用文理学院,北京 100191)
雨生红球藻源虾青素对糖尿病小鼠的降糖作用及其机制
李勇超,贺青华,刘瑞雪,张 波*,杨宗鑫,周 敏
(北京联合大学功能食品科学技术研究院,北京联合大学应用文理学院,北京 100191)
通过尾静脉注射四氧嘧啶(45~50 mg/kg BW iv)建立小鼠高血糖模型,研究雨生红球藻源虾青素(astaxanthin,ASX)对四氧嘧啶高血糖小鼠血糖的调节作用。分别以雨生红球藻源虾青素粉(虾青素含量为2%)25、100 mg/kg连续灌胃高血糖小鼠14 d,在末次灌胃后摘眼球取血测定血糖、胰岛素、SOD、GSH-Px的活性和MDA水平;肝、肾组织称重并测定SOD、GSH-Px的活性和MDA水平。结果表明,雨生红球藻源虾青素可缓解高血糖模型小鼠体重降低的趋势,减少饮水量和摄食量;雨生红球藻源虾青素可显著降低四氧嘧啶高血糖小鼠的血糖值(p<0.05)以及极显著提高血清中胰岛素的含量(p<0.01),增强了血清中的SOD(p<0.01)和GSH-Px(p<0.01)的活性,抑制了肾脏和肝脏中的MDA水平。结果表明,提高血清和肝肾组织的抗氧化能力,增加机体内的胰岛素水平可能是雨生红球藻源虾青素降血糖的机制之一。
雨生红球藻,虾青素,血糖,糖尿病,小鼠
糖尿病(diabetes mellitus,DM),是由遗传因素和环境因素相互作用而引起的体内胰岛功能性障碍从而导致胰岛素分泌不足和糖、脂质、蛋白质、维生素、水、电解质的代谢紊乱,以及氧化平衡破坏的一种全身慢性终身性疾病,临床上表现的主要特征为高血糖[1]。目前在世界范围内,糖尿病患病率、发病率和糖尿病患者数量急剧上升,且有研究表明[2-3],糖尿病出现糖、脂和蛋白多种物质的代谢紊乱,常伴有各种氧化应激、炎症、细胞凋亡和器官受损的现象,严重危害人类的生命与健康,其发病的原因尚未明确,发病机理复杂,尚无根治药物[1-4]。其在临床上的治疗主要以药物控制机体血糖的升高,减轻糖尿病的症状,从而降低糖尿病并发症的发生率。但是药物治疗会有一定的毒副作用,且会使患者对药物产生依懒性,会严重影响糖尿病患者的生活质量。因此有许多研究者把目光转向了具有降糖作用的天然活性物质,以期通过饮食调理来控制血糖,防止并发症的发生[5-6]。
虾青素(Astaxanthin,ASX)全称为3,3′-二羟基-β胡萝卜素-4,4′-酮,是一种红色的类胡萝卜素及天然的脂溶性色素,广泛地分布在海洋的细菌、藻类、甲壳类和鱼类中等,其中雨生红球藻中虾青素的含量高达1.5%~3%,被公认为自然界中生产天然虾青素最好的原料之一[5-6]。近年来国内外对虾青素做了大量的研究,现有结果表明,天然虾青素是迄今为止发现的自然界最强的天然抗氧化剂之一,它能发挥强大的抗氧化作用,增强细胞的再生能力,维持机体的平衡和减少衰老细胞的堆积,在抗炎、抗癌、预防心血管疾病、增强机体的免疫、保护神经系统有着重要的作用[9-13]。本文主要研究雨生红球藻源虾青素对糖尿病小鼠的血糖控制作用及其机制。
1 材料与方法
1.1 材料与仪器
昆明小鼠 许可证编号:SCXK(京)2012-0001,SPF级,雄性,体质量(25±3)g,中国食品药品检定研究院;雨生红球藻源虾青素粉 虾青素含量为2%,杭州鑫伟低碳技术研发公司;葡萄糖测定试剂盒 中生北控生物科技股份有限公司;小鼠胰岛素(INS)酶联免疫检测试剂盒 上海沪尚生物科技有限公司;蛋白定量测试盒 南京建成生物工程研究所;丙二醛(MDA)测试盒 南京建成生物工程研究所;总超氧化物歧化酶(T-SOD)测试盒 南京建成生物工程研究所;谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒 南京建成生物工程研究所。
5804R型低温高速离心机 德国eppendorf;电热恒温培养箱 上海一恒科学仪器有限公司;电动匀浆器 常州朗越仪器制造有限公司;SPF实验室 北京联合大学食品功能技术研究院。
1.2 动物的分组与饲养
SPF级昆明雄性小鼠50只,适应性饲养饲养3 d,随机分为四组:正常组、模型组、雨生红球藻源虾青素粉(纯度2%)低剂量组(25 mg/kg BW)、雨生红球藻源虾青素粉(纯度2%)高剂量组(100 mg/kg BW)。实验性小鼠在SPF屏障系统中饲养,温度控制在(20±2) ℃之间,空气相对湿度50%~70%,光照周期为 14 h光照(6:00~20:00)/10 h黑暗,自由取食、饮水。
1.3 糖尿病模型的建立和虾青素的灌胃
采用四氧嘧啶诱导糖尿病小鼠的方法造模:小鼠禁食24 h(自由取水)注射新鲜配制的四氧嘧啶(ALX)(45~50 mg/kg BW iv)造模,5~7 d后小鼠禁食3~5 h,眼眶取血,测血糖,血糖值在10~25 mmol/L为高血糖模型建立成功的小鼠。选高血糖模型小鼠按禁食3~5 h的血糖水平分组,随机选1个模型对照组和2个剂量组(组间血糖差不大于1.1 mmol/L)。
造模成功后,模型组、雨生红球藻源虾青素粉(纯度2%)低剂量组(25 mg/kg BW)、雨生红球藻源虾青素粉(纯度2%)高剂量组(100 mg/kg BW)各10只,自小鼠造模成功后24 h开始灌胃,雨生红球藻源虾青素粉溶液低剂量为25 mg/kg,雨生红球藻源虾青素粉溶液高剂量为100 mg/kg,正常组、模型组灌胃生理盐水,灌胃体积为1 mL/100 g BW,持续灌胃14 d,每天对各组小鼠的体重、饮水量和摄食量进行称量,且记录各组小鼠的精神状态。
1.4 血清和脏器的采集和制备
雨生红球藻源虾青素灌胃14 d后,摘眼球取血,离心得到的血清放入-80 ℃冰箱中用于血糖值、胰岛素和抗氧化指标的测定。处死小鼠后,立即解剖取出小鼠的肝和肾,放入-80 ℃冰箱中用于后续抗氧化指标的测定。
1.5 血糖和胰岛素的测定
用葡萄糖测定试剂盒测定小鼠血清中血糖含量,按试剂盒说明书进行操作按式(1)计算血糖下降率。
血糖下降率(%)=实验前血糖值-实验后血糖值/实验前血糖值×100
式(1)
用小鼠胰岛素(INS)酶联免疫检测试剂盒检测小鼠血清中的胰岛素水平,按试剂盒操作说明书进行实验。
1.6 血清抗氧化指标的测定
用丙二醛(MDA)测试盒测定小鼠血清中的MDA,按试剂盒说明书进行操作。用总超氧化物歧化酶(T-SOD)测试盒测定小鼠血清中的SOD活性,按试剂盒说明书进行操作。用谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒测定小鼠血清中GSH-Px的活力,按试剂盒说明书进行操作。
1.7 肝、肾组织抗氧化指标的测定
将小鼠肝、肾的样本从-80 ℃冰箱中拿出,放在10倍量的生理盐水中用组织匀浆器匀浆制成10%的匀浆液,3000 r/min离心10 min取上清备用,按照1.6中方法测定小鼠肝和肾中的MDA含量、T-SOD的活力和GSH-PX的活力。
1.8 数据处理
实验数据采用SPSS 12.0软件进行分析,各组数据结果以x±s表示,并进行单因素方差分析,p<0.05表示有显著性差异,p<0.01表示有极显著性差异。
2 结果与分析
2.1 雨生红球藻源ASX对小鼠体重的影响
实验期间观察发现,正常组的小鼠皮毛光泽,精神状态良好;模型组的小鼠毛色暗黄,精神萎靡;低、高剂量的雨生红球藻源ASX干预后,小鼠的毛色逐渐有光泽,精神状态渐渐变好。
从整个实验过程体重变化曲线图1可以看出:正常对照组小鼠的体重呈现持续增长的趋势;模型组的小鼠在实验的前7 d时体重逐步下降,随后慢慢增长,说明糖尿病小鼠在接受刺激后体内适应性代谢紊乱;在雨生红球藻源ASX干预后高血糖小鼠体重先下降而逐渐趋于正常,且恢复程度显著高于模型组小鼠,与正常组小鼠无差异。

表1 雨生红球藻源的ASX对小鼠血糖下降率、饮水量、摄食量和胰岛素含量的影响
注:*表示与正常对照组比较差异显著(p<0.05),**表示与空白对照组比较差异极显著(p<0.01);#表示与模型对照组比较差异显著(p<0.05),##表示与模型对照组组比较差异极显著p<0.01;表2、表3同。

图1 雨生红球藻源ASX对小鼠体重的影响Fig.1 Effect of ASX on body weight in diabetic mice
2.2 雨生红球藻源ASX对小鼠饮水量、摄食量、血糖和胰岛素含量的影响
实验小鼠的饮水量和摄食量结果见表1,模型组小鼠的饮水量和摄食量极显著高于正常对照组小鼠的饮水量和摄食量(p<0.01);在雨生红球藻ASX干预后,低剂量雨生红球藻源ASX组小鼠的饮水量和摄食量显著低于模型组小鼠的饮水量(p<0.01)和摄食量(p<0.05),高剂量雨生红球藻源ASX组小鼠的饮水量和摄食量极显著低于模型组小鼠的饮水量和摄食量(p<0.01)。结合表1和图1表明雨生红球藻源的ASX干预后可以对糖尿病三多一少的症状有明显减轻。
表1实验结果表明:与正常对照组相比,模型组小鼠的血糖下降率与正常对照组小鼠的血糖下降率有极显著性差异(p<0.01);与模型组相比,低剂量雨生红球藻源的ASX组小鼠的血糖下降率与模型组小鼠的血糖下降率有显著性升高(p<0.05),高剂量雨生红球藻源ASX组小鼠的血糖下降率与极显著升高(p<0.01)。说明雨生红球藻源ASX干预后,抑制了小鼠体内血糖的进一步升高,但未恢复至正常水平。
与正常对照组相比,模型组小鼠血清中胰岛素的含量与正常组小鼠血清中胰岛素含量极显著降低(p<0.01);与模型组相比,低剂量雨生红球藻源ASX组小鼠血清中胰岛素含量极显著升高(p<0.01),高剂量雨生红球藻源ASX组小鼠血清中胰岛素含量极显著升高(p<0.01)。说明雨生红球藻源ASX干预后,是通过调节小鼠体内胰岛素水平从而达到降低血糖的目的。
2.3 雨生红球藻源ASX对小鼠血清中的抗氧化指标的影响
表1实验结果表明:与正常对照组相比,模型组小鼠血清中的SOD活性下降(p<0.05),GSH-Px活性下降(p<0.05),而MDA含量无显著差异(p>0.05);与模型组相比,低剂量雨生红球藻源ASX组小鼠血清中T-SOD活性升高(p<0.05),GSH-Px活性升高(p<0.01),MDA含量无显著差异,高剂量雨生红球藻源ASX组小鼠血清中T-SOD活性升高(p<0.01),GSH-Px活性升高(p<0.01),MDA含量无差异。说明虾青素可以明显改善四氧嘧啶糖尿病小鼠的氧化应激水平。

表2 小鼠血清中的抗氧化指标(T-SOD、GSH-Px、MDA)
2.4 雨生红球藻源ASX对小鼠肝、肾抗氧化指标的影响
肝脏和肾脏是影响机体糖代谢的重要器官,肝脏和肾脏功能的好坏对糖尿病的发生及病情发展有极为重要的影响。表3实验结果表明:与正常对照组相比,模型组小鼠肝脏和肾脏的MDA含量显著升高(p<0.05),SOD活力无差异、GSH-Px活力无显著差异;与模型组相比,低剂量雨生红球藻源ASX组小鼠肝脏和肾脏的MDA含量显著降低(p<0.05),SOD活力无显著差异、GSH-Px活力无显著差异,高剂量雨生红球藻源ASX组小鼠肝脏和肾脏的MDA含量显著降低(p<0.01),SOD活力无显著差异、GSH-Px活力无显著差异。说明虾青素干预后对四氧嘧啶糖尿病小鼠组织的氧化应激水平有一定的作用,且对SOD、GSH-Px的活力有改善的作用,但与模型组相比无差异。
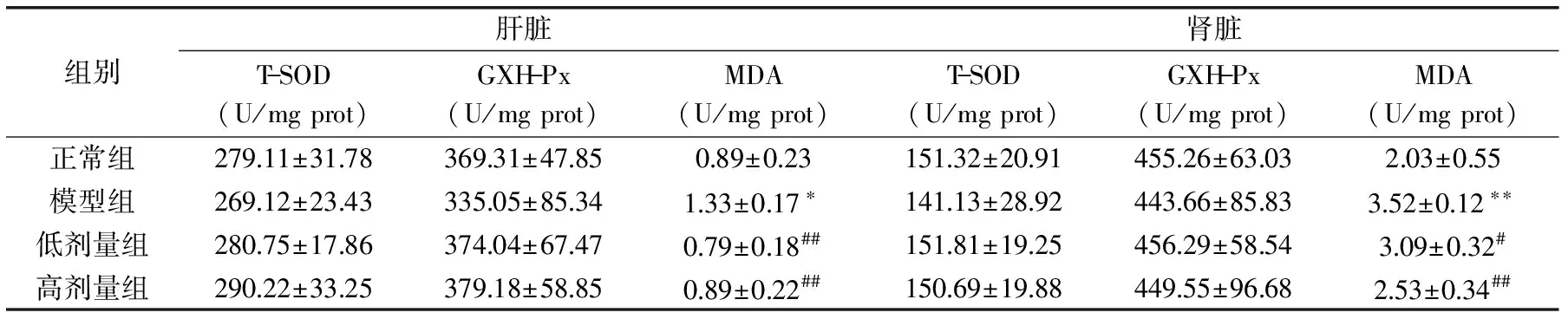
表3 小鼠肝脏和肾脏中的抗氧化指标(T-SOD、GSH-Px、MDA)
3 讨论与结论
四氧嘧啶是一种氧化剂,进入机体内代谢产生活性氧并迅速被胰岛β细胞摄取,通过氧化还原反应使胰岛β细胞中氧自由基含量升高,导致胰岛β细胞大量损伤和死亡。目前大量的研究表明,体内自由基堆积可导致胰岛β细胞受损,胰岛素分泌减少,血糖升高,进一步,在高糖环境下,蛋白质糖基化终末产物生成增加,与特异性受体作用可诱导氧化应激,同时高糖也能够引起氧自由基生成增加,同时也会使机体周围组织损伤,破坏机体的平衡,抗氧化能力下降[14-15]。
机体在正常情况下氧化和抗氧化处于一个动态平衡,当某种原因使自由基产生增加、抗氧化能力减弱,将导致各种病理变化的产生。最新研究表明[16-20],自由基诱发脂质的过氧化与糖尿病密切相关,是疾病起始的重要原因之一。MDA是多不饱和脂肪酸过氧化物的降解产物,与脂蛋白交联后具有较强的毒性,因此MDA作为衡量体内脂质过氧化的主要指标,在一定程度上反映了细胞受氧化损伤的程度;SOD能够清除自由基,保护细胞损伤,间接的反应机体清除自由基的能力;GSH-Px是机体内广泛存在的一种重要的催化过氧化氢分解的酶,可以起到保护细胞膜结构和功能完整的作用。实验研究表明,雨生红球藻源ASX的干预治疗,显著降低了糖尿病小鼠的血糖,显著提高了四氧嘧啶糖尿病小鼠的抗氧化酶活性,降低了四氧嘧啶对机体造成的氧化损伤,减轻了糖尿病的各种症状。
综上所述,雨生红球藻源ASX可显著降低高血糖小鼠的饮水量和摄食量,且明显改善了高血糖小鼠体重的正常趋势使其趋于正常;显著降低四氧嘧啶小鼠的氧化损伤,提高机体免疫力,促进胰腺β细胞的胰岛素分泌功能,从而降低血糖。雨生红球藻源ASX对四氧嘧啶糖尿病小鼠降糖的具体途径仍需进一步研究。
雨生红球藻源ASX显著降低高血糖小鼠的饮水量和摄食量,且明显改善了高血糖小鼠体重的正常趋势使其趋于正常;能够促进高血糖小鼠胰岛素的分泌,显著降低高血糖小鼠的血糖值;显著降低高血糖小鼠的氧化损伤,提高了机体的免疫力。
[1]Shi CH,Wang C,Bai R,et al. Associations among glycemic excursions,glycated hemoglobin andhigh-sensitivity C-reactiveprotein in patients with poorly controlled type 2 diabetes mellitus[J]. Experimental and Therapeutic Medicine,2015,10(5):1937-1942.
[2]Bjornstad P,Cherney D,Maahs DM. Early diabetic nephropathy in type 1 diabetes:new insights[J]. Curr Opin Endocrinol Diabetes Obes,2014,4(21):279-286.
[3]Boukhris M,Tomasello SD,Marza F,et al. Coronary Heart Disease in Postmenopausal women with Type II Diabetes Mellitus and the Impact of Estrogen Replacement Therapy:A Narrative Review[J]. Int J Endocrinol,2014,2014:413920.
[4]Richard P,Shin P,Beeson T,et al. Quality and Cost of Diabetes Mellitus Care in Community Health Centers in the United States[J]. PLoS One,2015,12(10):e0144075.
[5]Marciniak C,Marechal X,Montaigne D,et al. Cardiac contractile function and mitochondrial respiration in diabetes-related mouse models[J]. Cardiovasc Diabetol,2014,13:118.
[6]Zimmet P,Alberti KG,Shaw J.Global and societal implications of the diabetes epidemic[J]. Nature,2001,414:782-787.
[7]Ambati RR,Phang SM,Ravi S,et al. Astaxanthin:sources,extraction,stability,biological activities and its commercial applications--a review[J]. Mar Drugs,2014,1(12):128-152.
[8]Saw CL,Yang AY,Guo Y,et al.Astaxanthin and omega-3fatty acids individually ang in combination protect against oxidative stress via the Nrf2-ARE pathway[J]. Food and chemical toxicology,2013,62:869-875.
[9]Polotow TG,Vardaris CV,Mihaliuc AR,et al.Astaxanthin supplementation delays physical exhaustion and prevents redox imbalances in plasma and soleus muscles of Wistar rats[J]. Nutrients,2014,12(6):5819-5838.
[10]Ursoniu S,Sahebkar A,Serban MC,et al. Lipid profile and glucose changes after supplementation with astaxanthin:a systematic review and meta-analysis of randomized controlled trials[J]. Arch Med Sci,2015,2(11):253-266.
[11]Ciccone MM,Cortese F,Gesualdo M,et al. Dietary intake of carotenoids and their antioxidant andanti-inflammatory effects in cardiovascular care[J]. Mediators Inflamm,2013,2013:782137.
[12]Bhuvaneswari S,Yogalakshmi B,Sreeja S,et al. Astaxanthin reduces hepatic endoplasmic reticulum stress and nuclear factor-kappa B-mediated inflammation in high fructose and high fat diet-fed mice[J]. Cell Stress Chaperones,2014,2(19):183-191.
[13]Xu J,Gao H,Zhang L,et al. A combination of flaxseed oil and astaxanthin alleviates atherosclerosis risk factors in high fat diet fed rats[J]. Lipids Health Dis,2014,13:63.
[14]Yadav P,Sarker S,Bhatnager D. Action of Capparis decidua against alloxan inducedoxidative stress and diabetes in rat tissues[J]. Pharmacol Res,1997,36(3):221-228.
[15]Chakarabarti R,Vikramadithyan RK,Mullangi R,et al. Antidiabetic and hypolipidemic activity of Helicteres isora in animal models[J]. J Ethnopharmacol,2002,81:343-349.
[16]Feillet-Coudary C,Rock E,Coudyar C,et al. Lipid peroxidation and antioxidant status in experimental diabetes[J]. Clin Clim Aeta,1999,284:31-43.
[17]Lesley K,MacDonaldWicks,Manohar L G. Vitamin E supplementation in the mitigation ofcarbontetrachloride induced oxidative stress in rats[J].J Nutr Biochem,2003,14:211-218.
[18]Laybutt R,Hasenkma PW,GroffA,et al. B-cell adaptation to hypegrlyeemia[J]. Diabetes,2001,50:s180-s181.
[19]Choi HD,Youn YK,Shin W. Positive effects of astaxanthin on lipid profiles and oxidative stress in overweight subjects[J]. Plant Food for Human Nutrition,2011,66(4):363-369.
[20]Samols E,Bonne-Welr S,Weir GC. Intra-islet insulin-glucagon-somatostatinrelationships[J]. Clin Endocrind Metab,2013,15(1):33-58.
Effects ofHaematococcuspluvialisastaxanthin on diabetes mice for decreasing blood glucose and its mechanisms
LI Yong-chao,HE Qing-hua,LIU Rui-xue,ZHANG BO*,YANG Zhong-xin,ZHOU Min
(Research Institute for Science and Technology of Functional Food, College of Arts and Science,Beijing Union University,Beijing 100191,China)
To explore effect ofHaematococcuspluvialisastaxanthin to mice diabete for decreasing blood glucose and its mechanisms. Experimental diabete mice was induced by alloxan(ALX)(45~50 mg/kg BW iv). With 25 mg/kg and 100 mg/kg dose ofHaematococcuspluvialisastaxanthin(2%)for 14 d lavage alloxan diabete mice,the blood samples of mice were collected by orbit,blood glucose,insulin,SOD,GSH-Px activity and MDA level in the blood were measured. The liver and kidney were taken to weigh,SOD,GSH-Px activity and MDA level in the tissues were measured. The results showed thatHaematococcuspluvialisastaxanthin could significantly(p<0.05)inhibit diabete mice weight of reduction and return to normal,reduce(p<0.01)water intake and diet intake and reduce(p<0.01)high blood glucose levels of diabete mice and improve the ability of antioxidation,the mechanism of ASX in reducing blood glucose might be achieved by regulating the insulin.
Haematococcuspluvialis;astaxanthin;blood glucos;diabetes;mice
2016-06-17
李勇超(1991-),男,硕士研究生,研究方向:生物活性物质的功能与毒理,E-mail:liyongchaoyx@126.com。
*通讯作者:张波(1962-),女,教授,研究方向:生物活性物质的功能与毒理,E-mail:zhangbo_wl@buu.edu.cn。
“十二五”国家科技支撑计划课题(2012BAD33B06);北京联合大学校级科研项目(2015年)。
TS
A
1002-0306(2016)24-0000-00
10.13386/j.issn1002-0306.2016.24.000
