Medpor自体组织化生物相容性研究
2016-02-14樊东力
盛 阳,樊东力
Medpor自体组织化生物相容性研究
盛 阳,樊东力
目的观察Medpor自体组织化后生物相容性的变化。方法 将Medpor补片植入SD大鼠腹部皮下进行自体组织化,4 w后将自体组织化Medpor补片取出备用,按随机原则在背部左、右侧分别植入自体组织化Medpor补片或普通Medpor补片。20处植入自体组织化Medpor补片为A组,20处植入普通Medpor补片为B组。植入2 w后取出补片,行石蜡包埋、切片、HE染色、CD31免疫组化染色及Masson染色,进行生物相容性的评价。结果HE染色、Masson染色观察结果显示,A组组织长入充满补片孔隙,B组组织长入深度约为补片33%;CD31免疫组化染色结果显示,植入后2 w,实验组的微血管密度计数显著大于对照组(P<0.05)。结论Medpor补片自体组织化后再次植入机体靶向部位,可在较短时间内与机体组织建立紧密联系,融合能力较普通Medpor补片强,对于早期血管化有一定的作用,提高了Medpor补片在血供缺乏部位的生物相容性。
Medpor补片;自体组织化;生物相容性;大鼠
耳廓再造的方法是一期植入扩张器,二期于术中放入支架,利用耳部扩张的皮肤覆盖完成耳廓再造。目前使用肋软骨作为支架为临床上较广泛使用的技术[1]。但手术会在供区产生永久性缺陷[2],且移植软骨有被吸收和变形的可能。因此,生物材料被考虑作为支架用于耳廓再造,Medpor就是其中较好的一种。但该材料仍存在一定问题,如耳部组织皮肤薄、血供差,不利于支架快速血管化[3],增加了支架外露、感染的可能性。
Medpor补片具有相互交通的特殊孔结构[4],这种多孔特性允许血管、软组织长入,可减少感染发生率,提高材料与组织结合的强度[5]。新生血管长入支架孔隙,可降低支架外露、感染等并发症风险。因此,快速和足够的血管化是支架植入成功的必不可少的条件[6]。因此,本研究构建自体组织化Medpor补片模型,再移植到靶向部位,应用HE、Masson染色以及CD31免疫组织化学染色,观察自体组织化材料的相关组织学变化,评价其生物相容性,为临床应用提供实验依据。
1 材料与方法
1.1 实验动物 健康雌性成年SD大鼠20只,体质量200~250 g,由本院实验动物中心提供,并统一进行三级饲养。动物生产合格证号:SCXK-(军)2012-0013,SCXK(渝)2012-0005。
1.2 主要材料 Medpor补片(POREX公司,美国);苏木素伊红(HE)染色试剂盒(武汉博士德生物有限公司,中国);Masson染色试剂(福建迈新生物有限公司,中国);CD31抗体(ab119339,abcam,英国)。
1.3 方法
1.3.1 Medpor补片自体组织化 将20只SD大鼠以3%戊巴比妥钠腹腔注射麻醉,固定,腹部备皮,消毒铺巾,于腹部正中作约1 cm长切口,逐层分离,形成约3 cm×3 cm大小囊腔。将消毒备用Medpor补片(10 mm×10 mm×0.85 mm)植入囊腔,缝合、消毒,常规饲养。
1.3.2 对照实验 补片植入腹部4 w后,20只大鼠全身麻醉,腹、背部备皮,消毒铺巾,从大鼠腹部取出20块自体组织化Medpor补片放入PBS液中备用。背部消毒铺巾,在脊柱两侧2 cm处皮肤各作一长约1 cm切口,按随机原则在背部左、右侧分别植入自体组织化Medpor补片或普通Medpor补片,缝合伤口、消毒包扎。20处植入自体组织化Medpor补片为A组,20处植入普通Medpor补片为B组。
1.3.3 标本取材及处理 对照实验2 w后,取出补片及周围约1 mm范围的皮下组织,进行石蜡包埋、切片、HE染色、Masson染色、免疫组化(CD31)染色。
1.4 观察指标
1.4.1 组织形态学观察 将取出补片及周围组织,行石蜡切片,HE染色,光镜下观察相关组织学变化。
1.4.2 纤维化及胶原沉积 切片行Masson染色,光镜下观察补片及周围组织纤维化及胶原沉积情况。
1.4.3 微血管密度 将切片免疫组织化学(CD31)染色后,光镜下观察孔隙内纤维化程度及微血管密度,血管内皮细胞经免疫组织化学染色后出现棕黄色颗粒定性为阳性着色。微血管密度判定标准:在50倍光镜下找到血管密度较为集中的区域;于100倍光镜下进行微血管数目计数,含有红细胞的血管计为1个,取5个高倍视野下的微血管计算平均值,即为血管密度计数(microvessel density,MVD)。
1.5 统计学方法 应用SPSS20.0统计软件进行数据统计分析,计量资料行正态性检验,当不满足时,行对数正态变换,统计描述用x±s表示,组间比较用成组t检验,假设检验水准α=0.05。
2 结果
2.1 形态学观察 两组大鼠生长状态良好,伤口均未见异常。肉眼观察,A组Medpor补片与周围组织结合紧密牢固,外周可见致密透明纤维囊,表面有较多新生血管,内部可见大量组织长入;B组Medpor补片周围可见透明致密膜形成,表面有微血管血管生成,内部有部分组织长入。
2.2 HE染色观察 A组镜下观察可见组织长入充满补片孔隙(图1A),补片外表面出现密集的纤维血管组织,其中含有较丰富的新生血管(图1B);B组组织长入深度约为补片1/3(图1C),补片外表面可见较为稀疏的纤维组织,其中新生血管较少((图1D)。两组补片外周均可见成纤维细胞层,由于边缘刺激,成纤维细胞层在补片边缘略有增加。无明显炎症细胞浸润迹象。
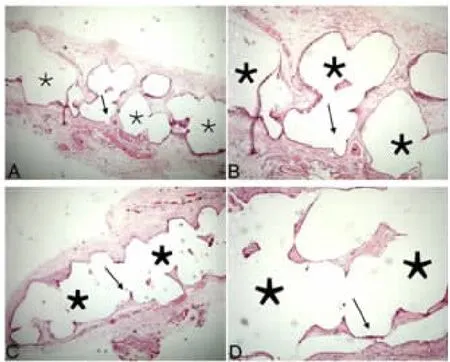
图1 植入2 w后,镜下观察组织长入及补片外表面新生血管情况(HE ×50和×100)
2.3 CD31免疫组化染色观察 A组补片周围呈CD31阳性染色的血管内皮细胞数量显著增多,且分布较为均匀(图2A);B组补片周围CD31阳性染色的血管内皮细胞略有增加,纤维组织淡染呈网状结构(图2B)。
2.4 Masson染色观察 两组补片外表面均有纤维囊包裹,胶原蛋白沉积于细胞层外。纤维血管组织由外表面向补片中心生长。A组组织填满补片孔隙内部(图3A);B组组织细胞浸润深度约为补片1/3(图3B)。
2.5 微血管密度 植入后2 w,实验组的微血管密度计数(7.10±1.85)显著大于对照组(3.10±0.74)(t= 3.7862,P<0.01)。
3 讨论
耳廓再造的方法是一期植入扩张器,二期于术中放入支架,再利用耳部扩张的皮肤作为覆盖物完成耳廓再造。因肋软骨属自体组织,不发生排斥反应,故仍为目前最经典和广泛使用的支架。但这种手术方式也有诸多缺陷,如供区在术后产生永久性缺陷,可能发生软骨吸收、扭曲变形等。

图2 植入2 w后,CD31阳性染色的血管内皮细胞数量(免疫组织化学染色 ×100)
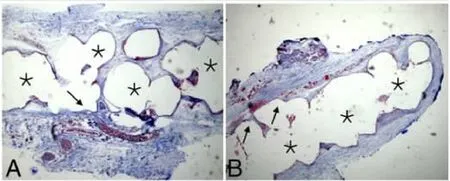
图3 植入2 w后,组织长入及微血管情况(Masson染色 ×50)
Medpor补片已成功地应用于各种面部骨骼的重建和改善。它的优点是:(1)具有良好生物相容性,其特殊孔型结构允许血管、软组织长入,减少感染发生率,提高材料与组织的结合强度;(2)具有较好硬度的同时兼顾了可塑性,易于雕刻,再造耳廓外形逼真;(3)不吸收,长期结构稳定。在耳再造术中,快速和足够的血管化是支架植入成功的必不可少的条件,然而,耳部覆盖组织薄,血供较差,不利于快速血管化,易导致支架植入失败。因此,改善支架早期血管化是现阶段研究的重点。
目前改善生物支架血管化方法有多种,如将特定的生长因子或特定细胞涂抹于支架表面。在重建显微外科中发展出预制的方法,在此方法中,支架被植入比缺陷位置更能促进新生血管生成的 “供区”组织。经过一段时间预植后,拥有广泛血管网络的支架将会被转移到“受区”组织[7]。由于自体细胞将材料自体组织化,可避免产生免疫排斥反应。
本实验将Medpor补片预先埋植于大鼠皮下,构建自体组织化Medpor模型,取出后移植到靶向部位。随后应用HE、Masson染色以及CD31免疫组织化学染色,通过组织学分析,观察自体组织化的血管化效果,评价其生物相容性。根据前期实验,Medpor补片植入后1 w,组织长入深度约为0.1 mm,2 w时为0.6 mm,4 w时组织充满材料孔隙,达到实验中所需的充分组织化要求。故本实验Medpor补片自体组织化时间为4 w。血管生成是由血管生成诱导因子和抑制因子共同介导的一个多细胞参与的多步骤过程。CD31在血管内皮细胞中高度表达,而在淋巴管内皮细胞中则不然。CD31已被证实为敏感的血管内皮细胞特异性标记,是血管生成的一个较为敏感的指标。免疫组化研究使用这些指标来比较植入物内血管生成情况。
本实验结果表明,A组Medpor补片与周围组织结合紧密牢固,内部可见大量组织长入,表面纤维组织含有较丰富的新生血管;B组Medpor补片表面纤维组织稀疏,新生血管较少。免疫组化研究结果显示,A组MVD值显著大于B组。表明自体组织化Medpor补片植入靶向部位2 w后即可与机体组织建立紧密联系,融合能力较普通Medpor补片强,生物相容性好。
本实验所采用的自体组织化方法简便易行,可操作性强,便于临床推广,手术效果佳,但需要二次手术,存在相应的风险,且成本偏高,手术周期长。在整形外科耳廓再造术中,患者预先埋入扩张器,如同时进行支架自体组织化,可能会减少二期手术后由于组织薄血供差,支架出现外露、感染、移位的情况。总的来说,材料自体组织化的方法对临床工作具有参考意义,但具体细节尚需进一步的动物实验和临床试验验证。
[1] Monroy A,K ojima K,Ghanem MA,et al.Tissue engineered cartilage“bioshell”protective layer for subcutaneous implants[J]. Int J PediatrOtorhinolaryngol,2007,71(4):547-552.
[2] Guasti L,Vagaska B,Bulstrode NW,et al.Chondrogenic differentiation ofadipose tissue-derived stem cells within nanocaged POSS-PCU scaffolds:a new tool for nanomedicine[J]. Nanomedicine,2014,10(2):279-289.
[3] Reichel CA,Hessenauer ME,Pflieger K,et al.Components of the plasminogen activation system promote engraftment of porous polyethylene biomaterial via common and distinct effects[J].PLoS One,2015,10(2):e0116883.
[4] Gosau M,Draenert FG,Ihrler S.Facial augmentation with porous polyethylene (Medpor)--histological evidence of intense foreign body reaction[J].J Biomed Mater Res B ApplBiomater,2008,87 (1):83-87.
[5] Couldwell WT,Chen TC,Weiss MH,et al.Cranioplasty with the Medpor porous polyethylene flexblockimplant.Technical note[J]. J Neurosurg,1994,81(3):483-486.
[6] Laschke MW,Schank TE,Scheuer C,et al.In vitro osteogenic differentiation of adipose-derived mesenchymal stem cell spheroids impairs their in vivo vascularization capacity inside implanted porous polyurethane scaffolds[J].ActaBiomater,2014, 10(10):4226-4235.
[7] Papavasiliou G, Cheng MH, Brey EM. Strategies for vascularization of polymer scaffolds[J].J Investig Med,2010,58 (7):838-844.
Establishment and biocompatibility of ectopic prefabricated vascularized porous polyethylene(Medpor)
Sheng Yang,Fan Dongli Department of Plastic and Cosmetic Surgery,Xinqiao Hospital of the Third Military Medical University, Chongqing,400037,China
ObjectiveTo observe the changes in the biocompatibility of ectopic prefabricated vascularized porous polyethylene (Medpor).MethodsMedpor patches were randomly implanted into the abdomen of 20 rats subcutaneously for the establishment of ectopic prefabricated vascularization.Four weeks later,Medpor patches with ectopic prefabricated vascularization were taken out.Those Medpor patches or ordinary Medpor patches were randomly implanted into the right or left side of the back.The 20 sides implanted with ectopic prefabricated vascularized Medpor patches were group A,and the other 20 sides implanted with normal Medpor patches were group B.Two weeks after the implantation,the patches were taken out and received paraffin imbedding,slicing,HE staining,CD31 immunohistochemical staining,and Masson staining.The biocompatibility was evaluated.ResultsHE and Masson staining results demonstrated that group B showed partial fibrovascularization extended toward the center of the implants(33%),while group A showed fibrovascularization extended to the center of the implants(100%).The CD31 immunohistochemical staining showed two weeks after the implantation,the microvessel density of group B was significantly less than that of group A (P<0.05).ConclusionConnection between porous polyethylene (Medpor)and surrounding tissues can be established quickly after ectopic prefabricated vascularization. Ectopic prefabricated vascularized Medpor can increase the biocompatibility of the parts where blood supply is weak.
Medpor;ectopic prefabricated vascularization;biocompatibility;rat
R 318/617
A
1004-0188(2016)04-0367-04
10.3969/j.issn.1004-0188.2016.04.007
2016-01-24)
400037重庆,第三军医大学新桥医院整形美容科
