ABn型分子或离子中离域π键的讨论
2016-02-13程功臻
蔡 苹 胡 锴 程功臻
(武汉大学化学与分子科学学院,武汉430072)
ABn型分子或离子中离域π键的讨论
蔡 苹*胡 锴 程功臻
(武汉大学化学与分子科学学院,武汉430072)
详细讨论了分子中存在离域π键的3个条件和推断分子中离域π键存在形式的3个步骤,同时介绍了原子不共平面时,“离域π键”存在的可能性。文中大量的实例和讨论,有助于读者全面掌握“离域π键”这一知识点。
离域π键;价层电子对互斥;杂化轨道
离域π键是指在一个具有平面结构的多原子分子中,如果彼此相邻的3个或多个原子中,有垂直于分子平面的、对称性一致的、未参与杂化的原子轨道存在,这些轨道可以相互重叠,形成多中心π键,也称“共轭π键”、“非定域π键”或“大π键”[1]。
形成离域π键需要满足以下3个条件:①参与形成离域π键的原子都在同一平面上;②这些原子有相互平行的p轨道;③p轨道上的电子总数小于p轨道数的2倍。前两个条件是为了保证p轨道之间产生最大重叠,最后一个条件则是依据分子轨道理论,几个原子轨道在组合形成分子轨道时,分子轨道数目不变,且成键轨道和反键轨道数目各占一半,p轨道上的电子总数小于p轨道数的2倍,则保证了填充在成键轨道上的电子数多于填充在反键轨道上的电子数,有利于分子体系能量的下降[2]。
虽然教材上将离域π键的定义和形成条件写得非常清楚,但在教学过程中,我们发现还是有很多学生在判断一个分子能否形成离域π键时有困难。究其原因,是在对一个分子的离域π键进行判定时,涉及到了价层电对互斥理论、杂化轨道理论以及对未参与杂化的轨道判断等多个因素,下面我们就以实际例子来看看如何有步骤地对分子的离域π键进行判断。
1 ABn型无机分子或离子中离域π键的判断
对于ABn型无机分子,通过以下3个步骤即可判断分子中是否存在离域π键:
①通过价层电子对互斥理论来判断分子的几何构型。比如:BF3分子中,中心原子B周围的电子个数为3+1×3=6,共3对电子,形成3个B—F σ键,分子为平面三角形,满足了形成离域π键的第一个条件。再比如:NH3分子中,中心原子N周围的电子个数为5+1×3=8,共4对电子,但只形成3个N—H σ键,分子为三角锥形,4个原子不共平面,因此,不满足第一个条件,无法形成离域π键。
②通过杂化轨道理论判断各原子间是否有相互平行的未参与杂化的p轨道。在BF3分子中,B原子周围有3对电子,3个配位原子F,B原子采用等性sp2杂化,剩余一个为未参与杂化的p轨道,满足第二个条件,可与周围F原子的p轨道间形成离域π键。在H2O分子中,O原子周围的电子个数为6+1×2=8,共4对,但只有2个配位原子H,故分子为角形(V形),共平面,满足第一个条件。但由于O原子采用不等性sp3杂化,分子中没有未参与杂化的p轨道,不满足第二个条件,因此无法形成离域π键。
③判断参与形成离域π键的电子数。以BF3分子为例,B的3个sp2杂化轨道中,各有一个单电子,用于与F原子中的成单电子形成σ键,剩下的未杂化的p轨道中,没有电子,但周围的3个F原子中与之平行的p轨道中,各有1对电子,共6个,小于4个p轨道数的2倍,满足第三个条件。因此,4个原子的4个相互平行的p轨道肩并肩地形成了离域π键,其中有6个电子,记做表示的是“四中心六电子”大π键。图1描述了离子中离域π键的形成过程。
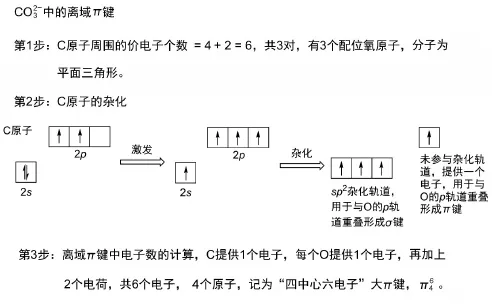
图1 离子中离域π键的形成过程
表1总结了ABn型无机分子中离域π键的形成情况。大部分ABn型无机分子中的离域π键都可以通过这三步来判断推理,但是也有一些例外,下面我们着重讨论CO2分子和NO2分子中的离域π键。

表1 ABn型无机分子中离域π键的形成情况
2 CO2分子中离域π键的讨论
从前面的讨论和表1中可以看出,C原子上尚有2个未参与杂化的、垂直于分子平面的p轨道(py和pz),且每个p轨道上各有1个电子,可分别与2个O原子的py(1个电子)和pz(2个电子)形成三中心的大π键,但由于O原子2个p轨道上的电子数不一致,导致其形成大π键的形式有两种(图2)。在这种情况下,我们必须结合分子本身的性质和分子轨道理论等知识来确定。现代实验已经证实,CO2分子属于抗磁性物质,即分子中无成单电子。如果CO2分子采用图2(b)式形成2个不同的离域键,即和两种离域π键,按照分子轨道的方法,由3个直线排列的原子上的3个平行p轨道组合形成分子轨道时,它们之间平行重叠,均形成π分子轨道,必然一共形成3个分子轨道,这3个分子轨道中,按照能量由低到高,一个是成键π分子轨道,一个是非键轨道,一个是反键π分子轨道,这些处于“大π键”上的电子最终均排布在这些π分子轨道上:“大π键”上有3个电子时,由低到高2个电子排布在成键轨道上,1个在非键轨道上;“大π键”上有5个电子时,由低到高2个电子排布在成键轨道上,2个在非键轨道上,1个在反键轨道上。这样CO2分子的和两种不一样的离域π键中,由于能量较高的反键轨道和能量较低的非键轨道上均有1个未成对的π电子,分子应有顺磁性,且体系的能量较高,应该表现出较强的化学活泼性,而这些与实验事实不符。因此,CO2分子中的离域π键应为图2(a)式,即两个离域π键[3,4]。此时“大π键”上有4个电子,它们排布在成键和非键轨道上各2个,均已经成对,故为抗磁性。注意这些结果与图上不完全一致,这是价键理论的局限性。
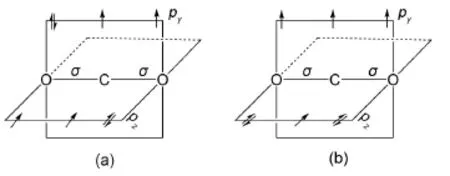
图2 CO2分子中两种可能的离域π键
3 NO2分子中离域π键的讨论
关于NO2分子的离域π键,教材上提到的有两种(图3)。
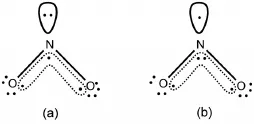
图3 NO2分子中两种可能的离域π键
中心原子N采用sp2杂化,分子共平面,但其周围只有2个O原子,故其中2个杂化轨道与O原子的p轨道重叠形成σ键。但是,还剩下的1个杂化轨道里是填充1个电子还是1对电子呢(图4)?如果填充1对电子,则未参与杂化的pz轨道上剩下1个电子,与2个配位O原子中的pz轨道重叠,形成离域π键(图3(a))。反之,形成离域π键(图3(b))。
与CO2分子中离域π键的讨论一样,在这种情况下,我们应该结合物质本身的性质来判断。我们知道,NO2分子容易二聚形成无色的、反磁性的N2O4分子,而这一过程,可以看作是2个NO2分子中的成单电子配对形成σ键所致(图5),这也说明在其分子中,杂化轨道上尚有1个成单电子,而未参与杂化的pz轨道上填充的是1对电子,故在NO2分子中形成的是离域π键(图3(b))[5]。

图4 NO2分子中N原子的杂化

图5 NO2分子的二聚过程
除了通过第1小节中提到的3个步骤来推断分子中的离域π键外,“等电子体”也可以帮助我们快速地判断出分子的离域π键,比如,我们知道了CO2分子中有2个离域键,不难判断出其等电子体和分子中的离域键。
4 原子不共平面的离域π键
本文主要讨论的是常见的由p轨道重叠形成离域π键的情况,采用σ键与π分离的方法来讨论,即σ键由中心原子的杂化轨道形成,余下的p轨道参与形成离域π键,为使其最大重叠,要求原子尽可能在同一平面。
但是,1985年发现的C60分子,由60个碳原子组成的球形结构,其C原子采用sp2.28的方式杂化,所有分子共球面,但不共平面,每个C原子提供1个具有单电子的p轨道,相互重叠形成离域π键[1]。可见,在同一个球面上的原子,只要其原子轨道能够有效重叠,也能形成离域π键,以提高分子的稳定性。
同样,d轨道在参与形成离域π键时,由于其空间分布特点,并不一定要求所有原子共面。比如SF6为八面体分子,中心S原子以sp3d2杂化轨道与8个F原子的2px轨道形成6个σ键,S原子中空的3d轨道(3dxy,3dyz,3dxz)可接受F原子对称性合适的2p轨道的电子对形成d-pπ键,应是3个使S—F键具有部分双键特征[6]。
5 结语
“离域π键”的教学是无机化学中的重点和难点,本文通过具体的实例,讲述了判断分子中离域π键的3个步骤,并指出了分子不共平面时的特殊情况。总之,一个体系能否形成离域π键,取决于各原子轨道间能否实现有效重叠,以及体系是否出现共轭效应所应具有的性质,如体系能量降低等。
[1]宋天佑,程 鹏,徐家宁,张丽荣.无机化学.第3版.北京:高等教育出版社,2015.
[2]陶 宁,方 力.安徽教育学院学报(自然科学版),1998,No.2,47.
[3]赵国华.大学化学,1996,11(2),53.
[4]汤德祥.大学化学,2004,19(2),49.
[5]谢成根.六安师专学报,1996,No.4,79.
[6]韦 薇,王良明,郭子义.中央民族大学学报(自然科学版),1999,8(1),74.
Discussion of the Delocalized π-Bond in ABnMolecules
CAI Ping*HU Kai CHENG Gong-Zhen
(College of Chemistry and Molecular Sciences,Wuhan University,Wuhan 430072,P.R.China)
Conditions for formation of the delocalized π-bond inABnmolecules were discussed in detail. Three steps were introduced to help judging the formation of delocalized π-bond in ABnmolecules.The delocalized π-bond in some non-planar molecules was also discussed.
Delocalized π-bond;Valence shell electron pair repulsion;Hybridized orbital
G64;O61
10.3866/PKU.DXHX201606027
*通讯作者,Email:caiping@whu.edu.cn
www.dxhx.pku.edu.cn
