脂肝方对非酒精性脂肪性肝炎大鼠脂肪酸、血脂、肝功能及肝细胞病理形态学的影响
2016-02-13张耀中张渐轩罗莉川胡鹏言李蓓蕾谢博文纪云西李柳梅
陈 雁,张耀中,张渐轩,罗莉川,胡鹏言,李蓓蕾,谢博文,纪云西,李柳梅
(1.广西中医药大学,广西南宁530001;2.浙江中医药大学附属第一医院,浙江杭州310001;3.贵港市中医院,广西贵港537100)
脂肝方对非酒精性脂肪性肝炎大鼠脂肪酸、血脂、肝功能及肝细胞病理形态学的影响
陈 雁1,张耀中1,张渐轩1,罗莉川1,胡鹏言1,李蓓蕾1,谢博文1,纪云西2,李柳梅3
(1.广西中医药大学,广西南宁530001;2.浙江中医药大学附属第一医院,浙江杭州310001;3.贵港市中医院,广西贵港537100)
[目的]探讨脂肝方(ZGF)对非酒精性脂肪性肝炎(NASH)大鼠脂肪酸、血脂、肝功能及肝细胞病理形态学的影响。[方法]SPF级健康SD大鼠(雌雄各半)160只随机分为正常组40只、模型组40只(8 w模型组、12 w模型组各20只)、西药对照组20只及脂肝方(ZGF)高、中、低剂量组各20只。正常组予普通饲料喂养,余组予高脂饲料喂养制备NASH模型,8 w非酒精性脂肪肝病(NAFLD)模型成功后各组给予相应药物4 w,于第12周末采血,检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)和总胆固醇(TC)及游离脂肪酸(FFA)含量,并观察肝组织病理变化。[结果]结果表明,与8 w正常组相比,8 w模型组肝细胞内脂肪变性,脂滴沉积,12 w模型组较8 w模型组肝细胞间有较多的气球样变、大泡性脂变,有明显肝细胞坏死及炎细胞浸润。除ZGF低剂量组外,各用药组肝细胞变性坏死及炎细胞浸润均较12 w模型组明显改善,以ZGF高剂量组最明显。12 w模型组ALT、AST、FFA含量及TC、TG含量高于8 w模型组(P<0.05),与12 w模型组相比,西药对照组和ZGF高、中剂量组的ALT、AST、FFA、TC及TG含量均降低(P<0.05),ZGF高剂量组各指标含量最低且低于8 w模型组(P<0.05)。[结论]脂肝方对非酒精性脂肪性肝(NAFLD)发展到非酒精性脂肪性肝炎(NASH)大鼠肝组织炎症有一定的改善作用,机制可能与其降低ALT和AST、TG、TC及FFA水平有关。
非酒精性脂肪性肝炎;脂肝方;生化指标;病理形态学
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是由多病因引起的代谢性肝脏疾病,而非酒精性脂肪性肝炎(nonalcoholic steatosis hepatitis,NASH)属于NAFLD的一种病理类型。随着人们生活水平的增高,其患病率也逐年增高,在我国,NAFLD是仅次于病毒性肝炎的第二大肝脏疾病[1]。NASH严重威胁着人类的健康,疾病后期可进展为肝硬化、肝癌,而肝硬化不可逆转,严重影响人们的健康及生活质量[2]。前期的研究表明脂肝方(ZGF)可以有效改善肝内炎症活动度,证实ZGF是治疗NASH的有效方剂[3]。本研究通过复制NASH大鼠模型,观察ZGF对从NAFLD到NASH大鼠肝组织相关生化指标及病理形态学的影响,从而探讨ZGF抑制肝组织炎症的作用机制,为临床NASH的防治提供实验依据。
1 实验材料
1.1 动物SPF级健康SD大鼠(雌雄各半)160只,体质量(200±20)g,购于广西医科大学实验动物中心,动物许可证号:SCXK桂2013-0002。在实验过程中对动物的饲养及处理符合动物伦理学标准。分笼饲养于室温22~26℃、相对湿度60%~80%、明暗各12 h的动物实验室内。
1.2 药物脂肝方(处方由党参25 g、白术20 g、山楂20 g、虎杖15 g、决明子20 g、姜黄10 g组成,由广西中医药大学第一附属医院提供,水煎浓缩制成每毫升药液含生药1.1 g,4℃保存)。阿托伐他汀钙片(商品名:立普妥,每片10 mg,辉瑞制药有限公司生产,国药准字:J20030047,批号:N93619)。
1.3 试剂及仪器谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)及总胆固醇(TC)试剂盒(南京建成生物工程研究所);Rat游离脂肪酸(free fatty acid,FFA)ELISA试剂盒(武汉华美工程公司);S500P型自动生化光谱分析仪(法国Gilson公司);5417R型高速冷冻离心机(德国EPPENDORF公司);RM2135 Leica切片机(无锡市华宝切片机制造总公司);OLYMPUS BX51型正置显微镜(日本OLYMPUS)。
2 方法
2.1 动物分组及模型的制备将160只SD大鼠随机分为正常组40只、模型组40只(8 w模型组、12 w模型组各20只)、西药对照组20只、ZGF高剂量组20只、ZGF中剂量组20只、ZGF低剂量组20只。正常组予普通饲料喂养,其他组参照文献[4]的造模方法予高脂饲料喂养(2%胆固醇+10%猪油+ 88%标准饲料),饲养8 w病理确认非酒精性脂肪性肝病造模成功后,除正常组外,余组继续给予高脂饲料喂养,同时正常组和模型组给予相当于成人等效剂量蒸馏水,ZGF高、中、低剂量组大鼠给予脂肝方水煎剂(分别相当于成人等效剂量的15、10、5倍)灌胃给药,西药对照组给予阿托伐他汀钙片1 mg/kg灌胃,每日1次,连续4 w。
2.2 标本采集实验于第8 w末从正常组、模型组中各随机取出20只大鼠麻醉后采血液标本,处死并采集肝脏标本;肝组织进行HE染色,其血清检测ALT和AST、TG和TC及FFA水平;其余的正常组、模型组、ZGF高剂量组、ZGF中剂量组、ZGF低剂量组和西药对照组于12 w末,全部大鼠经隔夜禁食12 h,饮水不限,称大鼠体质量,10%水合氯醛腹腔注射麻醉,腹主动脉采血,静置2 h后离心,分离血清,分装后-80℃保存备用。采血后作腹部正中切口打开腹腔,迅速取出肝脏,在肝脏右叶中部,距肝脏边缘0.5 cm处取约0.5 cm×0.5 cm× 0.5 cm的肝组织10%甲醛固定,常规制备成石蜡块。
2.3 观察指标
2.3.1 肝组织病理染色取距离肝边缘0.5 cm处相同部位肝右叶组织小块,大小约0.5 cm×0.5 cm×0.5 cm,经体积分数为10%中性甲醛溶液固定标本,常规脱水、石蜡包埋,作3 μm连续切片,常规HE染色,光镜下观察大鼠肝组织病理学改变。NAFLD活动度积分(NAS)组织学评分判断标准[5]见表1,满分为8分。

表1 NAFLD活动度积分组织学评分判断标准
2.3.2 血清中ALT、AST、TG和TC含量检测取大鼠血清用S500P型自动生化光谱分析仪(法国Gilson公司)检测血清ALT、AST、TG和TC的含量。
2.3.3 血清FFA含量检测取大鼠血清按Rat FFA ELISA试剂盒(武汉华美工程公司)说明书进行操作,于450 nm波长处测吸光度。以Curve Expert曲线拟合软件计算标准曲线的回归方程,分别计算样品浓度。
2.4 统计学分析采用SPSS20.0软件进行统计分析。计量资料以均数±标准差(±s)表示,两样本均数间比较采用t检验;多个样本间比较采用单因素方差分析(one-way-ANOVA),P<0.05为差异具有统计学意义。
3 结果
3.1 脱落或终止情况各组大鼠在喂养及NASH模型复制过程中,均未见死亡。但在灌药过程中,可能因灌胃操作不当,导致ZGF低剂量组大鼠死亡2只,ZGF中剂量组和高剂量组大鼠死亡各1只。
3.2 8w正常组与8w模型组肝细胞病理光镜观察见图1。

图1 8w大鼠肝细胞病理结果(×200)
如图示,8 w正常组大鼠肝细胞形态正常,肝小叶内结构完整,肝索排列整齐有序,肝细胞未见变性、坏死或炎性细胞浸润。8 w模型组大鼠肝组织中可见少量肝细胞脂肪变性,气球样变,胞质内可见大小不等量圆形脂滴。两图对比,说明NAFLD大鼠造模成功。
3.3 各组大鼠12 w肝组织病理学改变情况
3.3.1 各组大鼠12 w肝细胞HE染色光镜图见图2。HE染色显示,12 w模型组大鼠肝小叶结构不清晰,肝索放射状排列不明显,大部分细胞肿胀,并大小不均,细胞轮廓模糊,胞核消失或被脂肪空泡挤向一侧。脂肪泡以气球样变为主,汇管区及小叶内炎症细胞浸润和散在的点状坏死增多。经各药物组干预后,ZGF低剂量组除外,各用药组肝小叶结构基本完整清晰,肝索放射状排列明显,部分肝细胞体积增大,胞浆内充满大小不等的脂肪空泡,以气球样变为主,在中央静脉及汇管区周边脂变程度较轻。汇管区可见炎性细胞浸润,偶见肝细胞坏死灶。其中以ZGF高剂量组脂肪滴及炎症浸润减少最明显,见图2。

图2 12w各组大鼠肝组织病理学改变情况(×200)
3.3.2 各组肝组织NAFLD活动度积分(NAS)比较见表2。8 w模型组NAS<3分,可排除NASH;12 w模型组NAS>4分,可诊断为NASH。与12 w模型组相比,西药对照组、ZGF高剂量组、ZGF中剂量组的NAS降低(P<0.05)。
3.4 各组血清ALT、AST、TG、TC及FFA水平比较见表3。
表2 各组肝组织NAFLD活动度积分(NAS)比较(分,s)
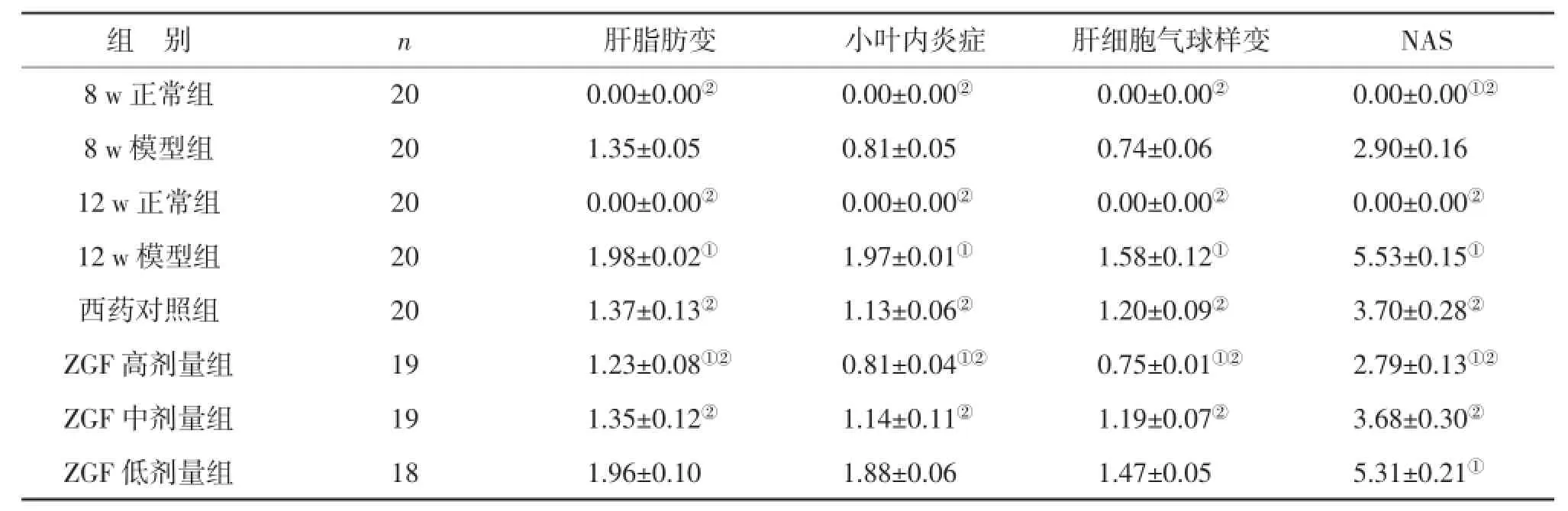
表2 各组肝组织NAFLD活动度积分(NAS)比较(分,s)
注:与8 w模型组比较,①P<0.05;与12 w模型组比较,②P<0.05
组别n肝脂肪变小叶内炎症肝细胞气球样变NAS 8 w正常组200.00±0.00②0.00±0.00②0.00±0.00②0.00±0.00①②8 w模型组201.35±0.050.81±0.050.74±0.062.90±0.16 12 w正常组200.00±0.00②0.00±0.00②0.00±0.00②0.00±0.00②12 w模型组201.98±0.02①1.97±0.01①1.58±0.12①5.53±0.15①西药对照组201.37±0.13②1.13±0.06②1.20±0.09②3.70±0.28②ZGF高剂量组191.23±0.08①②0.81±0.04①②0.75±0.01①②2.79±0.13①②ZGF中剂量组191.35±0.12②1.14±0.11②1.19±0.07②3.68±0.30②ZGF低剂量组181.96±0.101.88±0.061.47±0.055.31±0.21①
表3 各组血清ALT、AST、TG、TC及FFA水平比较(±s)

表3 各组血清ALT、AST、TG、TC及FFA水平比较(±s)
注:与8 w模型组比较,①P<0.05;与12 w模型组比较,②P<0.05;与西药对照组比较,③P<0.05
组别nALT(U/L)AST(U/L)TG(mmol/L)TC(mmol/L)FFA(μmol/L)8 w正常组2050.35±7.68①②③91.20±15.28①②③0.49±0.08①②③2.09±0.42①②③344.33±53.99①②③8 w模型组2067.60±8.83③138.35±10.20③0.73±0.13③3.31±0.42③475.81±54.72③12 w正常组2051.05±6.70①②③90.70±11.45①②③0.50±0.07①②③2.31±0.45①②③345.12±56.02①②③12 w模型组2093.61±10.46①③166.22±13.11①③1.11±0.08①③4.42±0.51①③605.83±60.32①③西药对照组2074.88±7.23②117.35±13.18②0.92±0.08②3.94±0.44②504.87±62.13②ZGF高剂量组1957.11±9.29①②③110.68±16.18①②③0.59±0.08①②③2.61±0.42①②③409.22±57.80①②③ZGF中剂量组1975.16±8.38②118.01±16.81②0.91±0.11②3.95±0.47②505.45±60.11②ZGF低剂量组1893.02±10.36③167.01±16.97③1.10±0.08③4.41±0.48③606.13±65.52③
4 讨论
非酒精性脂肪性肝炎(NASH)是常见的慢性肝脏疾病,主要为血中游离脂肪酸(free fatty acid,FFA)的增高,肝细胞脂肪变性,细胞凋亡增加[6],并伴随有血清转氨酶的升高等表现。脂质代谢紊乱导致的肝内脂质异常沉积是NASH发生发展的基础。肝脏中聚集的脂质包括甘油三酯、胆固醇和FFA等[7]。NASH患者体内的FFA升高水平与疾病的严重程度有关[8],研究表明,甘油三酯对细胞的损伤程度较小,FFA是具有高度细胞毒性的分子,作用于肝细胞可致线粒体肿胀和通透性增加,肝细胞变性、坏死和炎性浸润,从而导致细胞功能失调和凋亡[9]。在正常情况下肝脏摄取血中的FFA,合成TG及少量胆固醇和磷脂,同时将TG与载体蛋白或脂蛋白释放到血液中,当肝脏摄入的脂肪量超过肝脏的脂质和氧化能力,或者肝脏合成低密度脂蛋白障碍时,肝脏合成的内源性TG就不能以脂蛋白的形式进出肝脏,导致脂质在肝细胞内外堆积而形成脂肪肝。ALT、AST是评价肝功能的重要指标,是诊断非酒精性脂肪肝炎的可靠评价标准[10]。ALT主要存在于肝细胞胞浆内,轻微的肝细胞损伤即可引起ALT的升高,20%AST位于胞浆,80%位于线粒体内,当血清AST显著升高并排除心脏病变后,应首先考虑肝细胞线粒体大量破坏、坏死。NASH发生时往往伴随着线粒体功能的损害,导致ALT及AST水平升高。中医认为,NASH者多素体脾虚,嗜食肥甘厚腻,饮食失节,脾失健运,水湿内停,湿热内蕴,痰浊凝滞,瘀血内结,终致湿浊痰瘀互结于肝,阻滞肝脉而最终形成NASH。在治法上,肝病当先实脾。东垣有曰:“其治肝有余不足,或泻或补,惟脾胃之药之切。”《金匮要略》云:“实脾则肝自愈,此治肝补脾之要妙也”。脂肝方具有健脾益气、宣畅气化、化痰祛瘀之功效,可以有效控制脂肪肝向脂肪性肝炎发展。本研究通过复制NASH大鼠模型,观察ZGF对NAFLD、NASH大鼠肝组织生化指标的影响,通过高脂饲料喂养大鼠8 w后,模型组大鼠光镜下见肝组织中几乎所有细胞脂肪变性,未见肝小叶,肝细胞损伤严重,胞质内可见大量圆形脂滴,细胞核被挤向边缘。12 w后,模型组大鼠肝组织存在广泛而严重的大泡及小泡混合型的肝细胞脂肪沉积及部分坏死,中央静脉周围炎症细胞浸润,炎性细胞浸润以大量单个核细胞为主,细胞核被脂滴挤压到细胞边缘,也可见少量纤维组织增生等,与文献报道[11-12]改变一致;模型组血清ALT、AST水平较对照组明显升高,这与组织学上炎症坏死程度相一致,表明造模12 w后脂肪肝大鼠发展为脂肪性肝炎,采用ZGF对NASH大鼠模型进行干预后,肝组织病理学结果显示肝脏损伤明显好转,肝细胞呈轻度水样变,脂肪变性减少,仅见少数肝细胞呈脂肪变,个别呈气球样变,末见明显的肝细胞坏死及炎细胞浸润,偶见轻度纤维组织增生,汇管区扩大不明显,血清ALT、AST水平明显降低,其中脂肝方高剂量组对肝细胞损伤程度改善明显,提示ZGF对从脂肪肝到NASH大鼠的肝组织炎症有一定的改善作用且有一定的量效关系,机制可能与其降低ALT、AST、TG、TC及FFA含量有关。
[1]邹必英.非酒精性脂肪肝病因病机浅析[J].山东中医杂志,2013,32(5):301-302.
[2]Forbes S,Taylor-Robinson S D,Patel N,et al.Increased prevalence of non alcoholic fatty liver disease in European women with a history of gestational diabetes[J].Diabetologia,2011,54(3):641-647.
[3]刘佳.脂肝方对非酒精性脂肪肝大鼠中脂联素抵抗素影响研究[D].广州:广州中医药大学,2011.
[4]范健高,钱燕,郑晓英,等.已酮可可碱对非酒精性脂肪性肝炎大鼠肝脏核因子-κB信号通路及胰岛素抵抗的干预作用[J].中华肝胆杂志,2006,14(10):762-766.
[5]中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].中华肝脏病杂志,2010,18(3):163-166.
[6]Feldstein A E,Gores G J.Apoptosis in alcoholic and nonalcoholic steatohepatitis[J].Frontiers in Bioscience,2005(10):3093-3099.
[7]Mc Cullough A J.The clinical features,diagnosis and natural history of nonalcoholic fatty liver disease[J].Clinics in liver disease,2004(8):521-533.
[8]Musso G,Gambino R,Cassader M.Recent insights into hepatic lipid metabolism in non-alcoholic fatty liver disease(NAFLD)[J].Progress in lipid research,2009(48): 1-26.
[9]Unger R H.Lipid overload and overflow:metabolic trauma and the metabolic syndrome[J].Trends in endocrinology and metabolism tem,2003(14):398-403.
[10]Giannini E G,Testa R,Savarino V.Liver enzyme alteration:a guide for clinicians[J].CMAJ,2005(172):367-379.
[11]George J,Pera N,Phung N,et al.Lipid peroxidation,stellate cell activation and hepatic fibrogenesis in a rat model of chronic steatohepatitis[J].J Hepatol,2003,39(5):756-764.
[12]Leclercq I A,Farrell G C,Field J,et al.CYP2E1 and CYP4A as microsomal catalysts of lipidperoxides in murine nonalcoholic steatohepatitis[J].J Clin Invest,2000,105(8):1067-1075.
(编辑 熊 瑜)
R256.43
A
2095-4441(2016)04-0009-04
2016-11-01
国家自然科学基金项目(编号:80120531、80140715);广西高等学校重点资助科研项目(编号:201102ZD023)
陈雁(1990-),女,广西玉林人,研究方向:脾胃、肝胆疾病的临床与实验研究
纪云西,教授,研究方向:脾胃、肝胆疾病的临床与实验研究;E-mail:ji-yunxi@163.com
