刚地弓形虫DXR基因的克隆表达与生物学特性分析
2016-02-09宗红英蔡国斌
章 莹,宗红英,何 立,蔡国斌
刚地弓形虫DXR基因的克隆表达与生物学特性分析
章 莹1,宗红英2,何 立2,蔡国斌2
目的 对刚地弓形虫1-脱氧-D-木酮糖-5-磷酸还原异构化酶(TgDXR)基因进行克隆、表达、纯化和生物学特性分析。方法收集、纯化RH株弓形虫速殖子,提取cDNA和基因组DNA;PCR扩增TgDXR的基因片段;构建成熟TgDXR/pET-24b重组原核表达载体;经双酶切、PCR及测序鉴定阳性克隆;在大肠杆菌BL21中用IPTG诱导表达。亲和层析纯化重组TgDXR蛋白,并对该蛋白的生物学特性和酶的动力学活性进行分析。结果从弓形虫RH株的cDNA和基因组DNA中分别扩增出长度为1 542 bp和5 464 bp的TgDXR片段,成功构建重组质粒;SDS-PAGE结果表明,目的基因在大肠杆菌中高效表达。重组蛋白的相对分子量约50 kDa。酶活性实验显示,Mg2+、Mn2+是最佳金属螯合离子,反应最佳pH值为7.5,该酶活性抑制剂膦胺霉素(Fosmidomycin)对该酶蛋白的IC50为0.52 μmol/L。结论RH株刚地弓形虫TgDXR可在原核表达系统中高效表达,该重组蛋白具有生物学活性,并有望作为弓形虫特异性药物靶标。
刚地弓形虫;DXR;克隆表达;膦胺霉素
刚地弓形虫(Toxoplasmagondii)是一种专性细胞内寄生的顶复门原虫。弓形虫病是一种危害十分严重的人兽共患寄生虫病[1]。目前,该病治疗尚无理想的特效药物,主要以乙胺嘧啶和磺胺类药物联合应用为主。寻求新型的活性高、毒性低、能完全杀灭弓形虫缓殖子的药物是研究的焦点[2-3]。
动物体内类异戊二烯有2种不同类型的合成途径,即甲羟戊酸(MVA)途径和2C-甲基-D-赤藓醇-4-磷酸(MEP)途径。MVA合成途径主要存在于人、动物、酵母真菌及一些古细菌当中,而MEP途径是绝大多数病原微生物如结核分枝杆菌、幽门螺杆菌、肺炎杆菌、脑膜炎双球菌、梅毒密螺旋体、以及顶复门寄生原虫如疟原虫、弓形虫等合成萜类化合物的唯一途径[4]。MEP途径在不同物种之间的这一差异,使得催化该途径的酶成为潜在的、同时又具有选择性的分子药物靶。1-脱氧-D-木酮糖-5-磷酸还原异构化酶(DXR)是MEP途径中的第2个反应关键酶[4]。膦胺霉素(fosmidomycin, Fos)是传统的DXR小分子抑制剂,是研究MEP途径的有用工具[5]。本研究通过克隆弓形虫DXR(TgDXR)基因,构建原核表达载体,对体外表达的蛋白进行纯化,对该酶的生物学活性及Fos对其的抑制活性进行了分析,从而为深入研究TgDXR作为药物靶标奠定了基础。
1 材料与方法
1.1 虫株、菌株、主要试剂 弓形虫RH株(国际标准强毒株)液氮保存,Trizol、原核表达质粒pET-24b、T4 DNA连接酶、大肠杆菌E.coliDH5α、E.coliBL21(RIL)购自TaKaRa公司,限制性内切酶NdeI、HindIII、cDNA合成试剂盒、基因组DNA提取试剂盒、质粒提取试剂盒等购自Promega公司,Ni-NTA agarose购自Amersham Biosciences公司,异丙基-β-D-硫代半乳糖苷(IPTG)、膦胺霉素(Fos)、NADPH、BSA等试剂均购自Sigma公司。
1.2 PCR引物的设计与合成 根据GenBank数据库刚地弓形虫基因组中目的基因序列(DS984747,scf_1112359874706 genomic scaffold)和(XM_002370765,mRNA),分别设计2对TgDXR基因扩增的特异性引物:一对长片段PCR技术(long-range PCR)扩增TgDXR基因组序列和合成该基因cDNA全长的上游引物TgDXR-F:5′-CTCTTCTCTGTCAACTCACCATGTTGAAG-3′,对应的下游引物TgDXR-R:5′-GAGGGCCTTTAAGCCGAGGAAGTGAACACG-3′;另一对为体外表达TgDXR酶成熟蛋白的含限制性内切酶的RT-PCR上游引物TgDXR-NF:5′-GCCATATGAAGAGACTTGTGGTTTTGGGAAG-3′(NdeI),对应的下游引物TgDXR-HR:5′-GGAAGCTTCTTCCTCGGCTTAAAGGCCCTCG-3′(HindIII),由武汉擎科创新生物科技有限公司合成。
1.3TgDXR基因组序列扩增 从液氮中取出RH株弓形虫,37 ℃水浴解冻,腹腔注射小鼠,数天后抽取腹腔液,分别用胰酶和氯化铵液消化,生理盐水洗涤,离心得速殖子。使用基因组DNA提取试剂盒参照说明书提供的方法提取弓形虫基因组DNA。以合成的DNA为模板进行长片段PCR扩增:94 ℃预变性4 min;94 ℃变性40 s,65 ℃退火50 s,72 ℃延伸6 min,35个循环;72 ℃延伸10 min。PCR产物行1%琼脂糖凝胶电泳,EB染色鉴定。PCR产物与pGEM-T Easy载体连接,转化E.coliDH5α,筛选阳性克隆,提取质粒,测序鉴定。
1.4TgDXR基因cDNA序列扩增 参照Trizol试剂盒说明提取弓形虫总RNA,再按照逆转录试剂盒说明合成cDNA。以合成的cDNA为模板PCR扩增:95 ℃预变性2 min;95 ℃变性30 s,58 ℃退火50 s,68 ℃延伸1.5 min,35个循环;68 ℃延伸5 min。PCR产物行1%琼脂糖凝胶电泳鉴定。琼脂糖凝胶回收试剂盒回收纯化PCR产物。
1.5TgDXR基因与表达载体的连接、转化及鉴定将PCR产物和原核表达质粒pET-24b经NdeI、HindIII双酶切, 琼脂糖凝胶回收试剂盒回收酶切产物。目的基因TgDXR与质粒pET-24b T4连接酶16 ℃连接过夜。连接产物转化入感受态细胞E.coliDH5α中, 卡那霉素筛选阳性克隆, 提取阳性克隆质粒、双酶切, 1 %琼脂糖凝胶电泳鉴定并测序鉴定。
1.6 重组蛋白的诱导表达和纯化 将已鉴定的重组质粒pET-24b/TgDXR转化入感受态细胞E.coliBL21中,挑取单个菌落接种于含卡那霉素的5 mL LB液体培养基中, 37 ℃, 250 r/min振摇12 h, 按1∶100接种于含卡那霉素的5 mL LB液体培养基中,同样条件下培养至对数期OD600为0.4~0.6时, 加入IPTG 至终浓度0.25 mmol/L诱导表达4 h。将菌液离心进行10% SDS-PAGE、考马斯亮蓝R250染色分析重组蛋白表达情况。确定最佳诱导条件后,按照上述方法进行大量诱导表达,离心收集菌体,PBS重悬,冰浴超声裂解,12 000 r/min,4 ℃离心20 min收集上清,用Ni-NTA agarose参照说明书,用不同浓度咪唑的缓冲液进行洗涤,获得纯化的目的蛋白。
1.7TgDXR酶生物学特性测定TgDXR酶活性测定参照文献[6]方法进行。在U型96孔微量培养版中,每孔内100 nmol/LTgDXR酶蛋白、4 mmol/L MgCl2、100 μmol/L DXP、100 μmol/L NADPH和50 μg/mL BSA溶解于50 mmol/L HEPES缓冲液(pH7.6)中,使用Beckman DTX-880 microplate reader连续10 min、每隔30 s测定OD340值。酶活性抑制实验则在反应液加入DXP之前,抑制剂膦胺霉素(Fos)和TgDXR酶先在30 ℃孵育10 min。不同金属离子、不同Mg2+浓度和不同pH值对酶活性的影响实验同上进行。所有数据使用Prism(version 5.0)软件进行统计分析。为了尽量减少误差,重复3次独立性实验。
2 结 果
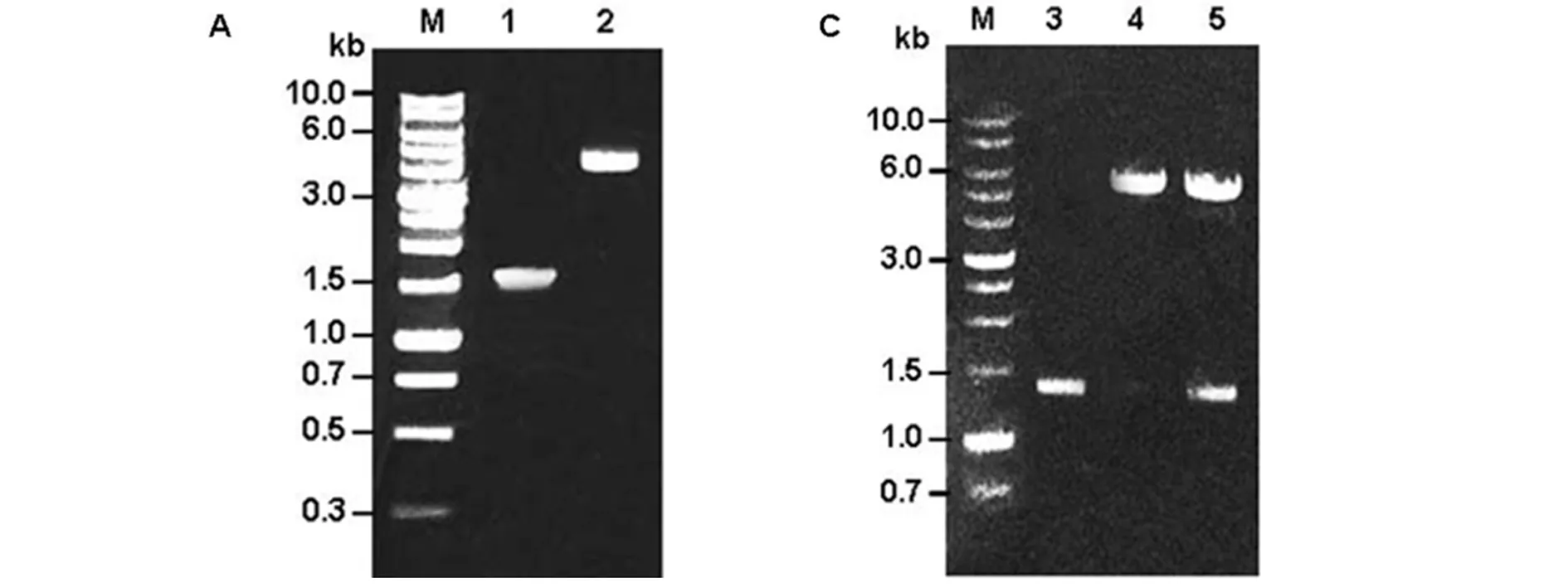
2.1TgDXR基因的PCR扩增与重组表达质粒pET-24b/TgDXR的鉴定 分别以弓形虫RH株速殖子的cDNA和基因组DNA(gDNA)为模板,PCR扩增该基因的cDNA开放阅读框区和基因组序列。PCR扩增产物的1%琼脂糖凝胶电泳结果如图1A所示。测序结果显示,TgDXR的cDNA开放阅读框序列全长为1 542 bp;TgDXR的gDNA序列长为5 464 bp;两者的碱基长度和准确度与预期序列的一致度>99%。通过比对分析,发现TgDXR基因由8个外显子和7个内含子组成(图1B)。重组表达质粒pET-24b/TgDXR通过NdeI、HindIII双酶切后可见5 310 bp和1 341 bp 2条带(图1C,泳道5)。PCR鉴定结果和测序结果显示,目的基因成熟蛋白表达区为1 341 bp(图1C,泳道3),与预期TgDXR成熟区序列一致。结果表明pET-24b/TgDXR重组表达质粒构建正确(图1C和D)。
2.2 重组蛋白TgDXR的表达与纯化 重组质粒pET-24b/TgDXR转入大肠杆菌BL21感受态细胞后,在37 ℃、IPTG终浓度为0.25 mmol/L、诱导表达4 h时可获得大量表达的可溶性目的蛋白,该重组蛋白预测的理论分子量约为50.3 kDa。经Ni-NTA agarose镍亲和层柱法纯化后进行SDS-PAGE分析,在50 kDa处有一条清晰的目的蛋白回收带(与理论分子量一致),即纯化后的目的蛋白(图2)。
2.3TgDXR酶生物学特性 在Mg2+和NADPH存在的情况下,体外原核表达的重组TgDXR成熟蛋白具有酶的活性。不同金属离子对酶活性的影响实验显示:Mn2+对酶活性的影响几乎与Mg2+相同,而以Co2+作为螯合离子时,酶的活性只有一半(图3A)。Mg2+浓度对酶活性的影响结果显示:随着Mg2+浓度的升高,该酶的活性逐渐增强,4 mmol/L时酶的活性达到最大(图3B)。酶反应缓冲液的pH值对酶活性的影响结果显示:pH 6.5 ~ 8.5时该酶蛋白均有酶活性,而当pH值为7.5~8.0时,酶活性相对最强(图3C)。DXR酶活性抑制剂膦胺霉素(Fos)对酶活性的影响结果表明:随着抑制剂浓度的升高,酶活性逐渐被抑制,经Prism 5.0软件分析该小分子化合物的半抑制浓度IC50为(0.520±0.043)μmol/L(图3D)。

M: 蛋白质分子质量标准; 1. 表达原液部分; 2. 未结合部分; 3. 洗脱部分; 4. 纯化部分1; 5. 纯化部分2; 6. 纯化部分3
M: Protein molecular weight marker; 1. original fractions; 2. un-binding fractions; 3. washing fractions; 4. elucted fraction 1; 5. elucted fraction 2; 6. elucted fraction 3
图2 重组TgDXR成熟蛋白纯化SDS-PAGE分析
Fig.2 Purification of recombinant matureTgDXR protein by SDS-PAGE analysis
3 讨 论
类异戊二烯及其衍生物在细胞的初级和次级代谢中起着重要的作用。研究发现,类异戊二烯的合成有2种不同类型的途径,即甲羟戊酸(MVA)途径和2C-甲基-D-赤藓醇-4-磷酸(MEP)途径[4]。经典的MVA合成途径存在于人和动物宿主中;而绝大多数病原微生物以及顶复门寄生原虫如疟原虫、弓形虫等合成萜类化合物的唯一途径是MEP途径[7]。顶质体(apicoplast)对于顶复门寄生原虫的生存有着极为重要的作用,阻断其某些基因的复制与表达后,虫体将无法继续增殖、立即死亡[8-9]。Nair等人(2011)提示顶复门原虫DXR可能存在于顶质体内发挥催化类异戊二烯合成的作用[10]。DXR酶蛋白是MEP途径中的第2个反应关键酶,其在二价金属离子和NADPH的辅助下催化1-脱氧-D-木酮糖-5-磷酸(DXP)发生异构并还原生成MEP。该反应是MEP代谢途径中最重要的限速反应和整个类异戊二烯化合物代谢中的重要调控位点[11]。基因组信息数据分析表明,该酶在人和哺乳动物机体中未发现,而在病原微生物和顶复门寄生原虫中存在[12]。因此利用DXR这一潜在药物靶标位点研制抗菌和抗寄生原虫药物成为人们的研究兴趣。不同物种DXR的动力学参数不同,相差也较大。二价金属离子可作为DXR的辅基,该酶催化时必须以NADPH作为专一辅酶[13]。膦胺霉素Fos及其衍生物FR900098是传统的DXR抑制剂,是研究MEP途径的有用工具[12]。体外实验显示Fos及其衍生物能有效抑制恶性原虫存活[14],体内实验以文氏鼠疟原虫(Plamodiumvinckei)感染小鼠为模型,显示Fos能够有效治愈鼠疟疾类异戊二烯及其衍生物在细胞的初级和次级代谢中起着重要的作用
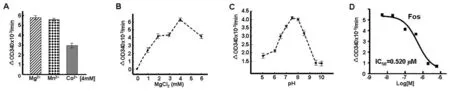
A. 二价金属离子对酶活性的影响;B. Mg2+浓度对酶活性的影响;C. pH值对酶活性的影响;D. DXR抑制剂(膦胺霉素,Fos)对酶活性的影响A.Effects of divalent metal ions on TgDXR activity; B.effects of [Mg2+] on TgDXR catalyzed reaction; C.effects of pH on TgDXR catalyzed activity;D.effects of DXR inhibitor (fosmidomycin, Fos) on TgDXR activity.图3 重组TgDXR成熟酶蛋白生物学特性分析Fig.3 Biological characteristic analysis of the recombinant mature TgDXR enzyme
关于弓形虫DXR的研究,相对于疟原虫DXR报道较少。本研究先根据GenBank注释的T.gondiiME49株的DXR基因序列设计特异性引物,PCR克隆T.gondiiRH株DXR基因序列,结果扩增出的基因序列与预测的ME49株的DXR基因序列大小相等,顺序一致性高于99%。前期研究提示:顶复门原虫与植物的类异戊二稀合成代谢酶的N-末端均具有顶质体靶向引导肽序列,包括信号肽和转导肽[16]。根据比对结果分析,TgDXR 1-67位氨基酸应是一个引导肽区域,而68-513位共446个氨基酸构成了TgDXR成熟蛋白。
本研究把去掉信号肽和转导肽片段的TgDXR成熟蛋白区克隆到原核表达质粒,并在大肠杆菌中进行可溶性表达。所表达的融合蛋白经SDS-PAGE分析分子量与推测的分子量相吻合,表明所获表达产物的大小与目的基因产物所编码蛋白的大小相一致。之后利用体外重组表达的TgDXR成熟蛋白进行酶生物学特性分析和抑制动力学试验。研究表明,体外重组表达的TgDXR蛋白在Mg2+或Mn2+存在条件下,能氧化NADPH并催化DXP生成MEP。而Co2+作为螯合剂时,酶的催化活性减半。小分子化合物DXR-抑制剂膦胺霉素(Fos)对TgDXR活性有较强的抑制作用,提示TgDXR是开发新型抗弓形虫药物的重要靶标。
[1] Wang JL, Huang SY, Behnke MS, et al. The past, present, and future of genetic manipulation inToxoplasmagondii[J]. Trends Parasitol, 2016, DOI: 10.1016/j.pt.2016.04.013
[2] Zeng YB, Zhu SH, Han HY, et al. Efficacy on different kinds of drugs against acute murine toxoplasmosis[J]. Chin J Zoonoses, 2011, 27(4): 316-319. (in Chinese)
曾艳波, 朱顺海, 韩红玉, 等. 抗急性弓形虫病药物疗效的研究[J]. 中国人兽共患病学报, 2011, 27(4): 316-319.
[3] Zhang RY, Liu Q, Shang LM, et al. Progress on anti-Toxoplasmagondiidrugs[J]. Progr Vet Med, 2010, 31(1): 95-100. (in Chinese)
张瑞岩, 刘全, 商立民, 等. 抗弓形虫药物研究进展[J]. 动物医学进展, 2010, 31(1): 95-100.
[4] Shi WJ, Wang HH. The MEP pathway: a potential drug target[J]. Chin J Antibiotics, 2008, 33(2): 65-68. (in Chinese)
施文钧, 王洪海. MEP途径:一个潜在的分子药靶[J]. 中国抗生素杂志, 2008, 33(2): 65-68.
[5] Nair SC, Brooks CF, Goodman CD, et al. Apicoplast isoprenoid precursor synthesis and the molecular basis of fosmidomycin resistance inToxoplasmagondii[J]. J Exp Med, 2011, 208(7): 1547-1559.
[6] Kuzuyama T, Takahashi S, Takagi M, et al. Characterization of 1-deoxyxylulose-5-phosphate reductoisomerase, an enzyme involved in isopentenyl diphosphate biosynthesis, and identification of its catalytic amino acid residues[J]. J Biol Chem, 2000, 275: 19928-19932.
[7] Mueller C, Schwender J, Zeidler J, et al. Properties and inhibition of the first two enzymes of the non-mevalonate pathway of isoprenoid biosynthesis[J]. Biochem Soc Trans, 2004, 28: 792-793.
[8] Seeber F, Soldati-Favre D. Metabolic pathways in the apicoplast of apicomplexa[J]. Int Rev Cell Mol Biol, 2010, 281: 161-228.
[9] Wiesner J, Jomaa H. Isoprenoid biosynthesis of the apicoplast as drug target[J]. Curr Drug Targets, 2007, 8: 3-13.
[10] Nair SC, Brooks CF, Goodman CD, et al. Apicoplast isoprenoid precursor synthesis and the molecular basis of fosmidomycin resistance inToxoplasmagondii[J]. J Exp Med,2011, 208: 1547-1559.
[11] Shigi Y. Inhibition of bacterial isoprenoid synthesis by fosmidomycin, a phosphonic acid-containing antibiotic[J]. J Antimicrob Chemother 2007, 24: 131-145.
[12] Kuntz L, Tritsch D, Grosdemange-Billiard C, et al. Isoprenoid biosynthesis as a target for antibacterial and antiparasitic drugs: phosphonohydroxamic acids as inhibitors of deoxyxylulose phosphate reductoisomerase[J]. Biochem J, 2005, 386: 127-135.
[13] Argyrou A, Blanchard JS. Kinetic and chemical mechanism ofMycobacteriumtuberculosisl-deoxy-D-xylulose-5-phosphate isomeroreductase[J]. Biochemistry,2004, 43: 4375-4384.
[14] JomaaH, Wiesner J, Sanderbrand S. Inhibitors of the nonmevalonate pathway of isoprenoid biosynthesis as anti-malarial drugs[J]. Science, 1999, 285: l573-1576.
[15] Wiesner J, Henschker D, Hutchinson DB, et al.Invitroandinvivosynergy of fosmidomycin, a novel antimalarial drug, with clindamycin[J]. Antimicrob Agents Chemother, 2002, 46: 2889-2894.
[16] Xue J, Diao JS, Cai GB, et al. Antimalarial and structural studies of pyridine-containing inhibitors of 1-deoxyxylulose-5-phosphate reductoisomerase[J]. ACS Med Chem Lett, 2013, 4: 278-282.
Cloning, expression and biological features of Toxoplasma gondii DXR
ZHANG Ying1, ZONG Hong-ying2, HE Li2, CAI Guo-bin2
(1.DepartmentofMedicalGenetics,WuhanUniversitySchoolofBasicMedicalSciences,Hubei430071,China;>2.DepartmentofHumanParasitology,WuhanUniversitySchoolofBasicMedicalSciences,Hubei430071,China)
To clone, express and purify of the 1-deoxy-D-xylulose-5-phosphate reductoisomerase (DXR) gene fromToxoplasmagondiiRH strain and analyze its biological characters, the DXR ofT.gondii(TgDXR) was amplified from cDNA and genomic DNA by PCR. The mature domain ofTgDXR was cloned into the pET-24b vector to construct the prokaryotic expression vectorTgDXR/pET-24b, which was efficiently expressed inE.coliBL21 (RIL). RecombinantTgDXR was purified by Ni-NTA affinity chromatography. The biological properties of this enzyme were characterized and enzyme activity/fosmidomycin (Fos) inhibition assay was tested. Result showed thatTgDXR in the non-mevalonate isoprene biosynthesis pathway was a potential target for developingToxoplasmakilling drugs.
Toxoplasmagondii;(DXR); prokaryotic expression; fosmidomycin
Cai Guo-bin, Email: gbcai2011@whu.edu.cn
10.3969/j.issn.1002-2694.2016.012.009
中央高校基本科研业务费专项资金资助(No.2042015kf036)
蔡国斌,Email: gbcai2011@whu.edu.cn
1. 武汉大学基础医学院医学遗传学系,武汉 430071; 2. 武汉大学基础医学院人体寄生虫学教研室,武汉 430071
R382.5
A
1002-2694(2016)12-1091-05
2016-06-08;
2016-09-02
Supported by the Fundamental Research Funds for the Central Universities (No. 2042015kf036)
