旋毛虫肌幼虫排泄分泌抗原诊断早期旋毛虫病的研究
2016-02-09胡晨曦王李昂刘春颖宋艳艳刘若丹王中全
文 慧,胡晨曦,王李昂,王 涵,刘春颖,宋艳艳, 刘若丹,姜 鹏,王中全,崔 晶
旋毛虫肌幼虫排泄分泌抗原诊断早期旋毛虫病的研究
文 慧,胡晨曦,王李昂,王 涵,刘春颖,宋艳艳, 刘若丹,姜 鹏,王中全,崔 晶
目的 评价旋毛虫肌幼虫排泄分泌(excretory-secretory,ES)抗原诊断早期旋毛虫病的价值。方法应用旋毛虫肌幼虫ES抗原Western blot对旋毛虫感染后6~11 d的小鼠血清及19 d的早期旋毛虫病人血清进行检测,并与感染后35 d的晚期旋毛虫病人和其他寄生虫病人血清的检测结果进行比较。结果Western blot分析显示,肌幼虫ES蛋白中的2条蛋白带(41.5、55 kDa)可被旋毛虫感染后7~11 d的小鼠血清识别,6条蛋白带(41.5、44.1、45、55、61和65.2 kDa)能被早期和晚期旋毛虫病人血清识别,阳性反应率均为100%(15/15);这6条蛋白带与裂头蚴病人和健康人血清无交叉反应,但与其他寄生虫病(血吸虫病、并殖吸虫病、华支睾吸虫病、棘球蚴病及囊尾蚴病)患者血清具有明显的交叉反应(19.12%~38.23%)。结论旋毛虫肌幼虫 ES 抗原中的41.5 kDa~65.2 kDa蛋白带可与旋毛虫感染早期血清反应,但与其他蠕虫病患者有明显的交叉反应。
旋毛虫病;旋毛虫;肌幼虫;排泄分泌抗原;Western blot;早期诊断
旋毛虫病是一种严重的食源性人兽共患寄生虫病,主要因生食或半生食含有旋毛虫幼虫的猪肉、其它动物肉类及肉制品所致。全世界198个国家(或地区)中66个有旋毛虫病分布[1],1986-2009年世界上44个国家报告65 818例病人,死亡42例[2]。1964-2009年,我国12个省、市、自治区发生了577 起人体旋毛虫病暴发,发病25 125例,死亡251人[3]。近年来我国居民的旋毛虫感染率呈上升趋势,据2001-2004年全国10个省(市、区)人体重要寄生虫病调查,人群旋毛虫血清抗体阳性率为3.38%,估计我国人体旋毛虫感染者达4 000多万[4]。旋毛虫肌幼虫排泄-分泌(excretory-secretory, ES)抗原诊断旋毛虫病具有较高的敏感性和特异性,是国内外用于旋毛虫病血清学诊断的主要抗原[5]。旋毛虫肌幼虫ES抗原ELISA是国际旋毛虫病委员会(International Commission on Trichinellosis, ICT)和国际兽医局 (Office International des Epizooties, OIE)推荐用于初步诊断旋毛虫感染的首选血清学方法, ELISA 阳性者需经Western blot 分析确认[6-7];当检测到针对旋毛虫肌幼虫ES抗原40~70 kDa蛋白带的特异性抗体时,可确认为旋毛虫感染[8]。
当应用旋毛虫肌幼虫ES抗原通过Western blot检测患者血清或进行血清流行病学调查时,由于不能确定旋毛虫感染的具体时间,肌幼虫ES抗原Western blot分析能否用于旋毛虫感染的早期诊断目前尚不清楚。鉴于此,本文应用旋毛虫肌幼虫ES抗原通过Western blot对感染旋毛虫的早期小鼠血清及旋毛虫病暴发后的早期患者血清进行检测,并与晚期旋毛虫病和其他寄生虫病患者血清的检测结果进行了比较。
1 材料与方法
1.1 旋毛虫虫种与实验动物 实验用旋毛虫为河南省南阳猪源旋毛虫(ISS 534),由本室昆明小鼠传代保种。健康雄性6周龄昆明小鼠购自河南省实验动物中心。
1.2 旋毛虫肌幼虫的收集与ES抗原 将300条旋毛虫肌幼虫经口感染30只小鼠,感染后42 d 处死。膈肌压片镜检证实感染成功后,剥皮,去除内脏和脂肪,将全身骨骼肌搅碎,用人工消化液[0.33%胃蛋白酶(活性为 1∶31 000,北京芳草试剂公司进口分装)-0.7%盐酸-0.85%氯化钠]消化,按贝氏法收集肌幼虫[9],用无菌生理盐水洗涤后移至RPMI-1640培养基中,37 ℃培养18 h。收集的培养液于超滤管(Amicon Ultra-4)中,低温超滤浓缩后即为肌幼虫ES蛋白[10]。经Bradford法测定蛋白浓度为2.6 mg/mL,-80 ℃保存待用。
1.3 试验血清 将300条旋毛虫肌幼虫经口感染10只小鼠, 感染后6~15 d尾静脉采血分离血清,经肌幼虫ES抗原ELISA检测的阳性小鼠血清用于后续的Western blot分析。30份旋毛虫病患者血清为我国云南省两次旋毛虫病暴发后,经流行病学、临床学、血清学(ELISA或IFT)或病原学检查确诊后的患者血清[11-12],其中15份为感染后19 d 的早期旋毛虫病患者血清,15份为感染后35 d的晚期旋毛虫病患者血清。确诊的华支睾吸虫病、并殖吸虫病、裂头蚴病、棘球蚴病、日本血吸虫病及囊尾蚴病患者血清, 均为本室采集与保存。健康人血清为健康献血者血清。所有血清样本-80 ℃保存备用。
1.4 SDS-PAGE 采用Bio-Rad公司电泳系统,分离胶浓度为12%,积层胶浓度为5%,肌幼虫ES抗原蛋白浓度为10 μg/孔。100 ℃水浴5 min后上样。在浓缩胶电压为80 V,分离胶电压为120 V条件下进行电泳2.5 h。电泳结束后将凝胶采用考马斯亮蓝染色4 h,脱色至条带清晰后,用蛋白图谱扫描仪(美国GE公司产品,分辨率为300 bpi,像素为8 bits)扫描成图像,数字化图像用Gene Genius凝胶图像分析软件分析,用蛋白Marker标定样品蛋白电泳条带的分子质量[13]。
1.5 Western blot 将未染色的凝胶、聚偏二氟乙烯膜(PVDF,美国Millipore公司产品)以及滤纸均在转印缓冲液中浸泡20 min。将凝胶中的蛋白转印至PVDF膜,转印条件为恒压17 V,35 min。PVDF膜用5%脱脂奶粉封闭,37 ℃孵育1 h。加入1∶100稀释的病人血清,4 ℃过夜孵育;TBST洗涤后,加入1∶5 000稀释的HRP标记的羊抗小鼠或羊抗人IgG(HRP-IgG, Sigma),37 ℃孵育1 h,洗涤后加二氨基联苯胺(DAB,Sigma)-H2O2底物显色,置Milli-Q水终止反应[14],扫描拍照后,避光保存。
2 结 果
2.1 旋毛虫肌幼虫ES抗原的SDS-PAGE及其与感染小鼠血清反应的Western blot分析 旋毛虫肌幼虫ES抗原经SDS-PAGE分析显示19条蛋白带,分子量分别为97、79、65.2、61、55、53、49、45、44.1、41.5、37、35.1、33.6、31、29.6、27、22.4、18及15 kDa(图1A)。Western blot结果显示,肌幼虫ES抗原中的2条蛋白带(41.5、55kDa)可被旋毛虫感染后7~11 d的小鼠血清识别;感染后26 d的小鼠血清可识别6条蛋白带(55、49、44.1、41.5、37、22.4及18 kDa),感染后42 d的小鼠血清可识别所有的肌幼虫ES抗原蛋白带(图1B)。
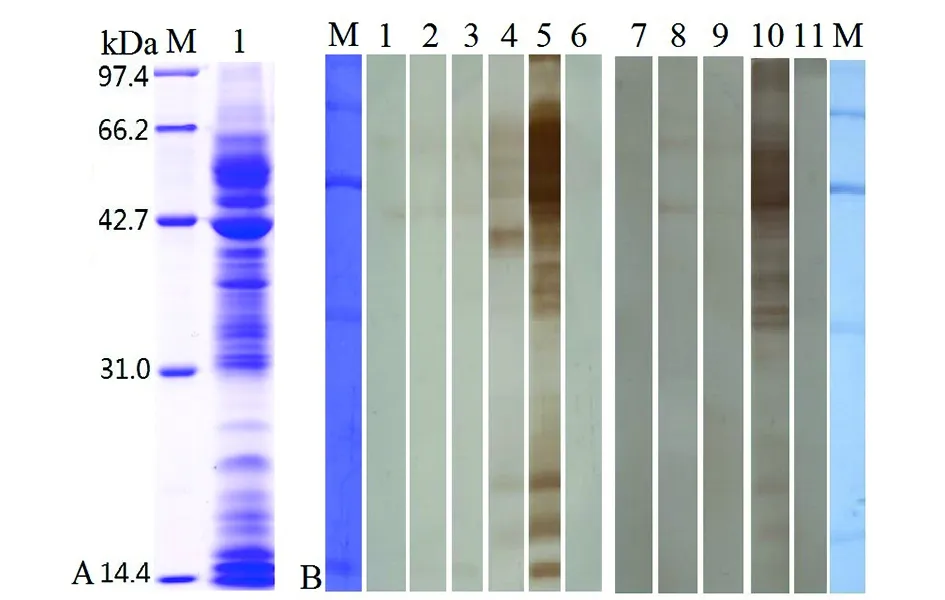
A: 旋毛虫肌幼虫ES蛋白的SDS-PAGE分析. M:低分子量蛋白Marker;1:旋毛虫肌幼虫ES蛋白;B. 旋毛虫肌幼虫ES蛋白与感染小鼠血清反应的的Western blot分析. M:低分子量蛋白Marker;1~4:旋毛虫感染后9~11 d及26 d小鼠血清;5与10:旋毛虫感染后42 d小鼠血清;6与11:正常小鼠血清;7~9:旋毛虫感染后6~8 d小鼠血清A: SDS-PAGE analysis of T. spiralis muscle larval ES antigens; M: protein molecular weight marker; 1: T. spiralis muscle larval ES antigens; B: Western blot analysis of T. spiralis muscle larval ES antigens by using mouse infection sera; M: protein molecular weight marker; 1~4: sera of mice infected with T. spiralis at 9~11 and 26 dpi; 5 and 10: sera of mice infected with T. spiralis at 42 dpi; 6 and 11: normal mouse sera; 7~9: sera of mice infected with T. spiralis at 6~8 dpi.图1 旋毛虫肌幼虫ES抗原的SDS-PAGE及其与感染小鼠血清反应的Western blot分析Fig.1 The SDS-PAGE and Western blot analysis of T. spiralis muscle larval ES antigens by mouse infection sera
2.2 肌幼虫ES蛋白与旋毛虫病人血清反应的Western blot分析 Western blot分析结果显示,肌幼虫ES蛋白中的17条蛋白带(65.2、61、55、53、49、45、44.1、41.5、37、35.1、33.6、31、29.6、27、22.4、18及15 kDa)可被早期旋毛虫病人血清识别;14条蛋白带(65.2、61、55、53、49、45、44.1、41.5、37、35.1、33.6、31、18及15 kDa)可被晚期旋毛虫病人血清识别;肌幼虫ES蛋白与健康人血清无阳性反应(图2)。
2.3 肌幼虫ES蛋白与其他寄生虫病人血清反应的Western blot分析 旋毛虫肌幼虫ES蛋白中的一些蛋白带(分子量范围为22.4~65.2 kDa)与其他蠕虫病患者血清具有交叉反应;其中11条蛋白带(65.2、61、55、53、49、44.1、41.5、37、35.1、33.6及31 kDa)与9份日本血吸虫病患者血清的交叉反应率均达100%(9/9);41.5、45 kDa和53~65.2 kDa蛋白带与并殖吸虫病患者血清具有明显的交叉反应;61、55、49 kDa蛋白带与华支睾吸虫病人血清的交叉反应率为43%(3/7)、29%(2/7)及29%(2/7)(图3)。53 kDa蛋白带与囊尾蚴病人血清的交叉反应率为45.45%(5/11),61、53和45 kDa蛋白带与棘球蚴病人血清的交叉反应率均为31%(4/13);肌幼虫ES抗原与裂头蚴病人血清无交叉反应(图4)。
旋毛虫肌幼虫ES蛋白中的6条蛋白带(41.5、44.1、45、55、61和65.2kDa)均能被早期和晚期旋毛虫病人血清识别,阳性反应率均为100%(15/15),但这6条蛋白带与其他蠕虫病人血清具有较高的交叉反应率(19.12%~38.23%)。虽然肌幼虫ES蛋白中的15、18 kDa蛋白带与其他寄生虫病人血清无交叉反应,但与早期旋毛虫病人血清的阳性反应率仅为60%~73.33%(表1)。

M:低分子量蛋白Marker;A1~15:早期旋毛虫病人血清;B1~15:晚期旋毛虫病人血清;C1~10:健康人血清M: protein molecular weight marker; A1~15: sera of early patients with trichinellosis at 19 dpi; B1~15: sera of late patients with trichinellosis at 35 dpi; C1~10: sera of normal persons 图2 旋毛虫肌幼虫ES蛋白与旋毛虫病人血清反应的Western blot分析Fig.2 Western blot analysis of T. spiralis muscle larval ES antigens by sera of patients with trichinellosis

M:低分子量蛋白Marker;A1~12:并殖吸虫病人血清;B1~9:日本血吸虫病人血清;C1~7: 华支睾吸虫病人血清M: protein molecular weight marker; A1~12: sera of patients with paragonimiasis; B1~9: sera of patients with schistosomiasis; C1~7: sera of patients with clonorchiasis图3 旋毛虫肌幼虫ES蛋白与吸虫病人血清反应的Western blot分析Fig.3 Western blot analysis of T. spiralis muscle larval ES antigens by sera of patients with trematodiasis

M:低分子量蛋白Marker;A1~11:囊尾蚴病人血清;B1~13:棘球蚴病人血清;C1~6:裂头蚴病人血清M: protein molecular weight marker; A1~12: sera of patients with cysticercosis; B1~13: sera of patients with echinococcosis; C1~6: sera of patients with sparganosis图4 旋毛虫肌幼虫ES蛋白与囊尾蚴病等其他寄生虫病人血清反应的Western blot分析Fig.4 Western blot analysis of T. spiralis muscle larval ES antigens by sera of patients with cysticercosis and other parasitic diseases
3 讨 论
在旋毛虫的不同发育期中,肌幼虫在宿主体内的存活时间最长,在人体内肌幼虫可存活30年,肌幼虫的ES抗原主要来自杆状体,直接暴露于宿主的免疫系统,是诱导宿主产生抗体应答的主要靶抗原[15]。由于旋毛虫肌幼虫容易通过人工消化法收集,目前国内外对旋毛虫病诊断抗原的研究主要集中在肌幼虫期抗原[6]。
本研究结果表明,旋毛虫肌幼虫ES蛋白中的6条主要蛋白带(41.5、44.1、45、55、61和65.2kDa)均能被感染后19 d的早期旋毛虫病人血清识别,也可被晚期旋毛虫病人血清识别,阳性反应率均为100%(15/15)。虽然这6条蛋白带与健康人血清和裂头蚴病人血清无交叉反应,但与其他蠕虫病人血清具有较高的交叉反应在,尤其是与日本血吸虫病和并殖吸虫病等病人血清具有明显的交叉反应。其他学者的研究亦表明,旋毛虫肌幼虫ES抗原的主要蛋白带(42~46、49、53~54及 64 kDa)与其他蠕虫病患者血清之间亦存在有交叉反应[16]。抗血吸虫gp50的单抗和抗血吸虫gp50阳性的血吸虫病人血清,均可与旋毛虫肌幼虫皮下层和杆状体发生阳性反应,表明血吸虫抗原gp50是与旋毛虫肌幼虫抗原发生血清学交叉反应的主要抗原[17]。应用DNA重组技术体外表达的旋毛虫21、31及43 kDa抗原,与血吸虫病等其他蠕虫病人血清也有部分交叉反应[18-20]。上述结果提示,旋毛虫肌幼虫ES抗原与上述蠕虫存在有明显的共同抗原[21]。国际旋毛虫病委员会推荐用于Western blot 确认旋毛虫感染的肌幼虫 ES 抗原40~70 kDa蛋白带,虽然能检测出早期和晚期旋毛虫病人血清抗旋毛虫抗体,但与日本血吸虫病、并殖吸虫病等蠕虫病患者血清具有明显的交叉反应。由于这些蠕虫病是我国常见的寄生虫病,因此,在我国应用肌幼虫 ES 抗原Western blot检测血清样本,当41.5~65.2kDa蛋白带出现阳性反应时,应结合病史、临床表现和其他实验室检查结果,与这些蠕虫病进行鉴别。
表1 旋毛虫肌幼虫ES抗原与旋毛虫病和其他蠕虫病患者血清Western blot阳性反应的蛋白带分析
Tab.1 Western blot analysis of protein bands of T. spiralis muscle larval ES antigens positively reacted with sera of patients with trichinellosis and helminthiasis

肌幼虫ES抗原分子量(kDa)MolecularweightofmusclelarvalESantigens阳性反应血清份数(%)No.ofpositivesera(%)早期旋毛虫病患者血清(n=15)Seraofearlypatientswithtrichinellosis(n=15)晚期旋毛虫病患者血清(n=15)Seraoflatepatientswithtrichinellosis(n=15)其他蠕虫病患者和正常人血清(n=68)Seraofpatientswithotherhelminthiasisandnormalpersons(n=15)65.215(100.00)15(100.00)18(26.47)61.015(100.00)15(100.00)26(38.23)55.015(100.00)15(100.00)26(38.23)45.015(100.00)15(100.00)13(19.12)44.115(100.00)15(100.00)16(23.53)41.515(100.00)15(100.00)20(29.41)18.09(60.00)4(26.67)015.011(73.33)4(26.67)0
虽然肌幼虫ES蛋白中的15、18kDa蛋白带与其他寄生虫病人及健康人血清无交叉反应,但与早期旋毛虫病人血清的阳性反应率仅为60%~73.33%,用于早期旋毛虫病血清学诊断的敏感性达不到临床诊断旋毛虫病的要求。因此,今后需要从旋毛虫感染宿主后的早期发育阶段(如肠道感染性幼虫、早期成虫或成虫)中筛选与鉴定旋毛虫病的早期特异性诊断抗原[22]。
[1] Pozio E. World distribution ofTrichinellaspp. infections in animals and humans[J]. Vet Parasitol, 2007, 149(1-2): 3-21.
[2] Murrell KD, Pozio E. Worldwide occurrence and impact of human trichinellosis, 1986-2009[J]. Emerg Infect Dis, 2011, 7(12): 2194-2202.
[3] Cui J, Wang ZQ, Xu BL. The epidemiology of human trichinellosis in China during 2004-2009[J]. Acta Trop, 2011, 118(1): 1-5.
[4] Wang LD. Investigation on the current national status of major human parasitic diseases in China[M]. Beijing: People's Publishing House, 2008: 84-89. (in Chinese)
王陇德. 全国人体重要寄生虫病现状调查[M]. 北京:人民卫生出版社, 2008:84-89.
[5] Wang ZQ, Cui J. Diagnosis and treatment of trichinellosis[J]. Chin J Parasitol Parasit Dis, 2008, 26(1): 53-57. (in Chinese)
王中全,崔晶. 旋毛虫病的诊断与治疗[J].中国寄生虫学与寄生虫病杂志,2008, 26(1): 53-57.
[6] Gamble HR, Pozio E, Bruschi F, et al. International Commission on Trichinellosis: recommendations on the use of serological tests for the detection ofTrichinellainfection in animals and man[J]. Parasite, 2004, 11(1):3-13.
[7] Dupuy-Camet J, Bruschi F. Management and diagnosis of human trichinellosis. In: Dupouy-Camet J, Murrell KD (Eds.), FAO/WHO/OIE guidelines for the surveillance, management, prevention and control of trichinellosis[M]. FAO/WHO/OIE, Paris, France, 2007: 37-68.
[8] Dupouy-Camet J, Kociecka W, Bruschi F, et al. Opinion on the diagnosis and treatment of human trichinellosis[J]. Expert Opin Pharmacother, 2002, 3(8): 1117-1130.
[9] Li F, Cui J, Wang ZQ, et al. Factors affecting the sensitivity of artificial digestion and its optimization for inspection ofTrichinellaspiralisin meat[J]. Foodborne Pathog Dis, 2010, 7(8): 879-885.
[10] Wang L, Cui J, Hu DD, et al. Identification of early diagnostic antigens from major excretory-secretory proteins ofTrichinellaspiralismuscle larvae using immunoproteomics[J]. Parasit Vectors, 2014, 7(1): 40.
[11] Wang CQ, Wu FW, Wang XR, et al. Survey of an outbreak of trichinellosis in Lanchang county of Yunnan province[J]. China Trop Med, 2013, 13(11): 1433-1434. (in Chinese)
王春泉,吴方伟,王兴荣,等.云南省澜沧县一起旋毛虫病暴发的调查[J]. 中国热带医学, 2013, 13(11): 1433-1434.
[12] Wang ZQ, Cui J, Xu BL, et al. Diagnosis of trichinellosis[S].Health criteria of People's Republic of China,2015.
王中全,崔晶,许汴利,等. 旋毛虫病的诊断[S].中华人民共和国卫生行业标准,2015.
[13] Liu RD, Jiang P, Wen H,. Screening and characterization of early diagnostic antigens in excretory-secretory proteins fromTrichinellaspiralisintestinal infective larvae by immunoproteomics[J]. Parasitol Res, 2016, 115(2): 615-622.
[14] Wang L, Wang ZQ, Cui J. Protein changes ofTrichinellaspiralismuscle larvaeinvitroinduced by bovine bile[J]. Vet Parasitol, 2013, 194(2-4): 164-167.
[15] Bolas-Fernandez F, Corral Bezara LD. TSL-1 antigens ofTrichinella: an overview of their potential role in parasite invasion, survival and serodiagnosis of trichinellosis[J]. Res Vet Sci, 2006, 81(3): 297-303.
[16] Yera H, Andiva S, Perret C, et al. Development and evaluation of a Western blot kit for diagnosis of human trichinellosis[J]. Clin Diagn Lab Immunol, 2003, 10(5): 793-796.
[17] Linder E, Thors C, Lundin L, et al. Schistosome antigen gp50 is responsible for serological cross-reactivity withTrichinellaspiralis[J]. J Parasitol, 1992, 78(6): 999-1005.
[18] Ren DF, Cui J, Wang ZQ, et al. Prokaryotic expression of the antigen gene Ts43 ofTrichinellaspiralisand identification of its recombinant protein[J]. Chin J Zoonoses. 2008, 24(6): 539-542. (in Chinese)
任道锋,崔晶,王中全,等. 旋毛虫抗原基因Ts43原核表达及重组蛋白鉴定[J].中国人兽共患病学报,2008, 24(6):539-542.
[19] Wang R, Wang ZQ, Cui J. Immunodiagnostic value and immune protection of the recombinant Ts21 antigen ofTrichinellaspiralis[J]. Chin J Parasitol Parasit Dis, 2009, 27(1): 17-21. (in Chinese)
王睿, 王中全, 崔晶. 旋毛虫Ts21重组蛋白的免疫诊断价值及免疫保护作用的研究[J]. 中国寄生虫学与寄生虫病杂志, 2009,27(1):17-21.
[20] Cui J, Wang L, Sun GG, et al. Characterization of aTrichinellaspiralis31 kDa protein and its potential application for the serodiagnosis of trichinellosis[J]. Acta Trop, 2015, 142: 57-63.
[21] Chan SW, Ko RC. Comparison between standard ELISA and dot-ELISA for serodiagnosis of human trichinosis[J]. Trans R Soc Trop Med Hyg, 1988, 82(6): 892-894.
[22] Sun GG, Liu RD, Wang ZQ, et al. New diagnostic antigens for early trichinellosis: the excretory-secretory antigens ofTrichinellaspiralisintestinal infective larvae[J]. Parasitol Res, 2015, 114: 4637-4644.
Early serodiagnosis of trichinellosis by Western blot with excretory-secretory antigens fromTrichinellaspiralismuscle larvae
WEN Hui, HU Chen-xi, WANG Li-ang, WANG Han, LIU Chun-ying,SONG Yan-yan, LIU Ruo-dan, JIANG Peng, WANG Zhong-quan, CUI Jing
(DepartmentofParasitology,BasicMedicalCollege,ZhengzhouUniversity,Zhengzhou450052,China)
To evaluate the value ofTrichinellaspiralismuscle larval excretory-secretory (ES) antigens for early serodiagnosis of trichinellosis, the larvae were cultured in RPMI-1640 at 37 ℃ in 5% CO2for 18 h and the ES antigens were analyzed by SDS-PAGE. Western blot withT.spiralismuscle larval ES antigens was used to detect the serum samples from mice infected withT.spiralisat 6-11 days post infection (dpi) and the patients with trichinellosis at 19 dpi, and the results were compared with those of serum samples from patients with trichinellosis at 35 dpi and other parasitic diseases. The results of SDS-PAGE indicated thatT.spiralismuscle larval ES antigens had 19 protein bands with a molecular weight of 15-97 kDa, whereas the results of Western blot analysis showed that two protein bands (41.5 and 55 kDa) in the ES antigens were recognized by mouse infection sera at 7-11 dpi, and six protein bands (41.5, 44.1, 45, 55, 61 and 65.2 kDa) were recognized by serum samples from early and late patients with trichinellosis, and the positive reaction rate was 100% (15/15). The six proteins had no cross-reaction with serum samples of patients with sparganosis and healthy individuals, but they had obvious cross reaction with serum samples from the patients with other parasitic diseases (schistosomiasis, paragonimiasis, clonorchiasis, echinococcosis, and cysticercosis), with the cross reaction rate ranging from 19.12% to 38.23%. The results indicate the six protein bands with 41.5-65.2 kDa inT.spiralismuscle larval ES antigens are positively reacted with early infection sera, but they obvious have cross reaction with sera from the patients with other helminthinasis.
trichinellosis;Trichinellaspiralis; muscle larvae; excretory-secretory (ES) antigens; Western blot; early diagnosis Supported by the National Natural Science Foundation of China (No. 81672043) and the Science Project of Higher Education of Henan (No. 16A310017) Corresponding author: Cui Jing, Email: cuij@zzu.edu.cn
10.3969/j.issn.1002-2694.2016.012.004
国家自然科学基金项目(No. 81672043)和河南省高等学校科研项目(No.16A310017)联合资助
崔 晶,Email: cuij@zzu.edu.cn
郑州大学医学院寄生虫学教研室,郑州 450052
R383.15
A
1002-2694(2016)12-1058-06
2016-07-11;
2016-09-29
