慢性阻塞性肺疾病患者外周血Th17/CD25+Foxp3+Treg比率的变化
2016-02-09何燕超揭志军施劲东梅周芳黄琦慧鄢莉宏
何燕超, 揭志军, 施劲东, 梅周芳, 钱 凌, 黄琦慧, 鄢莉宏
复旦大学附属上海市第五人民医院呼吸内科,上海 200240
论 著
慢性阻塞性肺疾病患者外周血Th17/CD25+Foxp3+Treg比率的变化
何燕超, 揭志军, 施劲东, 梅周芳, 钱 凌, 黄琦慧, 鄢莉宏*
复旦大学附属上海市第五人民医院呼吸内科,上海 200240
目的:研究慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)患者外周血中CD25+Foxp3+Treg和Th17细胞介导的免疫失衡与该疾病进展之间的相关性。方法:选择2012年1月至2015年3月在上海市闵行区江川社区及复旦大学附属上海市第五人民医院接受门诊或住院治疗的稳定期和急性发作期COPD患者共69例,同时收集吸烟或不吸烟的健康对照者各20例。测定受试者的肺功能。采用流式细胞术测定受试者外周血中Th17和CD25+Foxp3+Treg占CD4+细胞的百分比,分析Th17/CD4+和CD25+Foxp3+Treg/CD4+比率以及Th17/CD25+Foxp3+Treg比值在不同分组中的变化及其临床意义。结果:与健康对照组相比,稳定期COPD患者外周血中Th17/CD4+和Th17/CD25+Foxp3+Treg明显升高(P<0.05),而CD25+Foxp3+Treg/CD4+明显降低(P<0.05);急性发作期COPD患者的Th17/CD4+、CD25+Foxp3+Treg/CD4+和Th17/CD25+Foxp3+Treg均比对照组明显升高(P<0.05)。轻度、中度、重度和极重度的COPD患者中Th17/CD4+和Th17/CD25+Foxp3+Treg逐步升高(P<0.05),而CD25+Foxp3+Treg/CD4+逐步降低(P<0.05);COPD患者的Th17/CD4+和Th17/CD25+Foxp3+Treg与肺功能负相关(P<0.05),CD25+Foxp3+Treg/CD4+与肺功能正相关(P<0.05)。结论:Th17/CD25+Foxp3+Treg失衡参与了COPD的疾病进展过程,提示Th17/CD25+Foxp3+Treg免疫调节治疗可能成为COPD治疗的新途径。
慢性阻塞性肺疾病;免疫调节;Th17细胞;T淋巴细胞
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续气流受限为特征的可以防治的呼吸系统疾病。近年来,COPD的发病率和病死率居高不下,成为备受关注的疾病之一[1]。越来越多的研究证明,CD4+T细胞在COPD相关的慢性炎性反应中发挥作用[2]。辅助性T 细胞17(T helper cell 17,Th17)是CD4+T细胞的一种亚型。在转化生长因子-β(transforming growth factor-β,TGF-β)和白细胞介素-6(interleukin-6,IL-6)的作用下, CD4+T细胞可以表达核孤儿受体家族成员RORγt并向Th17分化,随后分化成熟的Th17分泌细胞因子IL-17A,从而发挥生物学效应[3]。调节性T细胞(regulatory T cell,Treg)是CD4+T细胞的另一种亚型,它是一种重要的免疫调节细胞。Treg中异位表达的叉头翼状螺旋转录因子p3(forkhead or winged helix transcription p3,Foxp3)可以通过接触抑制、分泌抑制性因子IL-10和TGF-β,维持免疫环境的稳态[4]。Th17/Treg平衡是Th1/Th2经典模型的补充,Th17/Treg平衡在机体免疫应答和免疫耐受中具有重要作用[5]。因此,本研究通过检测各个阶段的COPD患者外周血中Th17/CD25+Foxp3+Treg的百分比,探讨COPD的免疫学发病机制,并试图寻找可以干预COPD进展的有效靶点。
1 资料与方法
1.1 一般资料 收集2012年1月至2015年3月在上海市闵行区江川社区及复旦大学附属上海市第五人民医院接受门诊或住院治疗的COPD患者69例。所有病例均符合中华医学会呼吸病学分会制定的诊断标准[1],且均不合并支气管哮喘、其他肺部疾病、心力衰竭及自身免疫性疾病。除19例急性发作期COPD(acute exacerbation of COPD,AECOPD)患者外,所有50例稳定期COPD(stable COPD,SCOPD)患者均完成肺功能检查,相关指标包括一秒用力呼气容积(forced expiratory volume in one second,FEV1)、用力肺活量(forced vital capacity,FVC)、FEV1占预计值的百分比(EFV1%pred)、FVC占预计值的百分比(FVC%pred)以及FEV1/FVC比率。根据COPD全球策略(Global Initiative for Chronic Obstructive Lung Disease,GOLD)的分级标准(依据肺功能评估气流受限程度),将SCOPD患者分为GOLD1级(轻度)11例、GOLD2级(中度)14例、GOLD3级(重度)11例和GOLD4级(极重度)14例。同时,收集在本院体检中心进行体检的非吸烟健康志愿者及肺功能正常的吸烟者各20例,作为对照组;所有对照均不合并其他疾病。本研究方案经上海市第五人民医院伦理委员会批准,所有研究对象均签署知情同意书。所有入组患者及对照的具体临床资料见表1。
1.2 主要试剂和设备 流式细胞术使用的所有抗体以及细胞刺激培养所需的豆蔻酰佛波醇乙酯(phorbol 12-myristate 13-acetate,PMA)、离子霉素、布雷菲德菌素A(Brefeldin A,BFA)和Fix&Perm Kit Reagent均购自美国BD公司;淋巴细胞分离液(Ficoll-Hypaque)购自美国Sigma公司;人Treg染色试剂盒购自美国eBioscience公司。流式细胞仪(FACScalibur)购自美国BD公司。
1.3 标本收集与处理 采集受试者外周血3 mL,置入肝素锂抗凝管内。将外周血用0.9%氯化钠溶液等倍稀释后,将其沿离心管边缘轻轻加至Ficoll-Hypaque分离液上面,室温500×g离心20 min,分离白膜层细胞即为外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。用RPMI 1640培养液洗涤细胞3~5次后,用含有10%胎牛血清的RPMI 1640培养液调整细胞密度为1×106个/mL,将细胞铺至24孔板中培养,用于流式细胞学检测。
1.4 流式细胞术检测Th17/CD4+细胞比率 将细胞密度为1×106个/mL的新鲜PBMC接种于24孔板,每孔100 μL,然后分别加入1 μg/mL离子霉素、50 ng/mL PMA和1 μg/mL BFA,于37℃和5% CO2条件下培养细胞6 h。分别加入PE标记的鼠抗人CD8单克隆抗体和FITC标记的鼠抗人CD3单克隆抗体,4℃避光反应30 min,用PBS缓冲液洗涤。用固定破膜试剂盒(Fix & Perm Kit)中的Reagent A固定,Reagent B破膜,然后加入APC标记的鼠抗人IL-17A单克隆抗体或同型IgG1标记的细胞内抗体,4℃避光反应30 min,用PBS缓冲液洗涤。最后用0.4 mL PBS重悬细胞,上流式细胞仪检测CD3+CD8-IL-17A+细胞(即Th17)占CD3+CD8-细胞(即CD4+T细胞)的百分比(简称Th17/CD4+比率);每次检测均设立同型对照。
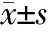
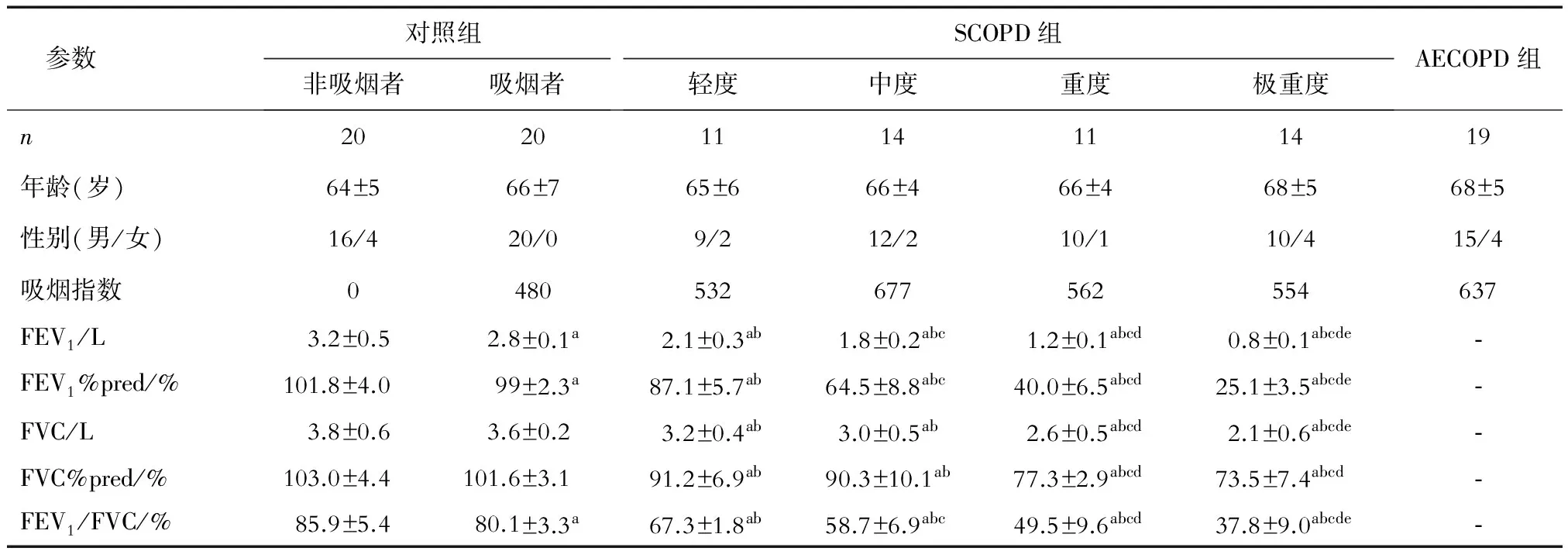
参数对照组非吸烟者吸烟者SCOPD组轻度中度重度极重度AECOPD组n20201114111419年龄(岁)64±566±765±666±466±468±568±5性别(男/女)16/420/09/212/210/110/415/4吸烟指数0480532677562554637FEV1/L3.2±0.52.8±0.1a2.1±0.3ab1.8±0.2abc1.2±0.1abcd0.8±0.1abcde⁃FEV1%pred/%101.8±4.099±2.3a87.1±5.7ab64.5±8.8abc40.0±6.5abcd25.1±3.5abcde⁃FVC/L3.8±0.63.6±0.23.2±0.4ab3.0±0.5ab2.6±0.5abcd2.1±0.6abcde⁃FVC%pred/%103.0±4.4101.6±3.191.2±6.9ab90.3±10.1ab77.3±2.9abcd73.5±7.4abcd⁃FEV1/FVC/%85.9±5.480.1±3.3a67.3±1.8ab58.7±6.9abc49.5±9.6abcd37.8±9.0abcde⁃
aP<0.05与非吸烟者比较;bP<0.05与吸烟者比较;cP<0.05与轻度COPD组比较;dP<0.05与中度COPD组比较;eP<0.05与重度COPD组比较。吸烟指数=每天吸烟支数×吸烟年数,所有COPD组中戒烟者的吸烟指数为戒烟前的吸烟指数;FEV1:1秒用力呼气容积;FVC:用力肺活量;FEV1%pred:1秒用力呼气容积占预计值的百分比;FVC%pred:用力肺活量占预计值的百分比
1.5 流式细胞术检测CD25+Foxp3+Treg/CD4+细胞比率 将细胞密度为1×106个/mL的新鲜PBMC接种于24孔板,每孔100 μL,然后加入PE标记的鼠抗人CD25单克隆抗体和FITC标记的鼠抗人CD4单克隆抗体,4℃避光反应30 min,用PBS缓冲液洗涤。用Treg染色试剂进行破膜、固定,PBS洗涤、离心后,加入APC标记的鼠抗人Foxp3单克隆抗体及同型IgG1标记细胞内抗体,4℃避光30 min,用PBS缓冲液洗涤。最后用0.4 mL含1%多聚甲醛溶液的PBS重悬细胞,上流式细胞仪检测CD25+Foxp3+Treg占CD4+T细胞的百分比(简称CD25+Foxp3+Treg/CD4+比率);每次检测设立同型对照。
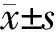
2 结 果
2.1 受试者临床资料分析 本实验共纳入受试者109例,其中对照组40例,SCOPD患者50例,AECOPD患者19例。在对照组中,吸烟者的FEV1、FEV1%pred和FEV1/FVC比率均低于非吸烟者,这说明吸烟可能引起肺功能下降。SCOPD组的FEV1、FEV1%pred和FEV1/FVC比率均低于对照组,并随着COPD分级增加,肺功能逐步降低(表1)。
2.2 COPD患者外周血中Th17/CD25+Foxp3+Treg失衡 为了探索Th17/CD25+Foxp3+Treg平衡在COPD发生及进展中的作用,本研究采用流式细胞术分析了对照组、SCOPD组和AECOPD组患者的外周血Th17和CD25+Foxp3+Treg占CD4+T细胞的百分率变化。结果(图1、表2)显示:与对照组相比,SCOPD组的CD25+Foxp3+Treg/CD4+比率明显降低(P<0.05),AECOPD组的CD25+Foxp3+Treg/CD4+比率明显升高(P<0.05),而SCOPD和AECOPD组的Th17/CD4+比率和Th17/CD25+Foxp3+Treg比值均明显升高(P<0.05)。

图1 各组受试者的CD25+Foxp3+Treg和Th17细胞流式检测结果A: CD25+Foxp3+Treg/CD4+; B: Th17/CD4+
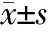

细胞对照组(n=40)SCOPD组(n=50)AECOPD组(n=19)Th17/%#0.95±0.272.3±1.07a3.48±0.75aCD25+Foxp3+Treg/%#4.11±0.792.62±1.11a5.25±1.37aTh17/CD25+Foxp3+Treg0.24±0.081.22±0.96a0.73±0.33a
#指Th17和CD25+Foxp3+Treg占CD4+T细胞的百分比.aP<0.05与对照组比较
2.3 Th17/CD25+Foxp3+Treg失衡与SCOPD患者肺功能的关系 为了探讨Th17/CD25+Foxp3+Treg与肺功能的关系,本研究将对照组分为非吸烟组和吸烟组,将SCOPD组按肺功能分为轻度、中度、重度和极重度组。分析发现,Th17/CD4+比率和Th17/CD25+Foxp3+Treg比值在吸烟组高于非吸烟组(P<0.05),在SCOPD各组均高于非吸烟组(P<0.05),并且随着肺功能分级进展,Th17/CD4+比率和Th17/CD25+Foxp3+Treg比值均逐步升高(P<0.05)。CD25+Foxp3+Treg/CD4+比率在吸烟组高于非吸烟组(P<0.05),轻度组与非吸烟组差异无统计学意义,而中度组CD25+Foxp3+Treg/CD4+比率低于轻度组和非吸烟组(P<0.05),并且重度组和极重度组的CD25+Foxp3+Treg/CD4+比率低于中度组(P<0.05,表3)。
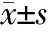
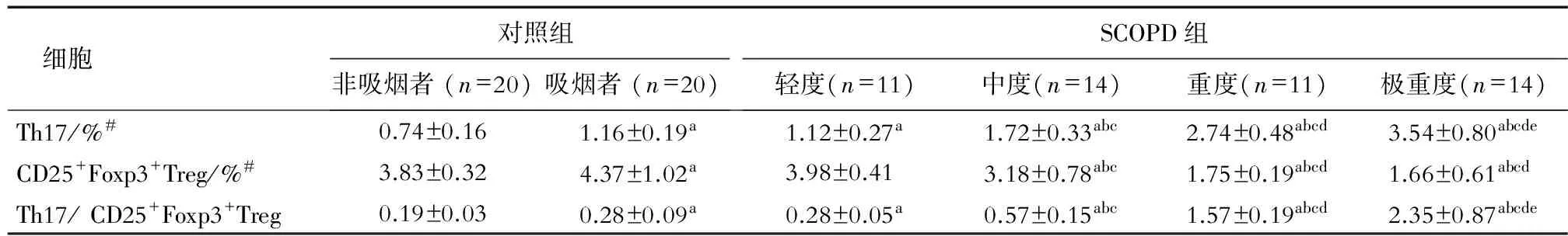
细胞对照组非吸烟者(n=20)吸烟者(n=20)SCOPD组轻度(n=11)中度(n=14)重度(n=11)极重度(n=14)Th17/%#0.74±0.161.16±0.19a1.12±0.27a1.72±0.33abc2.74±0.48abcd3.54±0.80abcdeCD25+Foxp3+Treg/%#3.83±0.324.37±1.02a3.98±0.413.18±0.78abc1.75±0.19abcd1.66±0.61abcdTh17/CD25+Foxp3+Treg0.19±0.030.28±0.09a0.28±0.05a0.57±0.15abc1.57±0.19abcd2.35±0.87abcde
#指Th17和CD25+Foxp3+Treg占CD4+T细胞的百分比.aP<0.05与非吸烟者比较;bP<0.05与吸烟者比较;cP<0.05与轻度COPD组比较;dP<0.05与中度COPD组比较;eP<0.05与重度COPD组比较
2.4 Th17、CD25+Foxp3+Treg、Th17/CD25+Foxp3+Treg与肺功能的相关性分析 本研究进一步分析SCOPD患者外周血Th17/CD4+、CD25+Foxp3+Treg/CD4+比率、Th17/CD25+Foxp3+Treg比值与肺功能下降程度的相关性。结果发现,Th17/CD4+比率与FEV1%pred、FVC%pred和FEV1/FVC比率均负相关(P<0.05);CD25+Foxp3+Treg/CD4+比率与FEV1%pred、FVC%pred和FEV1/FVC比率均正相关(P<0.05) ;Th17/CD25+Foxp3+Treg比值与FEV1%pred、FVC%pred、FEV1/FVC比率也均负相关(P<0.05) 。这些数据说明,COPD患者体内Th17/CD25+Foxp3+Treg失衡与肺功能下降有高度的相关性(表4)。
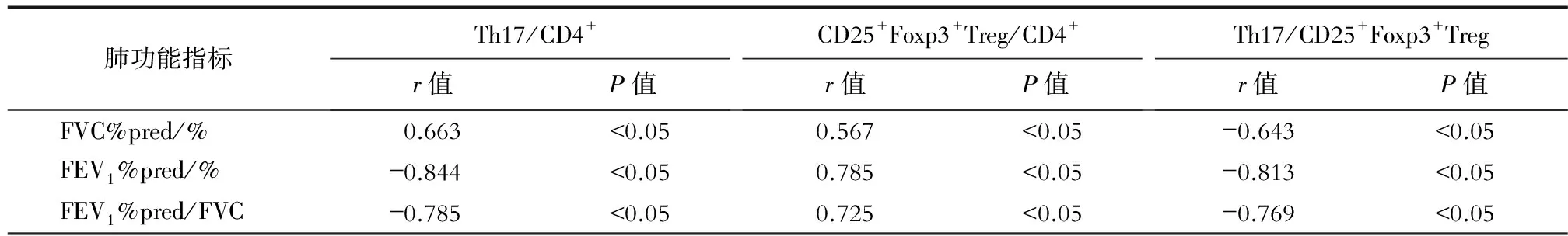
表4 外周血Th17和CD25+Foxp3+Treg与肺功能的相关性分析
3 讨 论
COPD与气管和肺组织对香烟烟雾等有害颗粒的异常慢性炎性反应有关[6-7]。这些有害颗粒不仅会引起上皮细胞损伤,激活固有免疫,而且会使机体自身的抗原性发生改变,进而激活特异性免疫。近期有很多研究显示,香烟烟雾的刺激会激活T细胞免疫[8-9]。Treg对T细胞亚群的分化具有重要的调节作用,Treg表达Foxp3后对Th17有明显的负向调节作用[4]。因此,研究Th17/Treg平衡在不同阶段、不同程度COPD患者体内的变化具有重要的临床意义。已有一些研究[10]发现,Th17/CD25+Treg平衡在SCOPD患者中有变化,但没有研究Foxp3+Treg在COPD患者体内的变化。COPD患者的主要临床表现为气流受限呈进行性进展,肺功能的变化是COPD进展的重要指标。因此,本研究选取了健康对照人群、SCOPD患者及AECOPD患者作为研究对象,检测各组外周血中Th17和CD25+Foxp3+Treg占CD4+T细胞百分比的变化,分析Th17、CD25+Foxp3+Treg与肺功能的相关性,并从免疫学角度探索Th17/CD25+Foxp3+Treg失衡在COPD发生及进展中的病理生理学机制。
本研究分析Th17、CD25+Foxp3+Treg在对照组、SCOPD组和AECOPD组的表达情况,结果发现SCOPD组的Th17/CD4+比率高于对照组,而CD25+Foxp3+Treg/CD4+比率低于对照组;AECOPD组的Th17/CD4+和CD25+Foxp3+Treg/CD4+比率均高于对照组。遂进一步分析Th17/CD25+Foxp3+Treg比值,发现SCOPD组和AECOPD组均高于对照组。这说明COPD患者体内处于Th17优势状态,AECOPD患者的CD25+Foxp3+Treg/CD4+比率升高可能是由于COPD急性发作的情况下存在其他促CD25+Foxp3+Treg分化的因素(如感染等)。
为了进一步探索Th17/CD25+Foxp3+Treg在COPD中的作用,本研究将对照组分为非吸烟组和吸烟组,将不同严重程度的SCOPD患者按肺功能分级分为4组。分析发现,吸烟者的Th17/CD4+、CD25+Foxp3+Treg/CD4+和Th17/CD25+Foxp3+Treg均高于非吸烟者;并且,随着COPD严重程度的进展,Th17/CD4+和Th17/ CD25+Foxp3+Treg在SCOPD组逐步升高;从中度COPD开始,CD25+Foxp3+Treg/CD4+比率明显下降,并随着疾病进展逐步降低。表1数据显示,吸烟者的FEV1%pred、FEV%pred和FEV1/FVC均低于非吸烟者;结果提示在COPD前期(FEV1%pred开始下降时)已经开始出现Th17/CD25+Foxp3+Treg失衡,并且随着肺功能下降,Th17/CD25+Foxp3+Treg失衡逐步加重。Wang等[8]通过香烟烟雾刺激建立小鼠COPD模型,检测不同肺功能阶段小鼠Th17/CD4+和CD25+Foxp3+Treg/CD4+的变化,结果发现:短期香烟刺激的小鼠PBMC和肺部CD25+Foxp3+Treg、Th17均比对照组明显增加,但是Th17/CD25+Foxp3+Treg无明显变化;长期刺激的小鼠PBMC和肺部CD25+Foxp3+Treg比对照组明显减少,Th17/CD25+Foxp3+Treg比对照组明显升高。本研究结果与之类似。
从本研究临床试验和Wang等[8]的动物实验结果可见,CD25+Foxp3+Treg的变化不同于Th17呈现一个稳步同方向的变化,而在吸烟组CD25+Foxp3+Treg所占比例相对于肺功能正常的非吸烟者出现了升高,呈现出一个波动的变化;这表明CD25+Foxp3+Treg可能在Th17/Treg平衡中起到单独调节作用。已有研究证明,Treg细胞是体内重要的调节细胞,它可以通过接触抑制和分泌IL-10而抑制Th17的分化及功能[10-12]。而Th17是一种促炎性反应细胞,它可分泌IL-6和IL-21等因子,激活STAT-3通路,抑制Foxp3的表达,进而抑制Treg分化[13-15]。因此,CD25+Foxp3+Treg/CD4+比率在吸烟组出现升高,可能是由于CD25+Foxp3+Treg对Th17分化的抑制作用。COPD前期可能通过CD25+Foxp3+Treg/CD4+比率升高而抑制Th17分化,从而保护内环境稳态;但是随着COPD进展,继续升高的Th17反过来抑制CD25+Foxp3+Treg的调节作用,使内环境失衡;到COPD晚期,Th17/CD25+Foxp3+Treg完全失衡,Th17占绝对优势。
本研究中,COPD患者的Th17/CD4+、CD25+Foxp3+Treg/CD4+和Th17/CD25+Foxp3+Treg随着肺功能分级逐步变化,因此进一步分析COPD患者Th17、CD25+Foxp3+Treg和Th17/CD25+Foxp3+Treg与肺功能的相关性。结果显示,Th17/CD4+和Th17/CD25+Foxp3+Treg均与FEV1%pred、FVC%pred及FEV1/FVC负相关,而CD25+Foxp3+Treg/CD4+与FEV1%FVC%pred及FEV1/FVC正相关。以上结果进一步说明,COPD患者体内Th17/CD25+Foxp3+Treg失衡的过程与肺功能的下降程度高度相关。
综上所述,Th17/CD25+Foxp3+Treg失衡参与了COPD患者疾病进展的过程,与肺功能下降高度相关,CD25+Foxp3+Treg对Th17/Treg平衡起到了重要的调节作用。本研究结果从免疫学角度为揭示COPD的病理生理机制提供了新的视角。同时,本研究也为Th17/CD25+Foxp3+Treg应用于临床评估COPD的严重程度,指导COPD的治疗方案提供了一定的理论依据。然而,本研究尚存在性别比率不均衡和样本量小等不足,因此检测Th17/CD25+Foxp3+Treg是否可以应用于评估COPD预后、指导COPD治疗,还有待更完善的大样本研究来明确。
[1] 黄俊芳, 王广发.慢性阻塞性肺病全球倡议慢性阻塞性肺病指南(2013更新版)解读[J].中国医学前沿杂志(电子版), 2013, 5(3):58-60.
[2] FREEMAN C M, MCCUBBREY A L, CRUDGINGTON S, et al.Basal gene expression by lung CD4+T cells in chronic obstructive pulmonary disease identifies independent molecular correlates of airflow obstruction and emphysema extent[J].PLoS One, 2014, 9(5):e96421.
[3] BEDOYA S K, LAM B, LAU K, et al.Th17 cells in immunity and autoimmunity[J].Clin Dev Immunol, 2013, 2013:986789.
[4] OHKURA N, KITAGAWA Y, SAKAGUCHI S.Development and maintenance of regulatory T cells[J].Immunity, 2013, 38(3):414-423.
[5] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007年修订版)[J].中华结核和呼吸杂志, 2007, 46(1):254-261.
[6] HERNANDEZ C P, MORROW K, VELASCO C, et al.Effects of cigarette smoke extract on primary activated T cells[J].Cell Immunol, 2013, 282(1):38-43.
[7] ALMANZAR G, EBERLE G, LASSACHER A, et al.Maternal cigarette smoking and its effect on neonatal lymphocyte subpopulations and replication[J].BMC Pediatr, 2013, 13:57.
[8] WANG H, PENG W, WENG Y, et al.Imbalance of Th17/Treg cells in mice with chronic cigarette smoke exposure[J].Int Immunopharmacol, 2012, 14(4):504-512.
[9] NADIGEL J, PRÉFONTAINE D, BAGLOLE C J, et al.Cigarette smoke increases TLR4 and TLR9 expression and induces cytokine production from CD8+T cells in chronic obstructive pulmonary disease[J].Respir Res, 2011, 12:149.
[10] O′SULLIVAN D, PEARCE E L.Fatty acid synthesis tips the TH17-Treg cell balance[J].Nat Med, 2014, 20(11):1235-1236.
[11] VANDER GEEST K S, ABDULAHAD W H, TETE S M, et al.Aging disturbs the balance between effector and regulatory CD4+T cells[J].Exp Gerontol, 2014, 60:190-196.
[12] GUO M M, TSENG W N, KO C H, et al.Th17- and Treg-related cytokine and mRNA expression are associated with acute and resolving Kawasaki disease[J].Allergy, 2015, 70(3):310-318.
[13] ZHOU L, IVANOV I I, SPOLSKI R, et al.IL-6 programs TH-17 cell differentiation by promoting sequential engagement of the IL-21 and IL-23 pathways[J].Nat Immunol, 2007, 8(9):967-974.
[14] YANG X O, PANOPOULOS A D, NURIEVA R, et al.STAT3 regulates cytokine-mediated generation of inflammatory helper T cells[J].J Biol Chem, 2007, 282(13):9358-9363.
[15] KORN T, BETTELLI E, GAO W, et al.IL-21 initiates an alternative pathway to induce proinflammatory TH17 cells[J].Nature, 2007, 448(7152):484-487.
[本文编辑] 叶 婷, 张艺鸣
Change of Th17/CD25+Foxp3+Treg ratio in peripheral blood of patients with chronic obstructive pulmonary disease and its significance
HE Yan-chao, JIE Zhi-jun, SHI Jin-dong, MEI Zhou-fang, QIAN Ling, HUANG Qi-hui, YAN Li-hong*
Department of Respiratory Medicine, Shanghai Fifth People’s Hospital, Fudan University, Shanghai 200240, China
Objective:To investigate the correlationship between peripheral CD25+Foxp3+Treg and Th17 cell-mediated immune imbalance and the progression of chronic obstructive pulmonary disease (COPD).Methods:A total of sixty-nine patients with COPD in stable stage or acute exacerbation of COPD were recruited from Shanghai Fifth People’s Hospital of Fudan University from January 2012 to March 2015.At the same time, the non-smokers and smokers with normal lung function, each 20 cases, were also used as the healthy controls.The pulmonary function of all subjects was evaluated.The percentages of Th17 and CD25+Foxp3+Treg cells in CD4+cells from peripheral blood were determined by flow cytometry.The changes of Th17/CD4+, CD25+Foxp3+Treg/CD4+and Th17/CD25+Foxp3+Treg ratios in the different groups and their clinical significance were analyzed.Results:Compared with the healthy control group, the ratios of Th17/CD4+and Th17/CD25+Foxp3+Treg in peripheral blood of patients with stable COPD were significantly increased (P<0.05), while the ratio of CD25+Foxp3+Treg/CD4+was significantly decreased (P<0.05).The ratios of Th17/CD4+, CD25+Foxp3+Treg/CD4+and Th17/CD25+Foxp3+Treg in patients with acute exacerbation of COPD were all increased as compared with the healthy control (allP<0.05).With the decline of lung function, the ratios of Th17/CD4+and Th17/CD25+Foxp3+Treg were gradually up-regulated in patients with mild, moderate, severe, very severe COPD (P<0.05), while the ratio of CD25+Foxp3+Treg/CD4+was gradually down-regulated (P<0.05).Moreover, the ratios of Th17/CD4+and Th17/CD25+Foxp3+Treg in COPD patients were negatively correlated with lung function (P<0.05), while the ratio of CD25+Foxp3+Treg/CD4+was positively correlated with lung function (P<0.05).Conclusions:Th17/CD25+Foxp3+Treg imbalance involves in the progression of COPD, suggesting that Th17/CD25+Foxp3+Treg immunomodulatory therapy may become a new approach for the treatment of COPD.
chronic obstructive pulmonary disease; immunomodulation; Th17 cells; T-lymphocytes
2016-07-01[接受日期]2016-11-29
上海市闵行区自然科学基金(2011MHZ03),上海市科学技术委员会自然基金生物引导类项目(134119b1200),上海市卫生系统优秀学科带头人资助项目(13B034),复旦大学青年骨干科研启动基金(11L-34).Supported by Natural Science Foundation of Minhang District in Shanghai (2011MHZ03), Natural Foundation-Biological Guide Project of Shanghai Municipal Science and Technology Commission (134119b1200), Excellent Academic Leaders of Shanghai Health System (13B034) and Foundation of Start-Up Research by Youth Cadre of Fudan University (11L-34).
何燕超,硕士,住院医师.E-mail: 360699058@qq.com
*通信作者(Corresponding author).Tel: 021-52880000, E-mail: yanlihong1973@aliyun.com
10.12025/j.issn.1008-6358.2016.20160709
R 563.9
A
