两种新萃取技术与光度法联用测盐酸洛美沙星
2016-02-08雷自荣杨盛春温晓东
雷自荣,杨 舒,杨盛春,温晓东
(大理大学药学与化学学院,云南大理 671000)
两种新萃取技术与光度法联用测盐酸洛美沙星
雷自荣,杨 舒,杨盛春,温晓东*
(大理大学药学与化学学院,云南大理 671000)
目的:将表面活性剂辅助-分散液液微萃取(SA-DLLME)和超声辅助-分散液液微萃取(UA-DLLME)与紫外-可见分光光度法(UV-vis)联用对盐酸洛美沙星(LMFH)进行预富集和测定,比较两种方法的分析性能。方法:优化实验条件,对比两种新方法与光度法联用测定该药物的分析性能。结果:在最优条件下SA-DLLME和UA-DLLME测定LMFH的检出限(LOD)分别为4.0 μg∕L和6.0 μg∕L,富集倍数达31倍和20倍。结论:SA-DLLME表现优于UA-DLLME,两种方法都显著提高了普通分光光度法分析测定该药物的灵敏度,拓展了分光光度法的应用范围。为验证所建立方法的准确性和实用性,进行了样品测定,结果准确。
表面活性剂辅助-分散液液微萃取;超声辅助-分散液液微萃取;预富集;分光光度法;盐酸洛美沙星
盐酸洛美沙星(LMFH)为喹诺酮类广谱抗菌药,对革兰氏阴性菌、革兰氏阳性菌及部分厌氧菌都有着强力的杀菌作用,主要用于呼吸道,泌尿生殖系统,以及皮肤软组织等感染的治疗,对盐酸洛美沙星进行分析测定具有实际意义及使用价值〔1〕。目前有多种测定盐酸洛美沙星的仪器分析方法,包括荧光分光光度法〔2〕、紫外光度法〔3〕、原子吸收(AAS)法〔4〕、液相色谱(HPLC)法〔5〕等。本实验中采用的两种新型液相微萃取预富集技术:表面活性剂辅助-分散液液微萃取(SA-DLLME)和超声辅助-分散液液微萃取(UA-DLLME)与紫外-可见分光光度法(UV-vis)联用对盐酸洛美沙星进行预富集和测定的新方法未见报道。
液相微萃取技术(liquid phase microextraction,LPME)是一种早在1996年由LIU等〔6〕及JEANNOT等〔7〕几乎在同一时间提出的微型样品前处理技术,如今该类技术得到了不断革新且应用前景越来越广阔。分散液液微萃取技术(dispersive liquid liquid microextraction,DLLME)是其中之一,最初是由伊朗科学技术大学Assadi科研小组于2006年提出〔8〕。该技术具有操作简单、成本低、富集倍数高、环境友好等优点。超声辅助-分散液液微萃取法(UADLLME)是在分散液液微萃取法(DLLME)基础上辅以超声技术取代传统有机分散剂,利用超声波在超声过程中产生的热效应、空化效应、强化扩散、乳化作用、机械搅拌等一系列效应,来加快萃取过程中的传质作用,从而提高萃取效率〔9〕。表面活性剂辅助-分散液液微萃取(SA-DLLME)则是利用表面活性剂取代了传统DLLME中的有机分散剂的一种更为新型和环境友好萃取技术〔10〕。SA-DLLME和UA-DLLME这两种技术是最近几年才发展起来的,仅有相对较少的文献报道过此类研究工作〔11-13〕,查阅文献可知,目前还没有将这两种技术应用于药物分析的研究报道。
本实验是首次将SA-DLLME和UA-DLLME两种新型萃取技术与紫外-可见分光光度法联用,实现了对药物盐酸洛美沙星的含量分析,具有一定的创新性和研究意义。传统分光光度法仪器简单,成本低,应用广泛,但灵敏度较低。通过将其与先进的表面活性剂辅助-分散液液微萃取技术联用,可以极大的提高仪器的分析性能,扩展了该仪器的应用范围,对于经济和科研水平相对落后地区有较大的实用价值。相对药物分析中广泛使用的HPLC法,经过富集后的光度法测定该药物的分析性能已具有一定的可比性,而分析成本大大降低,分析速度得到加快。在本研究工作中对吸收曲线及SA-DLLME和UA-DLLME各项实验条件进行了详细考察,获得了极好的分析性能,并对实际样品进行了分析测定。具体实验内容报告如下。
1 实验部分
1.1仪器TU-1901型紫外-可见分光光度计(北京普析通用仪器有限责任公司);SB5200DT型超声波清洗仪(宁波新芝生物科技股份有限公司);pHS-25型酸度计(上海虹益仪器仪表有限公司);TDL-5-A型离心机(上海安亭科学仪器厂);AL204型电子天平(上海梅特勒-托利多仪器有限公司);DZG-303A型纯水制备仪(成都唐氏康宁科技发展有限公司)。
1.2试剂盐酸洛美沙星(LMFH)标准储备溶液的配制:准确称取盐酸洛美沙星对照品(上海仁虎制药)0.050 0 g于烧杯中,加少量的0.01 mol∕L醋酸(四川西陇化工有限公司)溶解后,用0.01 mol∕L的醋酸定容至100 mL的量瓶中,配制成500 μg∕mL盐酸洛美沙星(LMFH)标准储备溶液,实验中使用时由该标准储备液逐级稀释。
溴甲酚绿(BMG)溶液的配制:准确称取0.100 g溴甲酚绿(天津市风船化学试剂有限公司)溶于10 mL 0.1 mol∕L的NaOH(天津市协和昊鹏色谱科技有限公司)溶液中,用二次蒸馏水定容至100 mL的量瓶中,配制成1 000 μg∕mL的溴甲酚绿(BMG)溶液。
其他试剂(四氢呋喃、无水乙醇、甲醇、丙酮、乙酸乙酯、正辛醇、三氯甲烷、四氯化碳、糊精、乳糖、硬脂酸镁、淀粉等)均为分析纯(国药集团化学试剂有限公司)。实验用水为纯水。
1.3表面活性剂和超声辅助-分散液液微萃取操作方法SA-DLLME以正辛醇为萃取剂,用表面活性剂Triton X-114代替了DLLME中传统的有机分散剂。具体的实验操作程序如下:准确移取3.00 mL LMFH标准工作液(10 μg∕mL)置于40 mL具塞离心管中,然后加入0.40 mL 1 000 μg∕mL BMG,充分摇荡后加入3.00 mL 0.001 mol∕L醋酸(调节pH=5)和0.037 5%(v/v)TritonX-114,加入5.00 mL正辛醇,用蒸馏水定容至40 mL,充分振摇1 min。充分摇匀后,以3 000 r∕min的转速离心5 min。待水相和有机相完全分离后,用注射器小心抽取上层有机相转移至1 cm比色皿,于波长431 nm处,以试剂空白为参比测定吸光度。
UA-DLLME以正辛醇为萃取剂,用超声处理代替了DLLME中传统的分散剂,实现了更为高效和绿色的萃取过程。具体的实验操作程序如下:准确移取3.00 mL LMFH标准工作液(10 μg∕mL)置于40 mL具塞离心管中,然后加入0.40 mL 1 000 μg∕mL BMG,充分摇荡后加入3.00 mL 0.001 mol∕L醋酸(调节pH=5.0),充分摇荡后,加入4.00 mL正辛醇,用二次蒸馏水定容至40 mL,充分摇匀后,超声振荡5 min,以3 000 r∕min的转速离心5 min。待水相和有机相完全分离后,用注射器小心抽取上层有机相转移至1 cm比色皿,于波长431 nm处,以试剂空白为参比测定吸光度。
1.4样品采集与制备为了验证所建立方法的准确性以及实用性,对盐酸洛美沙星胶囊(南京白敬宇制药有限责任公司)和片剂(武汉东信医药科技有限责任公司)进行了分析测定。测定前将盐酸洛美沙星胶囊和片剂制备为溶液进行测定,分别取该药物胶囊和片剂各10粒,称重后用研钵分别研成粉末,分别取该样品粉末0.100 g,各用10 mL 0.1 mol∕L的醋酸溶解后,用水定容到100 mL,过滤后取滤液1.00 mL,用纯水定容至100 mL,所得的试样溶液浓度约10 μg∕mL。
2 结果与讨论
2.1吸收曲线本工作以分光光度法为测定方法,因此首先要确定萃取后样品的最大吸收波长,即要对富集后样品的吸收曲线进行考察。在未确定最佳实验条件前,根据下述萃取步骤及条件开展预实验,进行吸收曲线的考察,以确定最佳工作波长。
UA-DLLME富集后分光光度法测定的吸收曲线:准确移取8.00 mL 10 μg∕mL LFMH标准工作液,置于40 mL具塞离心试管中,然后加入0.40 mL 1 000 μg∕mL的BMG,3.00 mL 0.001 mol∕L的醋酸溶液(调节pH=5.0),充分摇荡后,加入2.00 mL正辛醇,用二次蒸馏水定容至40 mL,充分摇匀后,超声振荡5 min,以3 000 r∕min的转速离心5 min,待水相和有机相完全分离后,用胶头滴管吸取上层有机相,用无水乙醇复溶,用1 cm比色皿以试剂空白为参比,在波长为380~500 nm之间,测得吸收光谱图,其最大吸收峰位于431 nm,因此在λ=431 nm处开展UA-DLLME的实验工作。见图1。
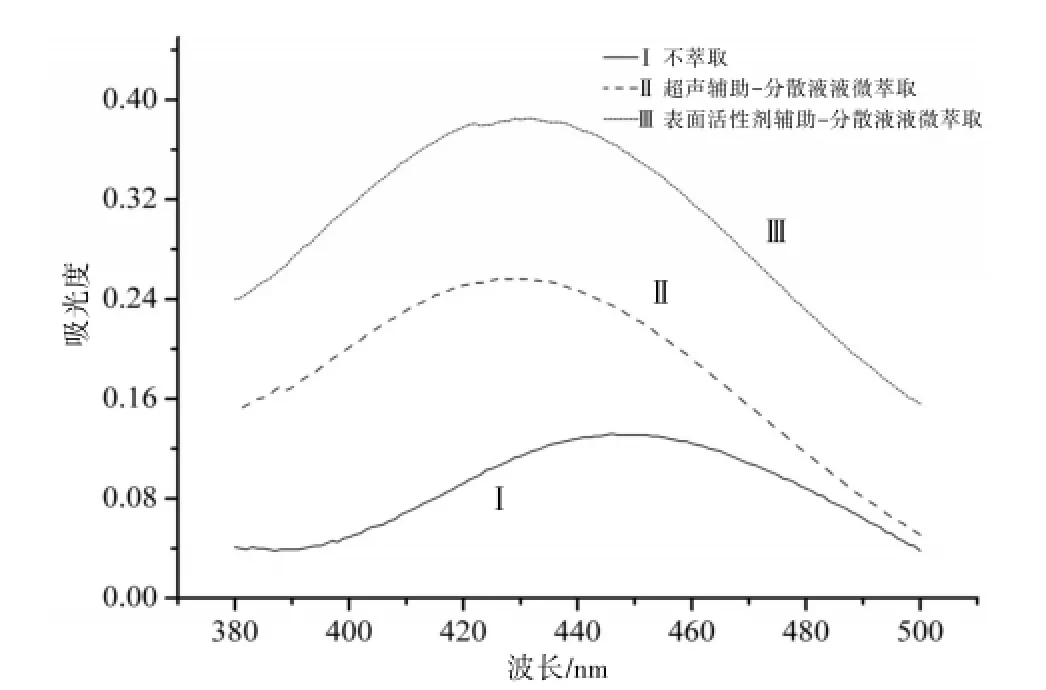
图1 吸收曲线
SA-DLLME富集后分光光度法测定的吸收曲线:准确移取6.00 mL 10 μg∕mL的LFMH标准工作液,置于40mL具塞离心管中,然后加入0.40 mL 1 000 μg∕mL的BMG,3.00 mL 0.001 mol∕L醋酸(调节pH= 5),充分摇荡后,加入0.05%(v/v)TritonX-114溶液和2.00 mL正辛醇,充分振荡1 min,用二次蒸馏水定容至40 mL。手动摇匀后以3 000 r∕min的转速离心5 min,待水相和有机相完全分离后,用胶头滴管吸取上层有机相,用无水乙醇复溶,用1 cm比色皿以试剂空白为参比,在波长为380~500 nm之间,测得吸收光谱,其最大吸收峰位于431 nm,因此在λ=431 nm处开展SA-DLLME的实验工作。同时考察了未经萃取处理直接显色后测定的吸收曲线。见图1。从图中可以看出,在未对UA-DLLME及SA-DLLME萃取条件进行优化的条件下富集效果仍然非常明显。同时发现,经过萃取和复溶后测定的最大吸收波长发生蓝移,可能是由于萃取剂等的加入使络合物的光谱性质发生了改变。
2.2SA-DLLME与UA-DLLME实验条件优化在确定仪器分析的最大吸收波长后,详细考察了影响SA-DLLME和UA-DLLME萃取效率的各实验条件以获取最佳的分析性能,包括萃取剂的种类与用量、络合剂浓度、SA-DLLME表面活性剂用量、UADLLME超声萃取时间、pH等条件。
2.2.1 SA-DLLME和UA-DLLME萃取剂种类及用量优化 在液相萃取技术中,选择合适的萃取剂是确保实验成功并提高分析灵敏度的关键。在选择萃取剂时要求对待测物的溶解能力要大,以保证取得良好的萃取效率。本实验对正辛醇、三氯甲烷、四氯化碳、四氢呋喃等4种萃取剂的萃取分析性能进行了考察以确定萃取剂的种类。实验表明,正辛醇对目标分析物的萃取效果最佳,经优化选择正辛醇作为萃取剂开展实验工作。
萃取过程中所加萃取剂的体积直接影响该方法的富集效率和富集倍数。在SA-DLLME和UADLLME中,分别考察了萃取剂正辛醇的体积为1.00、2.00、3.00、4.00、5.00、6.00 mL的富集效果,随着正辛醇的体积增加,吸光度逐渐增大,当加入的正辛醇体积超过某体积时吸光度略微减小。结果表明对于SA-DLLME,正辛醇体积在5.00 mL时萃取效果最好,对于UA-DLLME则选择4.00 mL的正辛醇萃取效果最佳。见图2。
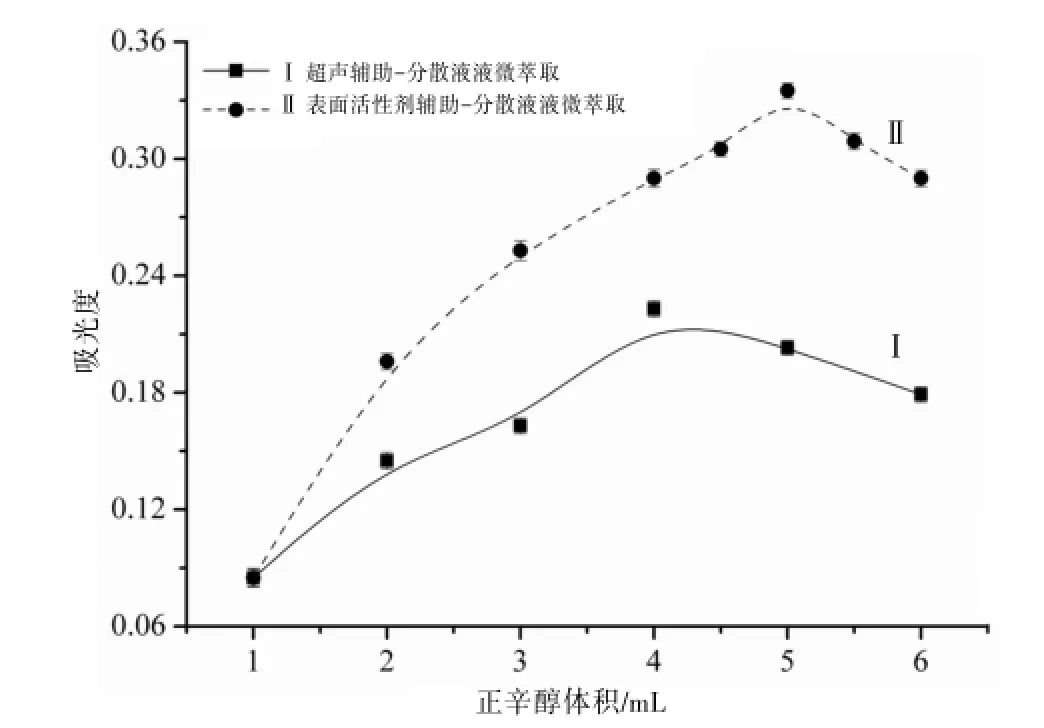
图2 萃取剂用量的优化
2.2.2 BMG的浓度优化 本实验选用溴甲酚绿作为盐酸洛美沙星的络合剂(兼显色剂)。溴甲酚绿简称BMG,可以与盐酸洛美沙星结合形成疏水性络合物而被萃取剂萃取富集,同时也起到光度法中显色剂的作用。络合剂(显色剂)的用量也是影响方法富集效率的重要条件之一,本实验对BMG浓度在1.25~15.00 μg∕mL的范围内进行优化。对于两种方法,随着BMG的浓度增大,萃取效率提高,吸光度逐渐增大,当加入的BMG的浓度超过10 μg∕mL时,过量的络合剂由于本身会被萃取剂萃取而干扰和影响了目标分析物的萃取效率,从而导致吸光度减小。因此溴甲酚绿浓度以10 μg∕mL为最佳,选择此条件展开实验工作。见图3。

图3 溴甲酚绿浓度的优化
2.2.3 SA-DLLME表面活性剂TritonX-114浓度优化在SA-DLLME技术中,表面活性剂取代了传统的有机分散剂起到乳化和分散萃取剂以提高萃取效率的作用。本实验中选用TritonX-114取代有机分散剂,分别考察了含量为0.000 0%、0.025 0%、0.037 5%、0.062 5%、0.100 0%、0.125 0%(v/v)TritonX-114溶液的萃取效率。实验表明,在一定用量范围内(0.000 0%~0.037 5%,v/v)吸光度随着TritonX-114用量的增加呈现显著增大的趋势,但当TritonX-114过量时,吸光度开始下降。当TritonX-114用量为0.000 0%,即未加入表面活性剂时,吸光度非常低,充分验证和说明了表面活性剂在本方法中所起到的重要辅助作用。经过优化,在SA-DLLME中选用0.037 5%(v/v)TritonX-114萃取效果最佳,因此选择此条件开展下面的实验工作。见图4。
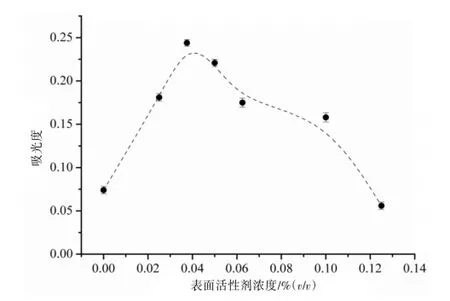
图4 表面活性剂浓度的优化
2.2.4UA-DLLME超声萃取条件优化 在UA-DLLME中,超声利用的是超声波在超声过程中产生的有关效应来提高萃取效率。超声技术的使用,代替了传统DLLME技术中的有机分散剂,不但使萃取效率得到了提高,并且降低了有机溶剂的使用。在该实验中对超声时间进行了优化,分别考察了超声时间0.5、1、2、4、5、6、8、10 min的萃取效率,实验结果显示超声5 min的效果最佳。见图5。
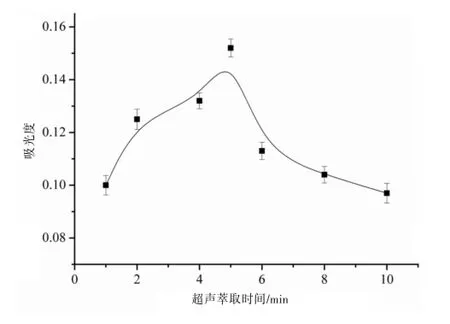
图5 超声萃取时间的优化
2.2.5 pH值的影响 SA-DLLME和UA-DLLME萃取LMFH的时候,首先需要LMFH与络合剂BMG形成疏水性的络合物。而络合物的形成受溶液体系的酸度条件的影响很大,从而影响萃取效率。在实验中通过调整萃取体系溶液的pH值,可以提高目标分析物与络合剂的络合效果,从而提高萃取效率。为了找到本实验的最佳酸度条件,在优化实验中考察了pH值在3.0~7.0范围内变化时的萃取效果。对于两种萃取方法都是当pH=5.0时吸光度值最好,萃取效率达到最大,因此选择pH=5.0为萃取实验的最佳酸度条件。见图6。
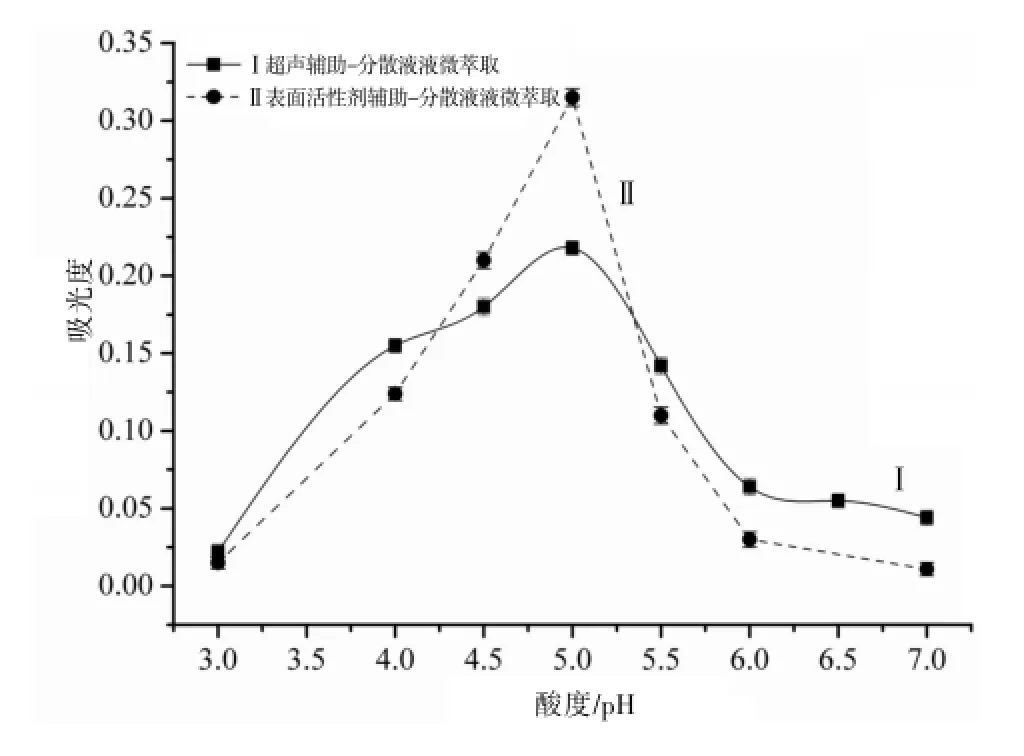
图6 溶液pH的影响
2.3干扰实验在考察两种方法的抗干扰能力时,在0.75 μg∕mL的LMFH溶液中加入相当于其含量50倍的硬脂酸镁,100倍的糊精、乳糖、淀粉等,按照SA-DLLME和UA-DLLME的实验方法操作,在优化的实验条件下,测定其吸光度。实验表明,当加入上述含量的干扰物质时,其吸光度与0.75 μg∕mL的LMFH标准溶液按照其实验方法操作所得的吸光度相比差异无统计学意义。因此,在测定药物的胶囊及片剂时,经过过滤后,可以用该方法进行测定。
2.4方法分析性能在最优实验条件下,对方法的分析性能进行了考察,总结和对比了经过UA-DLLME萃取、经过SA-DLLME萃取及不萃取直接显色测定的分析性能。见表1。
2.5样品分析为验证所建立方法的实用性和准确性,将该方法用于盐酸洛美沙星胶囊和片剂的测定。在测定药品胶囊和片剂的实验中,分别取2.0 mL约为10 μg∕mL的盐酸洛美沙星胶囊试样溶液及片剂试样溶液,各于40 mL的具塞离心管中,按优化的实验条件进行SA-DLLME和UA-DLLME萃取和分析测定(样品储备液在此过程中稀释了20倍),并进行了加标回收实验,加标回收率在92.5%~101.0%。见表2。
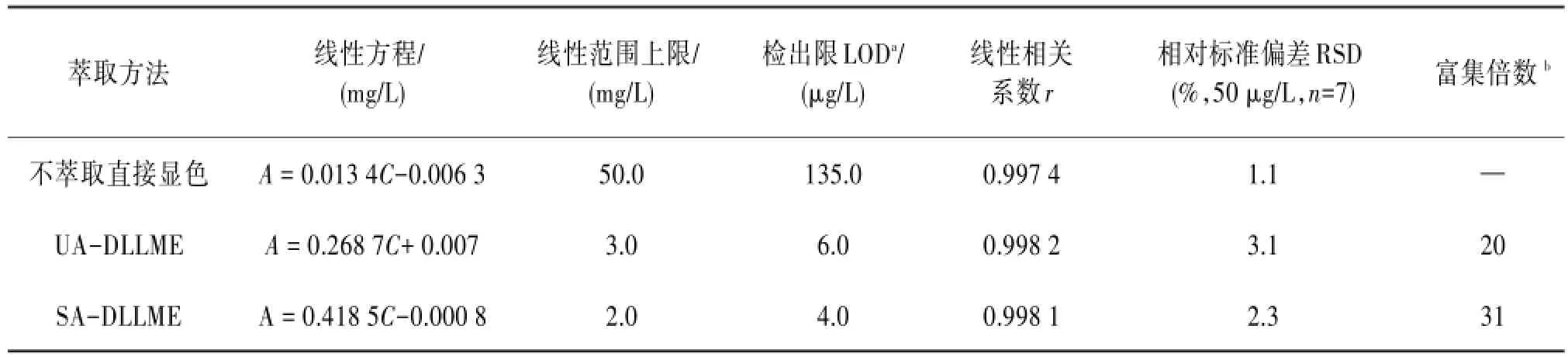
表1 分析性能
表2 盐酸洛美沙星胶囊和片剂样品溶液的分析结果()

表2 盐酸洛美沙星胶囊和片剂样品溶液的分析结果()
实际样品 富集方法盐酸洛美沙星胶囊盐酸洛美沙星药片■■■■■ ■■■■■UA-DLLME SA-DLLME UA-DLLME SA-DLLME实际样品中检测值∕(mg∕L) 0.446±0.021 0.479±0.023 0.435±0.019 0.466±0.022加标量∕(mg∕L) 1.0 1.0 1.0 1.0回收率∕% 101.0 100.0 92.5 94.6
3 结论
本实验建立了表面活性剂辅助-分散液液微萃取(SA-DLLME)和超声辅助-分散液液微萃取(UA-DLLME)与紫外-可见分光光度法(UV-vis)联用测定LMFH含量的新方法,实验结果表明该方法具有富集倍数高,操作简单,成本低,环境友好等优点。本方法是对传统的分散液液微萃取技术的提升和扩展,同时显著提高了普通分光光度法在药物分析方面的分析性能,具有一定的实用价值和研究意义。
〔1〕谭峰,郎惠云,李媛.萃取分光光度法测定盐酸洛美沙星〔J〕.分析化学,2001,29(5):561-564.
〔2〕冯琳,储秋萍,邵志高.荧光分光光度法测定盐酸洛美沙星胶囊含量〔J〕.中国抗生素杂志,1996,21(1):17-19.
〔3〕李惠明,宣坚钢.盐酸洛美沙星片的紫外分光光度测定〔J〕.中国医药工业杂志,1995,26(12):546-548.
〔4〕李媛,郎惠云,谢志海.间接原子吸收法测定药物中盐酸洛美沙星含量〔J〕.西北大学学报(自然科学版),2000,30(1):39-42.
〔5〕谷杰,杨德君.高效液相色谱法测定盐酸洛美沙星葡萄糖注射液的含量〔J〕.中国药学杂志,1997,32(4):234-235.
〔6〕LIU H,DASGUPTA P K.Analytical chemistry in a drop. Solvent extraction in a microdrop〔J〕.Anal Chem,1996,68(11):1817-1821.
〔7〕JEANNOT M A,CANTWELL F F.Solvent microextraction intoasingledrop〔J〕.AnalChem,1996,68(13):2236-2240.
〔8〕REZAEE M,ASSADI Y,MILANI HOSSEINI M R,et al. Determination of organic compounds in water using dispersive liquid-liquid microextraction〔J〕.Journal of Chromatography A,2006,1116(1):1-9.
〔9〕WEN X,KONG L,CHEN M,et al.A new coupling of spectrophotometric determination with ultrasound-assisted emulsification dispersive liquid-liquid microextraction of tracesilver〔J〕.SpectrochimicaActaAMolBiomolSpectrosc,2012,97:782-787.
〔10〕DENG Q,CHEN M,KONG L,et al.Novel coupling of surfactant assisted emulsification dispersive liquid-liquid microextraction with spectrophotometric determination for ultra trace nickel〔J〕.Spectrochim Acta A Mol Biomol Spectrosc,2013,104:64-69.
〔11〕WEN X D,YANG S C,ZHANG H Z,et al.Determination of trace bismuth by using a portable spectrometer after ultrasound-assisted dispersive liquid-liquid microextraction〔J〕.Anal Methods,2014,6(21):8773-8778.
〔12〕杜新,刘伟华,张婧雯,等.超声辅助分散液-液微萃取-火焰原子吸收光谱法测定水样中的痕量锌〔J〕.河北农业大学学报,2010,33(2):123-127.
〔13〕卢委委,孙福生,董杰,等.超声辅助离子液体分散液液微萃取-反相液相色谱法测定水中丁醚脲残留〔J〕.分析测试学报,2010,29(11):1198-1202.
Investigation of Two Novel Extraction Methods Coupled with Spectrophotometry for the Detection of Lomefloxacin Hydrochloride
Lei Zirong,Yang Shu,Yang Shengchun,Wen Xiaodong*
(College of Pharmacy and Chemistry,Dali University,Dali,Yunnan 671000,China)
Objective:Surfactant-assisted dispersive liquid-liquid microextraction(SA-DLLME)and ultrasound-assisted dispersive liquid-liquid microextraction(UA-DLLME)were coupled with conventional spectrophotometer to pre-concentrate and determine lomefloxacin hydrochloride(LMFH),as well as to compare their analytical performances.Methods:The experimental conditions were optimized and the analytical performances of the two kinds of DLLME techniques for LMFH determination were compared.Results: After optimization,the LODs were 4.0 μg∕L and 6.0 μg∕L for SA-DLLME and UA-DLLME,respectively,with the enhancement factors of 31 and 20 folds.Conclusion:The analytical performance of SA-DLLME was obviously better than UA-DLLME.The developed methods were applied to the determination of LMFH in real samples with satisfactory analytical results.
surfactant-assisteddispersiveliquid-liquidmicroextraction;ultrasound-assisteddispersiveliquid-liquidmicroextraction; pre-concentration;spectrophotometer;lomefloxacin hydrochloride
R917
A
2096-2266(2016)12-0030-06
10.3969∕j.issn.2096-2266.2016.12.007
(责任编辑 李 杨)
国家自然科学基金资助项目(21165001;21465001)
2016-09-22
2016-11-09
雷自荣,硕士研究生,主要从事药物分析研究. *通信作者:温晓东,教授,博士.
