水通道蛋白4对肺癌细胞A549迁移能力的影响及其作用机制研究
2016-02-07周永春陈琬玲李融林
周永春,张 琦,陈琬玲,方 育,李融林,张 璟,王 倩,师 毅
·论著·
水通道蛋白4对肺癌细胞A549迁移能力的影响及其作用机制研究
周永春,张 琦,陈琬玲,方 育,李融林,张 璟,王 倩,师 毅
目的 探讨水通道蛋白4(AQP4)对肺癌细胞迁移能力的影响。方法 选取肺癌A549细胞株,采用AQP4小干扰RNA(siRNAs)进行转染,采用Transwell法检测肿瘤细胞迁移能力,采用蛋白质印迹(Western blotting)法检测上皮型钙黏蛋白(E-cadherin)、神经型钙黏蛋白 (N-cadherin)及波形蛋白(Vimentin)表达水平,同时分析其对上皮间质转化(EMT)的影响。结果 敲降AQP4可抑制肺癌细胞A549迁移能力及EMT,上调E-cadherin表达水平并下调N-cadherin和Vimentin表达水平(P<0.05)。结论 抑制AQP4表达可有效降低肺癌细胞A549迁移能力并抑制EMT,推测促进EMT可能是AQP4的主要分子作用机制。
肺肿瘤;水通道蛋白质4;细胞迁移抑制;药理作用分子作用机制
周永春,张琦,陈琬玲,等.水通道蛋白4对肺癌细胞A549迁移能力的影响及其作用机制研究[J].实用心脑肺血管病杂志,2016,24(12):55-58.[www.syxnf.net]
ZHOU Y C,ZHANG Q,CHEN W L,et al.Impact of aquaporin 4 on migration of lung cancer A549 cells and the mechanism[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2016,24(12):55-58.
肺癌发病率和病死率均较高,且近年来呈逐年升高趋势;非小细胞肺癌(NSCLC)约占所有肺癌的80%,小细胞肺癌(SCLC)约占20%[1-2]。第三次全国居民死亡原因调查结果显示,过去30年间我国肺癌患者病死率升高了46.5%,肺癌病死率已位居所有癌症第一位[1]。虽然我国目前医疗诊治水平有了很大提高,但肺癌患者5年生存率仍不足15%[3]。
水通道蛋白(aquaporins,AQPs)是一组与水及部分小分子通透性相关的细胞膜转运蛋白,近年研究结果显示,AQP1、AQP3及AQP5等在肺癌细胞增殖和迁移过程中发挥着重要作用[4-10],但目前关于AQP4对肺癌细胞增殖、迁移等影响及其作用机制的研究报道较少。本研究旨在探讨AQP4对肺癌细胞A549迁移能力的影响及其作用机制,以期为肺癌的靶向治疗提供参考。
1 材料与方法
1.1 细胞株 肺癌A549细胞株购自中国科学院昆明动物研究所,细胞生长状况良好。
1.2 试剂 Hyclone胎牛血清(FBS);Transwell和lipofectamine 2000由ThermoFisher Scientific提供;小干扰RNA(siRNAs)由上海吉玛生物科技有限公司提供;肌动蛋白(β-actin)、AQP4、上皮型钙黏蛋白(E-cadherin)、神经型钙黏蛋白(N-cadherin)及波形蛋白(Vimentin)抗体由Santa Cruz Biotechnology提供。
1.3 细胞培养及转染 将肺癌细胞A549置于含10%FBS的RPMI-1640培养基,于37 ℃、5%二氧化碳(CO2)培养箱内培养,待细胞长至瓶底约80%时采用胰酶消化、传代,取对数生长期细胞进行实验;于转染前24 h将处于对数生长期的细胞接种到6孔板,采用lipofectamine 2000进行细胞转染,转染过程严格按照说明书进行操作;转染24 h后采用Transwell法检测细胞迁移能力,转染48 h后收集蛋白样品采用蛋白质印迹(Western blotting)法检测上皮间质转化(EMT)相关蛋白〔上皮型钙黏蛋白(E-cadherin)、神经型钙黏蛋白 (N-cadherin)及波形蛋白(Vimentin)〕表达水平。AQP4-siRNA-1序列为5′-GGUCUCCUGGUAGAGUUGAUAAUCA-3′,AQP4-siRNA-2序列为5′-GCTCAATAGCTTTAGCAATTG-3′,对照-siRNA(Negative Control)序列为5′-GGUCCGUUGGAGAUUAGAUAUCUCA-3′。
1.4 Transwell检测方法 取AQP4-siRNAs转染的肺癌细胞A549,静置24 h后消化、离心,采用含0.1%牛血清清蛋白(BSA)的无血清培养基进行混悬、稀释并计数细胞数,调整细胞数为1×105,吸取100 μl细胞悬液加入Transwell小室的上室,下室中加入含10%FBS的RPMI-1640培养基;置于37 ℃、5% CO2细胞培养箱内培养36 h,取出上室并自然风干,采用多聚甲醛固定15 min,磷酸盐缓冲液(PBS)清洗2 min后采用0.1%结晶紫染色,于100倍光镜下随机选取10个视野进行观察并计数细胞数,重复3次取平均值。
1.5 RT-PCR 取对数生长期肺癌细胞A549,转染AQP4-siRNAs 48 h后采用0.25%胰酶消化,加入Trizol试剂1 ml,混匀后提取总RNA;采用紫外分光光度计检测RNA中R值,根据公式A260/A280计算RNA总浓度。反转录反应体系:于0.2 ml EP管中加入10 μmol/L Oligo(dT)1 μl、总RNA 8 μl、焦碳酸二乙酯(DEPC)水3 μl,混匀后离心;于PCR仪上65 ℃加热5 min,之后冰浴3 min;在上述EP管中加入10 mmol/L脱氧核糖核苷三磷酸(dNTP)Mix 2 μl、5×Reaction Buffer 4.0 μl、RevertAidM-MuLV Reverse Transcniptase 1 μl、RibolockRnase inhibitor 1 μl;42 ℃加热60 min,70 ℃加热5 min;最后将得到的总RNA与合成的cDNA在-20 ℃冰箱中保存待测。荧光定量检测方法:采用20 μl反应体系,包括cDNA 2 μl,10 μmol/L引物1 μl,Takara的SYBR premix Ex Taq Ⅱ 10 μl,DEPC水7 μl。反应条件:95 ℃预变性30 s,循环40次(95 ℃变性5 s,60 ℃退火和延伸34 s),然后导出溶解曲线。引物序列如下:ZEB1上游引物:5′-CTACTCAACTACGGTCAGCCC-3′,ZEB1下游引物:5′-TTGGGCGGTGTAGAATCAGAG-3′;SNAIL上游引物:5′-TCCCTGTCAGATGAGGACAGT-3′,SNAIL下游引物:5′-TTTCGAGCCTGGAGATCCTTG-3′;基质金属蛋白酶9(MMP-9)上游引物:5′- GTACTGGCGATTCTCTGAGGG-3′,MMP-9下游引物:5′- CTCAAAGACCGAGTCCAGCTT-3′;甘油醛-3-磷酸脱氢酶(GAPDH)上游引物:5′-AAATCCCATCACCATCTTCCAG-3′,GAPDH下游引物:5′-GAGTCCTTCCACGATACCAAAGTTG-3′。内参基因为GAPDH,相对表达量采用2ΔΔCt法计算。
1.6 蛋白质印迹法 采用AQP4-siRNAs转染的肺癌细胞A549,静置48 h后于冰上操作,刮下细胞并移至1.5 ml EP管;每瓶加250~500 μl放射免疫沉淀法(RIPA)裂解液,1 200 r/min离心5 min,收集蛋白;采用聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,之后将蛋白转移至聚偏氟乙烯(PVDF)膜上;采用5%脱脂奶粉在室温下封闭1 h,一抗室温孵育2~3 h,二抗室温孵育1 h;室温下将ECL混合液滴加在PVDF膜上,避光反应3~5 min,显影、定影;以β-actin为内参。
1.7 统计学方法 采用SPSS 13.0统计软件处理数据,数据以箱式图表示,采用Student′t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 AQP4表达水平 与对照-siRNA比较,AQP4-siRNAs-1、AQP4-siRNAs-2转染的AQP4表达均降低(见图1)。
2.2 肺癌细胞A549迁移能力 与对照-siRNA比较,AQP4-siRNAs-1、AQP4-siRNAs-2转染的肺癌细胞A549迁移能力明显降低(P<0.05,见图2)。
2.3 E-cadherin、N-cadherin及Vimentin表达水平 与对照-siRNA比较,AQP4-siRNAs-1、AQP4-siRNAs-2转染的E-cadherin表达水平升高,N-cadherin和Vimentin表达水平降低(见图3);ZEB1和SNAIL mRNA表达水平降低(见图4、5);MMP-9表达水平降低(见图6)。
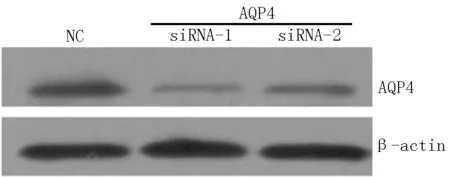
注:NC=对照-siRNA,AQP4=水通道蛋白4,siRNA=小干扰RNA,β-actin=肌动蛋白
图1 AQP4-siRNAs可降低AQP4表达水平
Figure 1 AQP4-siRNAs significantly down-regulated the protein expression of AQP4
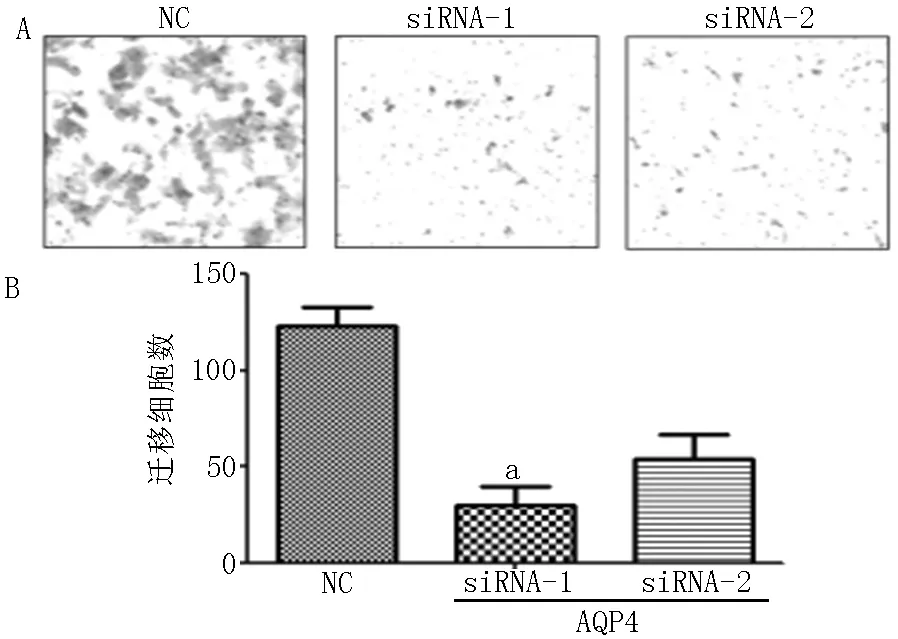
注:A为0.1%结晶紫染色图,B为箱式图;与对照-siRNA比较,aP<0.001
图2 敲降AQP4可抑制肺癌细胞A549的迁移
Figure 2 Knockdown of AQP4 significantly inhibited the migration of lung cancer A549 cells
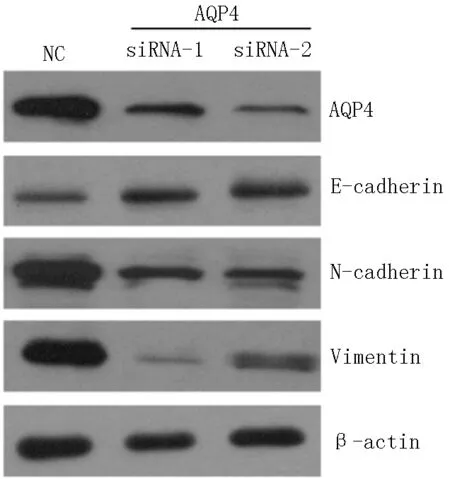
注:E-cadherin=上皮型钙黏蛋白,N-cadherin=神经型钙黏蛋白,Vimentin=波形蛋白
图3 敲降AQP4可抑制肺癌细胞A549 EMT
Figure 3 Knockdown of AQP4 significantly inhibited the EMT of lung cancer A549 cells
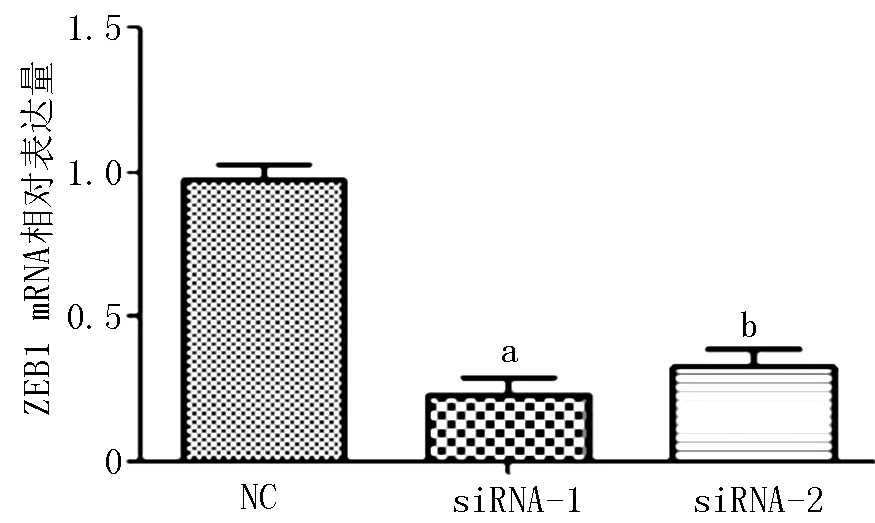
注:与对照-siRNA比较,aP<0.01,bP<0.001
图4 敲降AQP4可抑制肺癌细胞A549中ZEB1 mRNA表达
Figure 4 Knockdown of AQP4 significantly reduced the mRNA expression of ZEB1 of lung cancer A549 cells
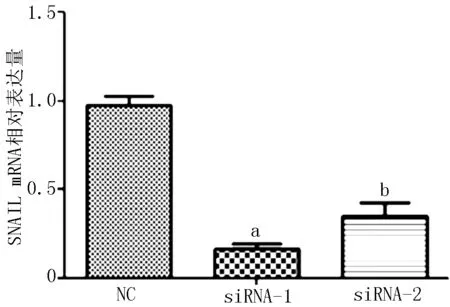
注:与对照-siRNA比较,aP<0.01,bP<0.001
图5 敲降AQP4可抑制肺癌细胞A549中SNAIL mRNA表达
Figure 5 Knockdown of AQP4 significantly reduced the mRNA expression of SNAIL of lung cancer A549 cells
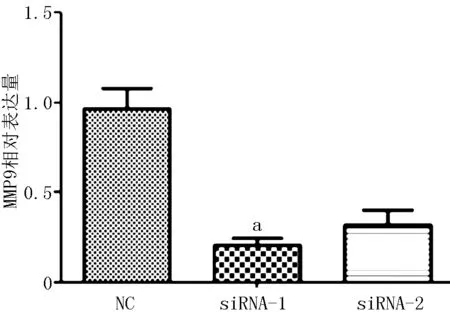
注:与对照-siRNA比较,aP<0.001
图6 敲降AQP4可抑制肺癌细胞A549中MMP-9的表达
Figure 6 Knockdown of AQP4 significantly reduced the expression of MMP-9 of lung cancer A549 cells
3 讨论
肺癌是目前全球范围内对人类身体健康和生命安全危害较大的恶性肿瘤之一,全球肺癌发病率约为20/100 000人,我国约为22/100 000人。外科手术是治疗肺癌的主要手段之一,虽然近年来手术技术及方式等取得了较大进展,但肺癌患者生存率并未得到有效提高;放疗、化疗毒副作用较大,且部分肺癌患者治疗反应较差。因此,探讨肺癌的发病机制、寻找抗肿瘤治疗新靶点仍是当前研究热点、难点之一。
近年研究表明,AQPs广泛存在于人体肺、胃、肠、肾、脑等器官组织中,且其在肿瘤的发生发展中发挥着重要作用[4-10],西妥昔单抗和阿法替尼可通过有效降低AQP1的表达而抑制肺癌细胞增殖并诱导癌细胞凋亡[11]。WEI等[5]研究发现,敲降AQP1可有效抑制肺癌细胞增殖及迁移能力,而抑制AQP3的表达可有效降低低氧诱导的NSCLC细胞生长[4,6],提示AQP1和AQP3在肺癌细胞增殖、迁移过程中发挥着重要作用。有研究发现,AQP4在宫颈上皮内瘤变组织中的表达水平明显高于正常宫颈上皮,且其在原发性胶质瘤组织中的表达水平也明显升高[12-14],但目前关于AQP4在肺癌中的作用机制尤其是分子作用机制的研究报道较少。
LI等[15]近期研究结果显示,沉默乳腺癌细胞T47D和MCF-7 AQP4可有效抑制癌细胞增殖、迁移及侵袭,同时还可上调E-cadherin的表达。也有研究表明,AQP4在肺癌细胞中呈高表达,敲降AQP4可明显降低肺癌细胞迁移能力[16-17],但目前关于AQP4影响肺癌细胞迁移能力的分子作用机制尚不清楚。EMT是导致肿瘤细胞迁移能力增强并最终引起肿瘤转移的重要生物学过程[13,18-19],E-cadherin表达降低和N-cadherin、Vimentin表达升高是反映EMT的重要指标[20-21]。本研究结果显示,敲降AQP4可上调肺癌细胞A549 E-cadherin的表达,下调N-cadherin和Vimentin的表达,提示沉默AQP4可有效抑制肺癌细胞EMT。鉴于EMT是肿瘤细胞迁移及转移的重要生物学过程,因此推测AQP4可通过促进EMT而增强肺癌细胞迁移能力。本研究结果还显示,敲降AQP4可通过降低E-cadherin而抑制ZEB1 mRNA和SNAIL mRNA的 表达及MMP-9的激活,进而抑制EMT。
综上所述,AQP4高表达参与了肺癌的发生发展,抑制其表达可有效降低肺癌细胞A549迁移能力并有效抑制EMT,推测促进EMT可能是AQP4的主要分子作用机制。
[1]HALL Z,AMENT Z,WILSON C H.Myc expression drives aberrant lipid metabolism in lung cancer[J].Cancer Res,2016,76(16):4608-4618.
[2]MELOSKY B,AGULNIK J,ALBADINE R,et al.Canadian consensus:inhibition of ALK-positive tumours in advanced non-small-cell lung cancer[J].Curr Oncol,2016,23(3):196-200.
[3]PARKIN D M,BRAY F,FERLAY J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[4]HOU S Y,LI Y P,WANG J H,et al.Aquaporin-3 inhibition reduces the growth of NSCLC cells induced by hypoxia[J].Cell Physiol Biochem,2016,38(1):129-140.
[5]WEI X B,DONG J C.Aquaporin 1 promotes the proliferation and migration of lung cancer cell in vitro[J].Oncol Rep,2015,34(3):1440-1448.
[6]XIA H,MA Y FU,YU C H,et al.Aquaporin 3 knockdown suppresses tumour growth and angiogenesis in experimental non-small cell lung cancer[J].Exp Physiol,2014,99(7):974-984.
[7]CHAE Y K,WOO J,KIM M J,et al.Expression of aquaporin 5(AQP5)promotes tumor invasion in human non small cell lung cancer[J].PLoS One,2008,3(5):e2162.
[8]XIANG Y,MA B,LI T,et al.Acetazolamide inhibits aquaporin-1 protein expression and angiogenesis[J].Acta Pharmacol Sin,2004,25(6):812-816.
[9]VERKMAN A S.Novel roles of aquaporins revealed by phenotype analysis of knockout mice[J].Rev Physiol Biochem Pharmacol,2005,155:31-55.
[10]ZHANG H,SHAO H,GOLUBOVSKAYA V M,et al.Efficacy of focal adhesion kinase inhibition in non-small cell lung cancer with oncogenically activated MAPK pathways[J].Br H Cancer,2016,115(2):203-211.
[11]LIU Y H,ZHU W L.Effects of cetuximab combined with afatinib on the expression of KDR and AQP1 in lung cancer[J].Genet Mol Res,2015,14(4):16652-16661.
[12]SHEN Q,LIN W,LUO H,et al.Differential expression of aquaporins in cervical precursor lesions and invasive cervical cancer[J].2016,23(11):1551-1558.
[13]BAEK S H,KO J H,LEE J H,et al.Ginkgolic Acid Inhibits Invasion and Migration and TGF-β-Induced EMT of lung cancer cells through PI3K/Akt/mTOR Inactivation[J].J Cell Physiol,2016,232(2):346-354.
[14]MOBASHERI A,BARRETT-JOLLEY R.Aquaporin water channels in the mammary gland:from physiology to pathophysiology and neoplasia[J].J Mammary Gland Biol and Neoplasia,2014,19(1):91-102.
[15]LI Y B,SUN S R,HAN X H.Down-regulation of AQP4 inhibits proliferation,migration and invasion of human breast cancer cells[J].Folia Biol(Praha),2016,62(3):131-137.
[16]WARTH A,MULEY T,MEISTER M,et al.Loss of aquaporin-4 expression and putative function in non-small cell lung cancer[J].BMC Cancer,2011,11:161.
[17]XIE Y P,WEN X H,JIANG Z Q,et al.Aquaporin 1 and aquaporin 4 are involved in invasion of lung cancer cells[J].Clin Lab,2012,58(1/2):75-80.
[18]HUANG S F,HORNG C T,HSIEH Y S,et al.Epicatechin-3-gallate reverses TGF-β1-induced epithelial-to-mesenchymal transition and inhibits cell invasion and protease activities in human lung cancer cells[J].2016,Food Chem Toxicol,2016,94:1-10.
[19] KOHNOH T,HASHIMOTO N,ANDO A,et al.Hypoxia-induced modulation of PTEN activity and EMT phenotypes in lung cancers[J].2016,16:33.
[20]ZHENG N,HUO Z,ZHANG B,et al.Thrombomodulin reduces tumorigenic and metastatic potential of lung cancer cells by up-regulation of E-cadherin and down-regulation of N-cadherin expression[J].2016,Biochem Biophys Res Commun,2016,476(4):252-259.
[21]LI Y,CHEN P,ZU L,et al.MicroRNA-338-3p suppresses metastasis of lung cancer cells by targeting the EMT regulator Sox4[J].Am J Cancer Res,2016,6(2):127-140.
(本文编辑:王凤微)
Impact of Aquaporin 4 on Migration of Lung Cancer A549 Cells and the Mechanism
ZHOUYong-chun,ZHANGQi,CHENWan-ling,FANGYu,LIRong-lin,ZHANGJing,WANGQian,SHIYi
.TheThirdAffiliatedHospitalofKunmingMedicalUniversity(YunnanProvincialKeyLaboratoryforLungCancer),Kunming650118,China
SHIYi,BloodTransfusionDepartment,DongguanBranchofAffiliatedHospitalofYan′anUniversity,Yan′an716000,China;E-mail:shiyandong0104@163.com
Objective To explore the impact of aquaporin 4(AQP4)on migration of lung cancer A549 cells and the mechanism.Methods We selected lung cancer A549 cells and transfected these cells by AQP4 siRNAs.Transwell assay was used to detect the tumor cell migration,Western blotting assay was used to detect the protein expressions of E-cadherin,N-cadherin and Vimentin,and the impact on epithelial-mesenchymal transition(EMT)was analyzed.Results Knockdown of AQP4 can significantly inhibite the migration and EMT of lung cancer A549 cells,up-regulate the E-cadherin protein expression and down-regulated the protein expressions of N-cadherin and Vimentin(P<0.05).Conclusion Knockdown of AQP4 may inhibite the migration and EMT of lung cancer A549 cells,promoting EMT may be the main molecular mechanism of AQP4.
Lung neoplasms;Aquaporin 4;Cell migration inhibition;Molecular mechanisms of pharmacological action
云南省教育厅科研基金重点项目(2013Z110);云南省科技厅-昆明医科大学联合专项基金项目(2013FB132)
650118云南省昆明市,昆明医科大学第三附属医院(云南省肺癌重点实验室)(周永春);昆明医科大学第一附属医院胸外科(张琦,李融林,张璟);中国人民武装警察部队云南省总队医院肿瘤科(陈琬玲);昆明医科大学第一附属医院麻醉科(方育);南京总医院消毒供应科(王倩);延安延安大学附属医院东关分院输血科(师毅)
师毅,716000陕西省延安市,延安大学附属医院东关分院输血科;E-mail:shiyandong0104@163.com
R 734.2
A
10.3969/j.issn.1008-5971.2016.12.014
2016-09-10;
2016-12-04)
