人乳头瘤病毒HPV E6/E7mRNA检测用于宫颈癌术后随访的研究
2016-02-07樊利芳肖凤仪
方 恋,樊利芳,肖凤仪
(1.武汉大学医学院基础医学院,湖北 武汉 430060;2.湖北医药学院附属随州医院妇产科,湖北 随州 441300)
宫颈癌(Cervical cancer)是目前全世界范围内,妇女所患最常见的恶性肿瘤之一。现代医学研究表明高危型人乳头状病毒(HPV)的感染是妇女罹患宫颈病变及宫颈癌发生的重要因素[1],其主要致病机制是位于HPV内部的E6/E7癌基因表达产生E6/E7癌蛋白,E6蛋白抑制p53而阻断凋亡,E7蛋白抑制pRB使细胞周期失控,致使细胞癌变的发生。而HPV E6/E7mRNA是E6/E7癌基因表达活动的直接产物,也是E6/E7癌蛋白合成的模板,是宫颈病变开始和进展的必要条件。因此,HPV E6/E7 mRNA检测是继HPV DNA检测之后的新一代宫颈病变评估方法,且通过对病毒癌基因的活动状态的检测来评估宫颈病变的风险程度,可能具有更高的特异性和阳性预测值。本研究对我院120例宫颈癌术后患者术后3个月内取脱落细胞行HPV E6/E7 mRNA的检测,并进行了为期18个月的随访跟踪,以探讨HPV E6/E7 mRNA检测在宫颈癌术后随访及评估复发风险的临床应用价值及优势。
1 资料与方法
1.1 一般资料
选取我院2014年3月~2015年9月的120例已行宫颈癌手术且病理确诊为宫颈病变的患者。病例纳入标准:1)患者均符合术后复检标准,即术后3个月对其复诊时采集阴道脱落细胞;2)年龄在36~69岁;3)排除在3天内有阴道给药或阴道冲洗者;4)无内科免疫系统疾病及使用相关药物史;5)无化疗及盆腔放疗史;6)初次术后切缘阴性;7)对于以上各组研究对象的临床年龄、体重等一般指标进行对比统计分析后发现,差异无统计学意义(P>0.05)。且在观察范围内的所有对象均给予签署相关知情同意书。8)临床随访资料完整。
1.2 方法
1.2.1 HPV E6/E7 mRNA拷贝数测定
使用专用刷在阴道残端逆时针旋转3圈,停留10 s,将得到的标本置于标本保存管中。采用分支链DNA(b-DNA)扩增技术对HPV E6/E7 mRNA进行检测,使用仪器试剂为科蒂亚生物技术有限公司生产的QuantiVirusTM冷光仪和HPV E6/E7 mRNA检测试剂盒。严格遵循试剂盒说明进行操作,以拷贝数< 1copy/ml 为阴性,≥1copy/ml 为阳性。
1.2.2 薄层液基细胞学检(TCT)
用TCT专用毛刷收集阴道残端的脱落细胞,按照国际癌症协会推荐的伯塞斯达系统(TBS)(2001)分类标准染色分类。
1.2.3 阴道镜检查及宫颈活检
由专职阴道镜医师用电子阴道镜观察,并于醋酸白试验和碘试验异常区行选择性多点组织检查(活检)或取阴道残端3,6,9,12点行常规活检。
1.2.4 随访检测
于术后3个月内进行HPV E6/E7 mRNA的检测,按检测结果分阴性及阳性组,并于术后6个月、12个月、18个月三时间点进行随访检测,行薄层液基细胞学检测(TCT)及阴道镜检查,阴道镜检阳性患者行组织病理活检。
1.2.5 复发判断标准
术后随访阴道残端病理诊断发现HPV E6/E7 mRNA检测阳性判断为复发。
1.3 统计学方法
采用SPSS17.0统计学软件进行分析,按照1.2.5所述复发判断标准版,计算HPV E6/E7 mRNA检测的敏感性 特异性阳性预测值 阴性预测值 和预测复发正确率。采用x2检验,以P<0.05为差异有统计学意义。
2 结 果
术后6、12、18个月的随访检测时累计发现病灶复发共计21例,残留/复发比例为17.5%(21/120)。
术后进行HPV E6/E7 检测的120名受试者有20名检测结果为阳性,此120名宫颈癌患者术后12个月后共有21人出现残留/复发。其预测率为95.23%(20/21)。
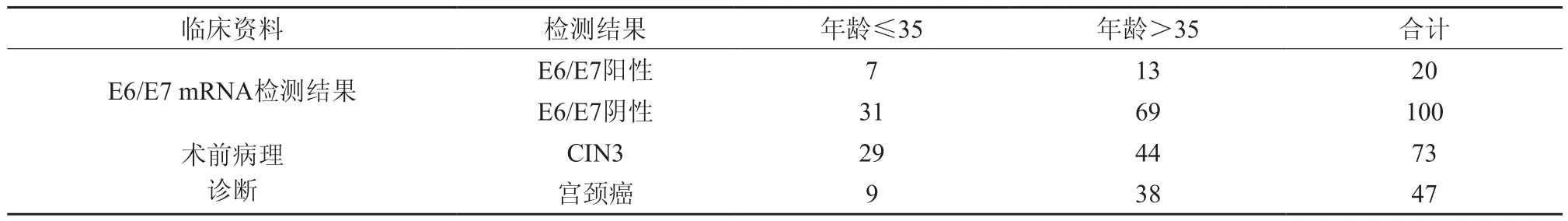
表1 120例宫颈癌患者随访前基本情况

表2 120例患者术后18个月累计随访检测结果

表3 E6E7mRNA 检测对术后预测残留/复发的诊断价值
3 讨 论
宫颈癌是现代女性生活危害妇女生命健康的一大疾患,现已升为妇科肿瘤第二大疾病,而感染HPV是公认的宫颈癌患者发病的重要原因。罹患宫颈癌(I-Ⅱa期)患者早期治疗以手术为主,其术后5年存活率较高,可达100%,但仍有部分患者出现术后复发的可能。而早期检查与早期手术干预,则极大地提高了宫颈癌患者的愈后,但是对于晚期以及术后复发的患者的治疗仍十分棘手。复发往往发生在具有高危因素的患者:如盆腔内有淋巴结转移、宫颈局部病变超过4cm者均为复发相关因素,且初次手术治疗后,患者是否会出现复发、什么时候复发以及复发部位均难以预测,误诊及临床分期不准确或许是其复发的原因之一。宫颈癌是目前治疗效果相对较好的妇科肿瘤,通常临床医师认为Ⅱa期以前的病例最好采取手术治疗,但临床上常发生不规范的手术治疗,如术前诊断不准确、临床分期不准确,使手术范围过小,从而导致术后复发。除上述因素外,宫颈癌预后差的原因还包括:患者年龄≦35岁、临床分期晚、原发肿瘤≧4cm,肿瘤的组织学类型不良及子宫颈深间质侵犯、淋巴毛细血管受侵、盆腔和腹主动脉旁淋巴结转移、宫旁组织受侵、阴道切缘阳性和子宫内膜受侵等因素。因此,有学者提出对早期宫颈癌患者,单一外科治疗不能使其生存期最大限度延长,为了提高疗效,必须对有复发危险因素的患者进行综合治疗,即新辅助化疗(NAC)和术后同步放化疗。但由于放化疗均有较大的副作用,如何评估宫颈癌术后患者的复发风险,筛选出须要接受术后同步放化疗的高风险患者就显得尤为重要。
目前常用的术后随访监测是通过HPV DNA检测,细胞学检测,阴道镜检测和组织病理活检。其中细胞学检测,阴道镜检测和组织病理活检只有当癌变已经发生后检测出来,无法作为预测术后复发风险的指标。HPV DNA检测通过检测病毒本身的存在评估宫颈病变,虽然具有较高的敏感性,但特异性相对较低,可检出过多的无临床意义感染(如一过性感染)。宫颈癌的关键病因是HPV E6/E7癌基因表达产生E6/E7癌蛋白(真正的致癌物质)。HPV E6/E7 mRNA是E6/E7癌基因表达活动的直接产物,也是E6/E7癌蛋白合成的模板,是宫颈癌变开始和进展的必要条件。持续性整合感染才会产生较多的E6/E7 mRNA, 进而产生较多的E6/E7癌蛋白,从而导致宫颈癌。HPV E6/E7 mRNA检测通过检测病毒致癌基因表达产生致E6/E7癌蛋白的活动及活动程度,评估宫颈术后复发风险,具有更高的特异性和阳性预测值。
HPV是一类亚型种类繁多,可感染阴道上皮鳞状细胞的双链DNA病毒。其中已确认特异HPV亚型的感染与肛门、生殖器鳞癌的发生有关,包括外阴、阴道、肛门、阴茎及头颈部癌[2-7]。大部感染者均能够自愈,但仍有部分人可持续存在,且最后发展为不同分型的宫颈病变,而高致病性的主要由高危HPVs所致[8]。
有研究表明[9]99.7%的宫颈癌患者的病变组织中都存在有HPV的感染,其阳性说明已有HPV的感染,但并不代表其已致癌变,只有反复感染或持续感染的患者才会进展[10],这种感染人群机率很低,少于10%;这说明HPV DNA的检测可能会检测出较多无临床意义的感染,而对于识别HPV DNA是否存在有持续感染则显得成尤为重要;HPV E6/E7 mRNA的检测是对HPV DNA检测缺陷的弥补,因其检测的指标为宫颈细胞病变程度相关的病毒活动,因此HPV E6/E7 mRNA检测技术是近年来国际上最新推出的新一代检测靶标,其不仅对高危型HPV持续性感染的妇女有诊断价值,对于已行宫颈癌术后的患者同时也具有很高、很精准的临床诊断价值。Sotlar K等的研究表明,与HPV DNA检测相比,E6/E7 mRNA检测作为判断HPV与病变进展为宫颈癌的风险相关性的指标更有效[11]。
本研究中通过对120例宫颈癌术后的患者进行HPV E6/E7 mRNA方法检测,并在共计18个月的随访期间行TCT检测和阴道镜检测,阴道镜检阳性患者行组织病理活检。结果显示术后3个月内检测HPV E6/E7 mRNA阳性患者全部在18个月内出现残留/复发病灶,而术后E6/E7 mRNA阴性患者仅有1%(1/100)出现残留/复发病灶。对于预测术后复发风险,HPV E6/E7mRNA检测显示出非常高的特异度与阳性预测值,这一点与国外Benevolo[12]的研究结果也是相符的。此外,本研究随访期内同时进行了3次液基细胞学检测,但是仍有3例(2.5%)TCT结果阴性的患者活检证实出现病灶残留/复发,这3例患者E6/E7 mRNA检测均为阳性。另一方面,本研究中唯一1例E6/E7阴性活检出现复发患者 TCT结果为阳性,说明如果将TCT与HPV E6/E7 mRNA检测联合则可能更好的避免出现漏诊。
综上所述,笔者认为HPV E6/E7 mRNA能够用于评估宫颈癌患者术后复发风险,临床上建议针对术后E6/E7mRNA阳性患者加强随访监控,可尝试早期联合放化疗治疗方案积极地采取措施,以期降低宫颈癌患者术后复发率,并及时对于出现复发病灶患者进行治疗。
[1] Sn-ders PJ,Heideman DA,Meijer CJ.Methodsfor HPV de-tection in exfoliated cell and tissuepecimens.APMIS,2010,118(6~7):520-528.
[2] HILLBERTZ NS,HIRSCH JM,JALOULI J,etal.Viral and molecular aspects of oral cancel[J].Anticancer Res,2012,32(10):4201-4212.
[3] 孙 远,徐卫国.HPV与肛门肿瘤[J].国际肿瘤学杂志,2010,37(7):544-547.
[4] JOSEPH AW,D′SOUZA G.Epidemiology of human papillomavirus-related head and neck cancer[J].Otolaryngol Clin North Am,2012,45(4):739-764.
[5] SEHNAL B,DRIAK D,NEUMANNOVA H,et al.Prevalence of anal human papillomma virus infection among women and its relation to cervical HPV infection [J].Cseka Gynekol,2012,77(3):210-214.
[6] BIRCH-JOHANSEN F,NORRILD B,OLESEN A B,et at.HPV infection might play a role in the development of nonmelanoma skin cancer in immunocompetent indivdduals[J].Ugeskr Laeger,2012,174(7):413-417.
[7] 李 海,邓志勇,张 阳.人乳头瘤病毒在阴茎鳞癌组织中的表达及意义[J].现代实用医学,2010,22(9):1037-1038.
[8] STANLEN M.Pathology and epidemiology of HPV infection in females [J].gynecol Oncol,2010,117(2):5-10.
[9] 任美英,王翠峰,付玉华.HPV E6/E7 mRNA定量检测技术及其在宫颈病变中的临床应用,世界最新医学信息文摘(电子版),2012,12(9):50.
[10] 赵倩颖,郑明蓉.高危型人乳头瘤病毒E6/E7 mRNA检测筛检宫颈癌的价值.中国实用妇科与产科杂志,2013,29(10):837-840.
[11] Sotlar K,Selinka HC,Menton M,et al.Detection of human papillomavirus type 16 E6/E7 oncogene transcripts in dysplastic and nondysplastic cervical scrapes by nested RT-PCR. Gynecologic oncology,1998,69(2):114-121.
[12] Benevolo M, Vocaturo A, Caraceni D,et al. Sensitivity, Specificity and clinical value of human papillomavirus(HPV) E6/E7 mRNA assay as a triage test for cervical cytology and HPV DNA test [J].Clin Microbiol,2011,49(7):2643-2650.
