汤旺河花斑副沙鳅繁殖季节性腺发育组织学观察
2016-02-07李培伦刘伟王继隆
李培伦,刘伟,王继隆
(中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070)
汤旺河花斑副沙鳅繁殖季节性腺发育组织学观察
李培伦,刘伟,王继隆
(中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070)
运用组织切片技术研究汤旺河花斑副沙鳅Parabotia fasciata繁殖季节的性腺发育。结果表明:花斑副沙鳅性成熟系数在6月份最高,其中雄性群体的平均成熟系数为(1.26±0.28)%,雌性群体为(27.6±3.14)%;6~8月,花斑副沙鳅性成熟系数逐渐降低,推断其繁殖盛期在6月中旬~7月上旬。繁殖季节汤旺河花斑副沙鳅精巢发育处于精子形成阶段,精小囊相互融合,大量的精细胞向精子转变,排精后精巢内充满网状的结缔组织,染色后呈粉红色,精原细胞游离于囊腔内,精巢结构为典型的小叶型结构。花斑副沙鳅只有一侧卵巢,繁殖季节卵巢切面显示,主要由第Ⅰ、Ⅱ、Ⅲ(早期)、Ⅴ和Ⅵ5个时相卵母细胞构成,其中第Ⅰ、Ⅱ、Ⅲ(早期)和Ⅵ时相卵母细胞主要存在于产后恢复期的卵巢内,第Ⅴ时相卵母细胞存在于成熟卵巢内。成熟卵母细胞卵径为628.9~893.6μm,放射带厚度为13.69~20.486μm。依据卵巢切面组织学及性成熟系数月份变化,推测汤旺河花斑副沙鳅为一次性产卵鱼类。
汤旺河;花斑副沙鳅;精巢;卵巢
花斑副沙鳅 Parabotia fasciata Dabry属鳅科(Cobitidae)、沙鳅亚科(Botiinae)、副沙鳅属(Parabotia),俗称黄沙鳅、黄鳅、沙鳅、花间刀、雷鱼等,为底栖小型经济鱼类,多栖息于江河支岔缓流处,以水生昆虫和藻类为食[1],分布于我国北至黑龙江、南至珠江各大水系的干流及其支流,也见于俄罗斯远东地区的黑龙江水系[1,2]。花斑副沙鳅肉质细嫩,营养价值高,深受消费者的喜爱,亦可作为观赏型鱼类[3],但由于其天然产量较低,价格一直较高。目前,有关花斑副沙鳅的研究主要集中在基础生物学特征、年龄与生长、繁殖生态、胚胎发育、肌肉营养、仔鱼摄食生态等[1-6],而有关其性腺发育的研究未见报道。本文通过研究汤旺河花斑副沙鳅繁殖季节性腺发育,以期为丰富其繁殖生物学内容、人工繁育规模化及资源保护利用等提供基础。
1 材料与方法
1.1 区域概况
汤旺河为松花江北岸典型的山溪冷水性第一大支流,是大麻哈鱼Oncorhynchus keta、乌苏里白鲑Coregonus ussuriensis等名贵冷水鱼的产卵场和育肥场。本次调查采样地点为汤旺河下游(46° 40'51.197"~46°42'17.716"N,129°54'7.33"~129°55' 17.69"E),地处亚寒带大陆性季风气候区,春秋两季时间较短,夏季湿热多雨,冬季严寒而漫长。汤旺河下游沿岸水草风貌,河床底质为砂石、石砾,水质清澈,水深2~4m,适宜鱼类生长繁育。
1.2 材料
2013年6~8月,每月走访渔民2~3次,跟船调查,用小目单层刺网捕捞采样,并记录采样时水温变化。共采集花斑副沙鳅样本364尾,其中雄性196尾,雌性168尾,雌雄比例为0.86∶1。新鲜状态下测定其体长、体质量,解剖观察性腺,称量性腺质量及净体质量,分别截取性腺前、中、后三部分在Bouin’s液中固定24h后,保存于70%酒精中。
成熟系数(GSI)=(性腺质量/净体质量)×100%
1.3 组织学观察
性腺组织用乙醇(80%开始)梯度脱水,二甲苯透明,常规石蜡包埋与切片,切片厚度6μm,苏木精-伊红(H.E)染色,中性树胶封片。用Carl Zeiss显微镜观察,SZSS2000系统拍照。
2 结果与分析
2.1 花斑副沙鳅繁殖季节的成熟系数与水温变化
2013年6~8月,汤旺河下游水温为12~23℃,平均水温为19.6℃,6月中旬水温升至17℃,7月中上旬水温最高,为23℃,其后水温逐渐下降。经解剖测量,雄性群体体长为11.2~13.9cm,体质量为17.25~30.69g;雌性群体体长为10.9~17.2cm,体质量为16.69~42.91g。汤旺河花斑副沙鳅雄性群体性成熟系数为0.19%~1.686%,其中6月份性成熟系数最高,平均为(1.26±0.28)%;7月次之,平均为(1.06±0.32)%;8月最低,平均值仅为(0.73±0.09)%。雌性群体成熟系数较高,为2.09%~35.7%,其中6月成熟系数最高,平均值为(27.6±3.14)%;7月性成熟系数平均值为(7.16±0.79)%;8月最低,成熟系数平均值为(2.93±0.58)%。整体来讲,6~8月份汤旺河花斑副沙鳅性成熟系数随着月份的推移逐渐降低(表1)。
2.2 花斑副沙鳅精巢发育特点
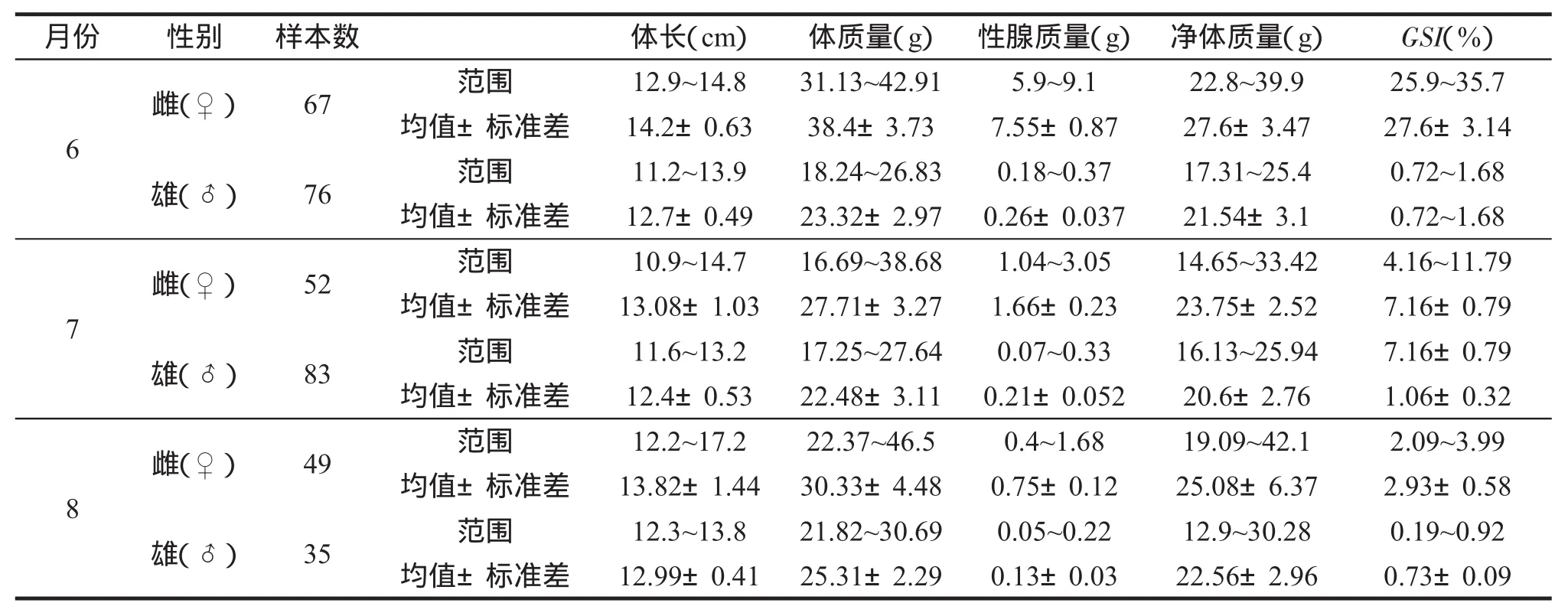
表1 汤旺河花斑副沙鳅繁殖季节的生物学指标Tab.1 Biological indices of barred loach Parabotia fasciata during spawning season
花斑副沙鳅的精巢成对,位于腹腔两侧,繁殖季节呈乳白色,表面比较光滑,被丰富的血管网络所覆盖,单个精巢呈管状,中间较粗,两端稍细,两条输精管在泄殖孔处合为一。精母细胞发育分期参考Schulz R W&Miura T对精子发生过程的分期方法[7]。
繁殖季节,汤旺河花斑副沙鳅精巢处于精子形成阶段,尚未变态为成熟精子的精细胞聚集在精小囊内,精细胞的核径很小,着色很深,呈深蓝色。随着生殖季节的到来,相邻的精小囊之间相互融合为一个个较大的囊腔,囊腔内的精细胞逐渐进入生精小管的管腔内,变态为成熟的精子。成熟的精子头部染色最深,为深蓝色,头部直径约为4.13~4.58μm(图版Ⅰ-1),在管腔内呈涡旋状排列。精子和精细胞的区别在于:精子在管腔中,而精细胞在囊腔中,待外界环境条件适合,成熟的精子便通过输精管排至体外。
繁殖季节,花斑副沙鳅精巢内精子排至体外之后,精巢组织染成粉红色,显得疏松,逐渐缩小,横切面内部充满网状的结缔组织(图版Ⅰ-2)。此外,还能观察到精原细胞游离于囊腔内,其胞径19.83~23.66μm,核径4.48~5.12μm,核居中或偏于一侧,着色较深,核膜清晰,胞质着色差(图版Ⅰ-3)。精巢内尚有少量未排尽的精细胞,此后逐渐被精巢吸收。
2.3 花斑副沙鳅卵巢发育特点
花斑副沙鳅卵巢不成对,为一个扁平的卵囊。繁殖季节卵巢呈长而稍扁平圆柱形的囊状器官,由1根输卵管通往泄殖孔。卵巢黄绿色,表面覆以被膜,被膜内侧有粗的红褐色主血管,主血管多分支,整个卵巢被网状的血管网络包裹。其中卵母细胞的发育分期参考龚启祥等[8]对香鱼Plecoglossus altivelis卵母细胞的发育分期方法。
组织切片显示,繁殖季节花斑副沙鳅的卵巢由第Ⅰ、Ⅱ、Ⅲ(早期)、Ⅴ和Ⅵ5个时相卵母细胞构成。第Ⅰ、Ⅱ、Ⅲ(早期)时相卵母细胞主要存在于产后恢复期的卵巢内,其中第Ⅰ时相卵母细胞主要位于生殖上皮边缘,排列比较紧密,呈椭圆形或不规则多边形,胞径23.65~42.73μm,核径10.41~15.86μm,细胞核较大,约占细胞体积的1/2~2/3,细胞质含量较少且分布密集,嗜碱性强,被染成深蓝色(图版Ⅰ-4)。第Ⅱ时相卵母细胞呈圆形或不规则的多边形,原生质体增加,细胞体积显著增大,胞质颗粒排列相对疏松,嗜碱性变弱,着色浅,细胞核呈圆形,核膜边缘可以看到若干着色较深的核仁。该时相卵母细胞的胞径为38.73~204.89μm,核径为14.96~90.68μm。第Ⅱ时相末期可以看到细胞边缘出现一层薄薄的滤泡细胞层(图版Ⅰ-5)。第Ⅲ时相早期卵母细胞最显著的特点是:在胞质外缘出现几层小的皮质液泡,随着卵母细胞的发育,皮质液泡层数逐渐增多,晚期可延伸至核膜边缘,该时相早期卵母细胞的胞径为189.32~285.77μm,核径为73.25~119.23μm(图版Ⅰ-6)。第Ⅴ相卵母细胞为成熟的卵子,主要存在于卵巢中。该阶段卵巢体积最大,充满成熟的卵子,轻压鱼腹便有成熟的卵粒流出。花斑副沙鳅成熟的卵母细胞内充满粉红色的卵黄颗粒,位于卵黄质膜外层的放射带亦清晰可见(图版Ⅰ-7)。成熟卵母细胞的胞径为628.9~893.6μm之间,放射带厚度为13.69~20.486μm(图版Ⅰ-8)。第Ⅵ时相卵母细胞存在于产卵后的卵巢中,为未排出的卵母细胞。该时相卵母细胞逐渐退化、被吸收,卵膜模糊而断裂,细胞外的滤泡细胞(颗粒细胞)分生出大量吞噬细胞,进入卵母细胞内吞噬卵黄,卵细胞质和卵黄胶液化,形成许多空泡,直至整个卵母细胞逐渐被周围细胞完全吸收(图版Ⅰ-9)。
3 讨论
3.1 花斑副沙鳅精巢特点
目前,国内外有关硬骨鱼类精巢结构特点的研究很多[9-12],但是未见有关花斑副沙鳅的报道。一般来讲,硬骨鱼类的精巢结构分为2种类型[7,13]:小叶型(lobular type),很多鱼类都属此类型,如乌苏里白鲑Coregonus ussurinsis[11]、黄颡鱼Pelteobagrus fluvidraco[14]、大弹涂鱼Boleophthalmus pectinirostris[15]、大泷六线鱼Hexagrammos otakii[16];小管型(tubular type),仅出现于银汉鱼目的某些种类,如体内受精的宽帆鳉Poecilia latipinna。花斑副沙鳅的精巢属于典型的小叶型结构,精巢中间具有空腔,囊状的空腔中充满了精细胞,待到繁殖季节,相邻的精小囊融合为大的囊腔,囊腔内的精细胞逐渐进入生精小管的管腔内,变态为成熟的精子,时机成熟则通过输精管将精子排至体外。小管型精巢的初级精原细胞只在小管的盲端分布,形成小囊,随着精子的发生和精子形成的过程,小囊逐渐向中央腔移动,中央腔与输精管相通,靠近中央腔的小囊破裂而把成熟的精子释放到中央腔内[11,16]。
3.2 花斑副沙鳅卵巢与皮质液泡发生特点
通常,硬骨鱼类具有成对的卵巢,而花斑副沙鳅却只有一个卵巢,与同科的长薄鳅Leptobotia elongata[17]一致,体现了鳅科鱼类的物种特异性,也是其在长期进化过程中形成的一种生殖策略。
鱼类卵母细胞的发育过程中出现3种不同类型的营养物质,即皮质液泡、蛋白卵黄颗粒和脂质卵黄滴[18],在不同鱼类中营养物质出现的时间和顺序有一定的差异。本研究结果表明:花斑副沙鳅的皮质液泡最早出现在第Ⅲ时相早期的质膜边缘,随后数量不断增多,最后充满整个核膜外周空间。这一研究结果与葛氏鲈塘鱧Perccottus glenii[19]、犬首鮈Siberian gudgeon[20]等一致。成熟鱼卵内充满卵黄颗粒,皮质液泡消失,说明在花斑副沙鳅受精卵孵化及胚胎发育过程中主要由卵黄颗粒提供营养物质。
3.3 花斑副沙鳅的繁殖期
鱼类的繁殖季节和持续的时间是鱼类种群长期进化过程中形成的繁殖策略,保证仔鱼在饵料规格和丰度适宜的时候孵出,使后代存活数量趋于最大。研究表明:温度和昼夜长短是影响鱼类繁殖期的关键环境因子[21,22]。辽宁省本溪市太子河中花斑副沙鳅的繁殖高峰期在7月份[1];湖北孝感市澴河中花斑副沙鳅的繁殖高峰期在7月中旬~8月中旬,其中水温达到25~32℃为繁殖盛期[4]。依据成熟系数及采捕看,汤旺河花斑副沙鳅的繁殖高峰期为6月中旬~7月上旬,该时期水温为19~23℃。汤旺河夏季水量充沛、水质清澈、光照充足,适宜花斑副沙鳅产卵繁殖及后代的生长发育。研究推断,我国境内花斑副沙鳅的繁殖期集中在6~8月份,而不同地理种群之间存在一定差异,繁殖盛期受水温、纬度影响较大,随着纬度的升高,其繁殖盛期逐渐提前。
3.4 花斑副沙鳅的产卵类型
研究表明:鱼类产卵类型主要以卵巢外观特征及产卵前后卵巢中卵母细胞的组成和消长来鉴定[23,24]。鱼类卵巢中卵母细胞的发育可分为三种类型:完全同步型、分批非同步型、不同步型[25],而产卵类型可分为一次产卵型和分批产卵型[26]。从切片上看,花斑副沙鳅成熟期的卵巢内以第Ⅴ时相卵母细胞为主,卵巢边缘处有少部分第Ⅱ、Ⅲ时相卵母细胞。产后的卵巢切片中,除部分处于退化吸收的卵母细胞外,大部分为第Ⅱ时相卵母细胞以及少数第Ⅰ时相卵母细胞,并没有第Ⅳ时相卵母细胞,故推断花斑副沙鳅卵巢没有多次产卵的组织学结构。另参照6~8月花斑副沙鳅成熟系数,其卵巢成熟系数逐月降低,且幅度较大,不具备在一个繁殖季节内再次迅速发育成熟的条件,这与黄颡鱼[14]、大弹涂鱼[15]、葛氏鲈塘鳢[19]的研究结果一致。综上所述,推测花斑副沙鳅为一次产卵型的鱼类。
[1]解玉浩.东北地区淡水鱼类[M].沈阳:辽宁科学技术出版社,2007:251-252.
[2]杨明生,肖汉兵,曾令兵,等.温度对花斑副沙鳅仔鱼发育、摄食及不可逆点的影响[J].动物学杂志,2012,47(4): 114-120.
[3]伍远安,梁志强,袁希平,等.花斑副沙鳅肌肉营养成分分析与评价[J].淡水渔业,2011,41(1):87-91.
[4]杨明生,李建华,黄孝湘.澴河花斑副沙鳅的繁殖生态学研究[J].水利渔业,2007,27(5):84-85.
[5]杨明生.花斑副沙鳅的胚胎发育观察[J].淡水渔业,2004, 34(6):34-36.
[6]杨明生.花斑副沙鳅的年龄和生长特征[J].孝感学院学报,2009,29(6):17-19.
[7]SchulzR Wand Miura T.Spermatogenesis and its endocrine regulation[J].Fish Physiol Biochem,2002,26(1):43-56.
[8]龚启祥,曹克驹,曾嶒.香鱼卵巢发育的组织学研究[J].水产学报,1982,6(3):221-234.
[9]张耀光,罗泉苼,钟明超.长吻鮠精巢发育的分期及精子的发生和形成[J].动物学研究,1992,13(3):281-287.
[10]徐长安,李军,张士璀.激素诱导欧氏六线鱼性腺发育的初步研究[J].海洋科学,1998(3):4-5.
[11]李培伦,刘伟,王继隆.乌苏里白鲑洄游群体性腺发育组织学观察[J].生物学杂志,2015,32(1):34-38.
[12]Santos R N,Andrade C C,Santos L N,et al.Testicular maturation ofOligosarcus hepsetus(Cuvier)(Actinopterygii,Characidae)in a Brazilian tropical reservoir[J]. BrazJ Biol,2006,66(1A):143-150.
[13]Billard R.Spermatogenesis and spermatology of some teleostfishspecies[J].ReprodNutrDevelop,1986,26(4): 877-920.
[14]陈伟兴,范兆廷,杨洁.黄颡鱼性腺的组织学观察[J].东北农业大学学报,2006,37(2):194-198.
[15]曹伏君,罗杰,刘楚吾.大弹涂鱼性腺发育的组织学观察[J].水生生物学报,2010,34(2):418-425.
[16]温海深,王连顺,牟幸江,等.大泷六线鱼精巢发育的周年变化研究[J].中国海洋大学学报:自然科学版,2007, 37(4):581-585.
[17]赵云芳.长薄鳅生物学特性的初步观察[J].四川动物, 1995,14(3):122.
[18]Mayer I,Shackley S E and Ryland J S.Aspects of the reproductive biology of the bass,Dicentrarchus labrax L. I.an histological and histochemical study of oocyte development[J].Journal of Fish Biology,1988,33(4):609-622.
[19]李培伦,刘伟,王继隆,等.葛氏鲈塘鱧卵子发生的组织学观察[J].水产学杂志,2013,26(6):26-30.
[20]李培伦,刘伟,王继隆.犬首鮈卵子发生过程及成熟卵膜形态结构观察[J].动物学杂志,2014,49(5):707-715.
[21]WoottonRJ.EcologyofTeleostFishes[M].NewYork:Chapman and Hall,1990.
[22]Lam T J.Environmental influences on gonadal activity in fish[G]//Hoar,WS,etal.,editors.Fishphysiology.Vol.LXB, Lodon:Academic Press,1983:65-166.
[23]施琮芳,尹伊伟,胡传林,等.鲢鱼性腺周年变化的研究[J].水生生物学集刊,1964,5(1):77-94.
[24]吴佩秋.小黄鱼不同产卵类型卵巢成熟期的组织学观察[J].水产学报,1981,5(2):161-171.
[25]Wallace A R and Selman K.Cellular and dynamic aspects of oocyte growth in teleosts[J].American Zoologist,1981, 21(2):325-343.
[26]刘筠.中国养殖鱼类繁殖生理学[M].北京:农业出版社,1993:20-73.
Histological Observation of Gonadal Development of Barred Loach Parabotia fasciata in Tangwang River During Breeding Season
LI Pei-lun,LIU Wei,WANG Ji-long
(Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China)
The gonadal developmental of barred loach Parabotia fasciata was studied in Tangwang River during breeding season by a conventional histological method.The results showed that the maximal gonado-somatic index(GSI)was observed in June,with average GSI of(1.26±0.28)%in male population in June,and average GSI of(27.6±3.14)%in female population in June.The peak spawning period of the gonad was speculated to be changed from the middle June to early July,based on the fact that the GSI was declined from June to August.The male populations had testis with developmental spermiogenesis in which the leydig cells were broken into spermatid turning into the sperm.The pink staining testis was full of reticular connective tissue,and the free spermatogonial cells were distributed in intra-testicular cavity,showing typical lobular type testicular structure after spermiation.The barred loach has only singe ovary in one side of abdominal cavity,and in the ovary sections,the phasesⅠ,Ⅱ,Ⅲ(early period),Ⅴand phaseⅥ,were observed in breeding season and oocyte development in phaseⅠ,Ⅱ,Ⅲ (early period)and phaseⅥoocyte in the ovary after spawning, the phaseⅤoocytes in the matured ovary.The barred loach had mature eggs with diameter ranging from 628.9~893.6 μm,and the zona radiate with thickness of 13.69~20.486 μm.According to the ovary development and gonado-somatic index,it turns out that the barred loach spawns once a year.
Tangwang River;Parabotia fasciata;testis;ovary
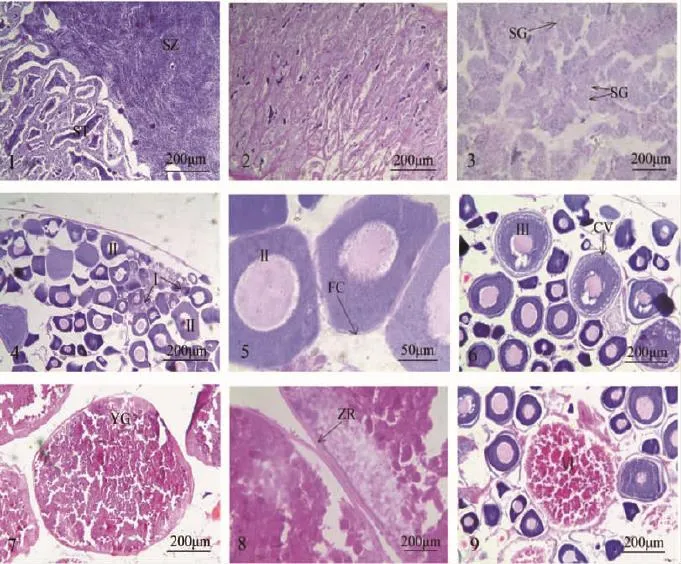
图版Ⅰ 繁殖季节汤旺河花斑副沙鳅性腺发育的组织学观察PlateⅠ Observation of gonadal development in barred loach Parabotia fasciata in Tangwang River in spawning season
S954.4
A
1005-3832(2016)03-0039-05
2016-03-08
农业部财政专项物种资源保护项目(2014-2018);公益性行业(农业)科研专项(201303056-5).
李培伦(1989-),男,研究实习员,从事鱼类生理生态研究.E-mail:lpl19890925@163.com
刘伟(1960-),研究员.E-mail:liuwei_1020@aliyun.com
