荧光光谱法研究柯里拉京与人血清白蛋白之间的相互作用
2016-02-07申炳俊苗苗刘慧李萍周锦秀曹宇宁金丽虹田坚
申炳俊,苗苗,刘慧,李萍,周锦秀,曹宇宁,金丽虹,田坚
(1.长春理工大学清洁能源技术研究所,长春 130022;2.长春理工大学生命科学技术学院,长春 130022)
荧光光谱法研究柯里拉京与人血清白蛋白之间的相互作用
申炳俊1,苗苗2,刘慧2,李萍2,周锦秀2,曹宇宁2,金丽虹2,田坚1
(1.长春理工大学清洁能源技术研究所,长春 130022;2.长春理工大学生命科学技术学院,长春 130022)
在模拟人体血液pH条件(pH 7.4,离子强度0.1mol/L),通过荧光猝灭、位点竞争、同步荧光和三维荧光光谱等方法研究了柯里拉京(Cor)与人血清白蛋白(HSA)之间相互作用机制。结果表明:HSA的荧光能被Cor静态猝灭,两者间结合常数为2.79×103(298K)、2.22×104(304K)和8.41×104L/mol(310K)。根据Van’t Hoff方程结果显示,Cor与HSA间的作用主要为疏水作用,其作用过程为自发、吸热。基于Förster能量转移,得知Cor与HSA间结合距离为9.33 nm。位点竞争实验指出,Cor优先结合HSA的位点III。三维荧光光谱和同步荧光光谱显示,与Cor作用对HSA构象影响不显著。
柯里拉京;人血清白蛋白;荧光光谱;标记竞争
人血清白蛋白(Human serum albumin,HSA)是一种单体多结构域生物大分子,在人体血浆中含量丰富。HSA的表面包含多个亲脂性的结合位点,具有存储和转运内源性代谢物及外源性疏水物质作用,是生物活性物质发挥生物效应的重要载体和靶向分子。药物进入体内一般无法直接作用于病灶部分,通常先与HSA可逆结合成复合物,然后再被运输到机体的各个部位进行释放[1]。由于药物与HSA的亲和性大小直接影响血液中药物浓度的高低、有效作用时间,进而影响它们在体内的吸收、分布、代谢、排泄和毒性等过程。因此,研究HSA与中药活性成分的相互作用,对于探讨药物小分子在人体内的运输与代谢过程,对药物分子化学结构改造等方面有重要的理论和实际意义。为此,国内外研究人员对中药活性成分与HSA相互作用进行了大量研究,所涉及中药活性成分种类繁多,如黄酮类[2]、生物碱类[3]、多酚类[4]、酚酸类[5]及醌类[6]等。
柯里拉京(corilagin,Cor)化学名称为1-酰-3,6-六羟基联苯二甲酰基葡萄糖,是一种天然的多酚单宁酸类化合物。Cor主要存在于叶下珠、老鹳草等植物中。药理学试验证明,Cor不仅具有抗氧化、抗动脉粥样硬化、抗纤溶、降低血压、抑制病毒、抗菌及抗炎等药理活性,还对多种肿瘤细胞有抑制作用[7-9],具有潜在的药用价值。
目前,已有多种方法用于研究小分子与蛋白质的结合作用,包括动态法和静态法,前者主要有平衡透析法[10]、亲和毛细管电泳[11]和亲和色谱法[12],后者主要有光谱法[5,11]、核磁共振[13]等手段。其中,光谱法尤其是荧光光谱法在小分子与蛋白质之间相互作用研究中应用广泛,该方法可以获得结合常数、结合位点数等分子间分子作用信息,具有操作简单、分析速度快、灵敏度高和选择性好等优点。本文模拟了生理条件(pH 7.4,离子强度0.1mol/L),利用荧光猝灭法结合位点竞争实验对Cor与HSA间相互作用的机制进行了研究,同时利用同步荧光和三维荧光技术探讨了其构效关系。所获得结果为阐明药物分子在体内的运输及药理作用提供可靠实验数据及理论依据。
1 实验
1.1 试剂和仪器
人血清白蛋白(HSA)购自美国Sigma公司,柯里拉京(Cor)购自成都普菲德生物技术有限公司,华法林(warfarin)购自南通飞宇生物科技有限,布洛芬(ibuprofen)、洋地黄毒苷(digitoxin)均购自德国Dr. Ehrenstorfer公司。Tris-HCl缓冲液(0.05mol/L,pH=7.4,含0.1mol/L NaCl)。准确称取适量Cor、华法林、布洛芬和洋地黄毒苷对照品溶于无水乙醇中,配制成1.00×10-4mol/L的储备液。用Tris-HCl缓冲液将HSA配成浓度为1.00×10-4mol/L的储备液。上述储备液均置于4℃下避光保存。实验用水为二次去离子水,其他试剂均为分析纯。
荧光光谱利用天津港东公司的F-280型荧光分光光度计测得,吸收光谱利用日本岛津公司的UV-2550型紫外-可见分光光度计测得。荧光值用“内滤光效应”公式[14]进行校正:
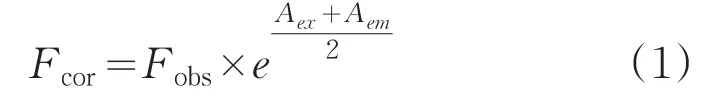
式中,Fcor和Fobs分别为Cor-HSA体系校正后和测到的荧光强度;Aex和Aem为Cor在激发和发射波长处吸光度值。
1.2 实验过程
1.2.1 荧光发射光谱测定
在一系列7mL比色管中,依次加入40μL HSA储备液和适量Cor储备液,用Tris-HCl缓冲液定容至4mL,获得HSA∶Cor(浓度比)分别为1∶0,1∶1,1∶2,1∶3,1∶4,1∶5,1∶6和1∶7的混合体系;于298、304或310K静置30min。在激发波长为280nm,激发、发射狭缝宽度分别为10nm和5nm条件下,扫描290~410nm范围内荧光发射光谱。
1.2.2 同步荧光光谱测定
溶液配制同上,在相同条件下分别扫描285~335nm(Δλ=15nm)及310~380nm(Δλ=60nm)范围内同步荧光光谱。
1.2.3 三维荧光光谱测定
配制HSA∶Cor(浓度比)为1∶0和1∶4的混合体系,在298K条件下静置30min,方法同上。设定激发波长范围为200~330nm,发射波长范围为250~500nm,激发和发射间隔均为5nm,扫描三维荧光光谱。
1.2.4 位点竞争实验
固定HSA和位点探针(保泰松/布洛芬/洋地黄毒苷)的浓度均为1.0×10-6mol/L,充分混合后,在298K条件静置30min;向位点探针-HSA体系中加入适量Cor储备液,混合均匀,继续在298K条件下作用30min,扫描荧光发射光谱,参数同前。
1.2.5 紫外吸收光谱
准确量取适量Cor储备液加入比色管中,用0.05mol/L Tris-HCl缓冲液定容,获得1.0×10-6mol/L Cor溶液,扫描290~410nm范围内的紫外吸收光谱。
2 结果与讨论
2.1 Cor对HSA的荧光猝灭作用及机理
通过相互作用(如形成复合物,碰撞猝灭,能量转移,激发态反应和分子重排等)使荧光物质荧光强度下降的现象,都称为荧光猝灭作用。文中激发波长为280nm时,HSA在343nm处具有内源荧光(曲线1),而在此条件下Cor自身无荧光发射(曲线9)。图1为不同浓度Cor对HSA的荧光猝灭光谱。可以看出,HSA的内源性荧光强度可以被Cor猝灭,且猝灭效应随Cor浓度的增大而增强(曲线1~8),其荧光峰形变化不大,但最大发射波长发生了微弱的红移(1.5nm)。说明Cor与HSA间发生了一定程度的相互作用,两者间可能形成复合物。
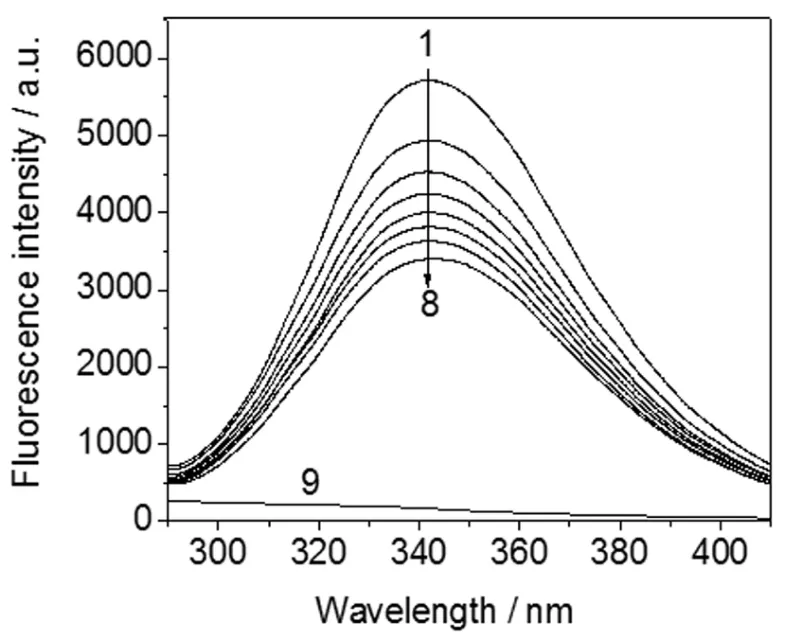
图1 Cor-HSA体系的荧光发射光谱
在严格控制pH值和温度的条件下,能引起HSA荧光猝灭的机制主要包括动态猝灭、静态猝灭和非辐射共振能量转移。其中,静态猝灭是猝灭剂与荧光分子在基态时形成了不发荧光的复合物而引起的猝灭,而动态猝灭是猝灭剂与激发态的荧光分子之间发生相互碰撞导致的荧光猝灭。无论静态猝灭还是动态猝灭都遵循Stern-Volmer方程[5]:
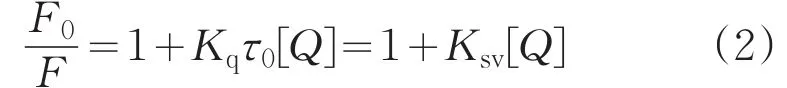
式中,F0和F分别为无、有Cor时HSA的荧光强度;Kq为速率常数;τ0为生物大分子的平均荧光寿命(约为10-8s);Ksv为Stern-Volmer猝灭常数,[Q]为Cor的平衡浓度。Cor-HSA体系的Stern-Volmer曲线见图2,可以看出,随着Cor浓度的增加,F0/F逐渐增大,且二者间呈良好的线性关系。由拟合线性方程的斜率可以得到Cor对HSA的猝灭常数Ksv和Kq值,结果列于表1。通常,静态猝灭速率常数随着温度升高而减小,动态猝灭则与之相反[1,5]。由表1可知,Ksv随着温度的升高而减小,且Kq值均大于最大扩散碰撞猝灭常数2.0×1010L/(mol·s)[15],因此推断Cor对HSA的荧光猝灭属于静态猝灭。
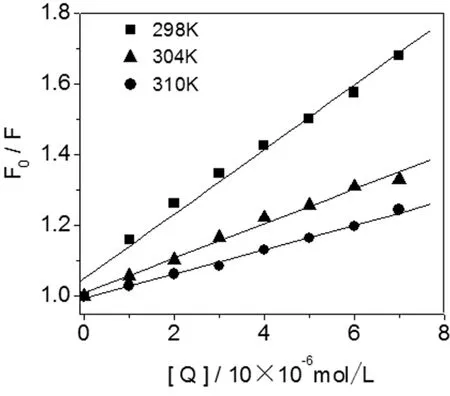
图2 不同温度下Cor-HSA的Stern-Volmer图
2.2 Cor与HSA的能量转移及结合距离
Förster能量转移理论可以解释药物分子与HSA之间的非辐射能量转移,同时可被用来确定氨基酸残基和药物分子的结合距离[16]。
供能体-受能体间能量转移的效率E、供能体-受能体之间的距离r和能量转移距离R0存在如下关系:
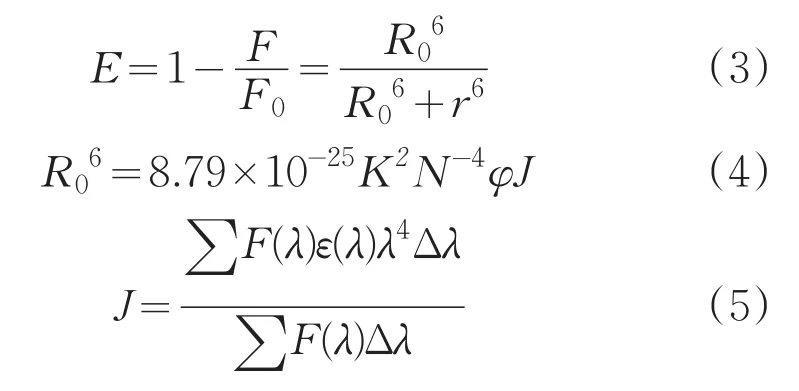
式中,R0是能量转移的效率为50%时的临界距离,K2是偶极的空间取向因子;N是介质的折射率;φ是HSA在无Cor存在时的荧光量子产率;J是HSA的荧光发射光谱和Cor紫外吸收光谱的重叠程度;F(λ)是HSA在波长λ处的荧光强度,ε(λ)是Cor在波长λ处的摩尔吸光系数。
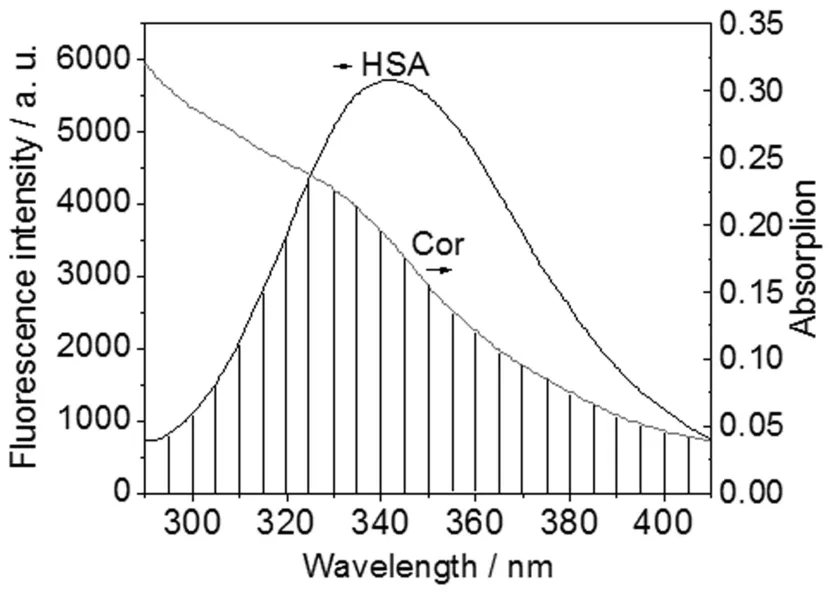
图3 HSA的荧光发射光谱和Cor紫外吸收光谱的重叠图
图3为HSA的荧光发射谱和Cor的紫外吸收光谱的重叠图。用矩形分割法求得图3中光谱重叠部分的面积,即重叠积分J=5.37×10-1(2cm3·L)/mol。文中实验条件下,供体和受体各项随机分布的取向因子平均值K2=2/3,折射指数N取水和有机物平均值1.336,对于HSA的体系量子产率φ取0.118。根据公式(4)获得R0=6.99nm。由公式(3)依次求得E=0.15,r=9.33nm。由于r>R0,且r>7.0nm,说明HSA与Cor间没有发生非辐射能量转移。这进一步表明Cor通过静态猝灭方式导致HSA的荧光猝灭。
2.3 Cor与HSA的结合常数及结合位点数
若荧光分子与猝灭剂间存在静态猝灭,那么可用Scatchard方法计算两者间结合常数(KA)及结合位点数(n)[17]:
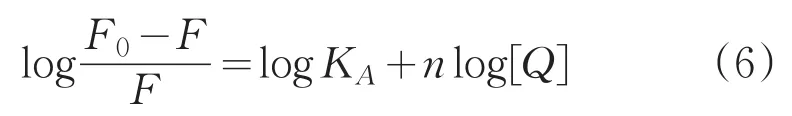
以logF0-F/F对log[Q]作图4,拟合获得方程、结合常数和结合位点数,结果见表1。由曲线良好的线性关系可以推测,HSA与Cor有一个独立的结合位点,这与计算所得到的结合位点数n≈1是一致的。Cor与HSA的结合常数KA的数量级在103和104,说明Cor与HSA间的结合能力较强。由此推断Cor能够较好地被HSA存储和运输。

表1 不同温度下Cor与HSA的猝灭常数Ksv、结合常数KA和结合位点数n
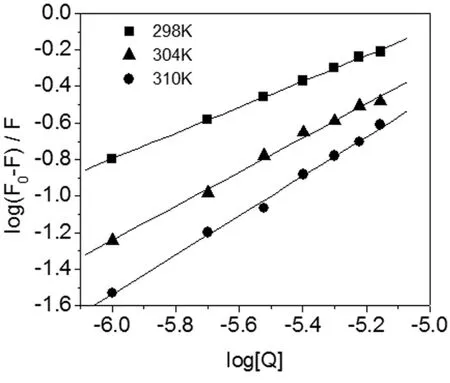
图4 不同温度下Cor-HSA的双对数方程曲线图
2.4 Cor与HSA的热力学参数和结合力的确定
小分子与生物大分子(如蛋白质、核酸)之间结合的相互作用力主要包括静电引力、氢键、范德华力和疏水作用力,两者结合的作用力类型可以通过反应的热力学参数焓变(ΔH)、熵变(ΔS)和自由能变化(ΔG)来判断。热力学参数可以根据Van’t Hoff定律计算[18]:
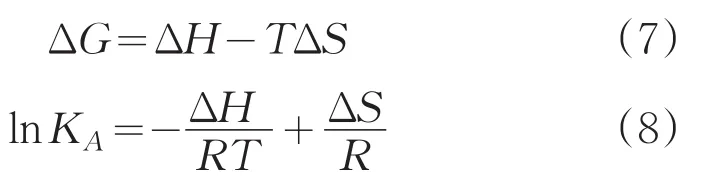
式中,KA是相应温度下的有效结合常数,R为气体常数(8.314(mol K)/J),T为绝对温度。当实验中温度变化不大时,反应的ΔH可近似为常数。以不同温度下的lnKA对1/T作图5,由线性方程的线斜率和截距可以求得Cor与HSA结合的ΔH和ΔS,进而可以得到不同温度下的ΔG,计算结果见表2。ΔG<0,说明Cor和HSA之间的反应过程是一个自由能降低的自发、吸热过程。而ΔH和ΔS均为正值,根据Ross和Subramanian[19]理论推断疏水作用力是Cor与HSA结合过程的主要驱动力。

表2 不同温度下Cor-HSA体系的热力学参数
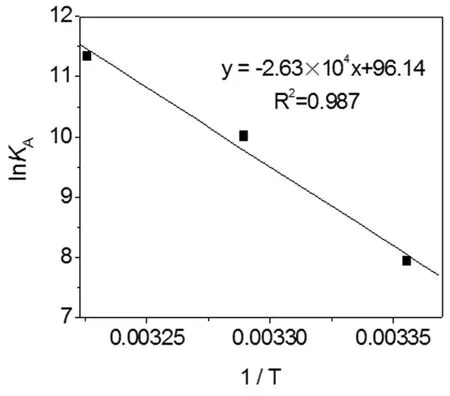
图5 不同温度Cor-HSA的Van't Hoff曲线图
2.5 Cor在HSA上结合部位的确定
晶体结构分析表明大多数小分子物质在HSA中主要结合部位是两个疏水性口袋Site I和Site II。研究发现,华法林结合于Site I,布洛芬结合于Site II,而洋地黄毒苷结合在血清白蛋白的第三个结合部位,即Site III[5]。以华法林、布洛芬和洋地黄毒苷分别作为HSA的Site I、Site II和Site III位点探针,通过位点竞争实验得到Cor在HSA上结合部位的信息。表3中列出了位点探针存在时Cor-HSA体系的表观结合常数K′A及结合常数的变化率φ (φ=(K′A-KA)/KA)。可以看出,与不存在标记探针的Cor-HSA体系相比,洋地黄毒苷的存在对于表观结合常数的影响最大。表明Cor在HSA的三个位点均有结合,且优先结合在HSA的洋地黄毒苷(Site III)处。
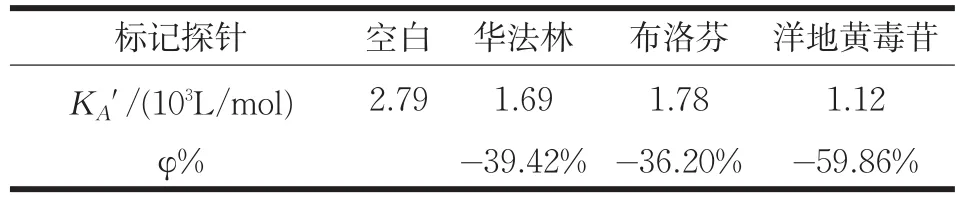
表3 位点标记试剂存在时Cor与HSA的结合常数K′A和结合常数的变化率φ(T=298K)
2.6 Cor对HSA构象的影响
2.6.1 同步荧光光谱
同步荧光光谱可用于研究蛋白氨基酸残基周围极性及蛋白质构象改变的信息。当Δλ=15nm时,可以得到酪氨酸残基周围微环境改变的信息;当Δλ=60nm时,所得到的同步荧光显示的是色氨酸残基周围微环境改变的信息[1,5]。固定HSA的浓度,逐渐增加Cor的浓度,扫描Δλ=15nm和60nm时的同步荧光光谱,如图6所示。

图6 Cor与HSA相互作用的同步荧光光谱
可见,Cor的加入使HSA的酪氨酸和色氨酸荧光强度均有减弱,其中酪氨酸残基的发射波长无变化,而色氨酸残基的发射波长略红移0.8nm,说明Cor与HSA的结合作用使色氨酸残基所处环境的疏水性有所降低。因此,Cor的加入对HSA构象有一定的影响,但不显著。此外,7.0×10-6mol/L Cor对HSA中酪氨酸荧光强度猝灭的程度(30.6%)大于色氨酸(24.9%),说明Cor在HSA上的结合部位更接近于酪氨酸残基。
2.6.2 三维荧光光谱
三维荧光光谱表现的是荧光强度随激发(λex)和发射(λem)波长同时变化的信息,是另外一种证实HSA构象和微环境是否改变的方法[1,20]。图7显示了HSA和Cor-HSA复合物的三维荧光光谱。可见,HSA具有2个典型的荧光峰1和峰2。其中,峰1(λex/λem=280/345nm,F=1355.3)主要反映了蛋白质中色氨酸残基和酪氨酸残基的光谱特性,而峰2(λex/λem=230/345nm,F=174.3)是由蛋白质多肽链C=O骨架结构n→π*电子跃迁引起的,反映了蛋白质二级结构的变化情况。与Cor作用后,HSA的荧光峰1(λex/λem=280/346nm,F=1045.3)和峰2(λex/λem=230/346nm,F=130.9)的荧光发射峰均略红移1nm,且荧光强度都呈现明显下降,其中峰1降低22.8%,峰2降低24.9%。说明Cor的加入对HSA生色团(主要是色氨酸和酪氨酸)微环境及其二级结构有一定的影响,这与同步荧光光谱的结论是一致的。
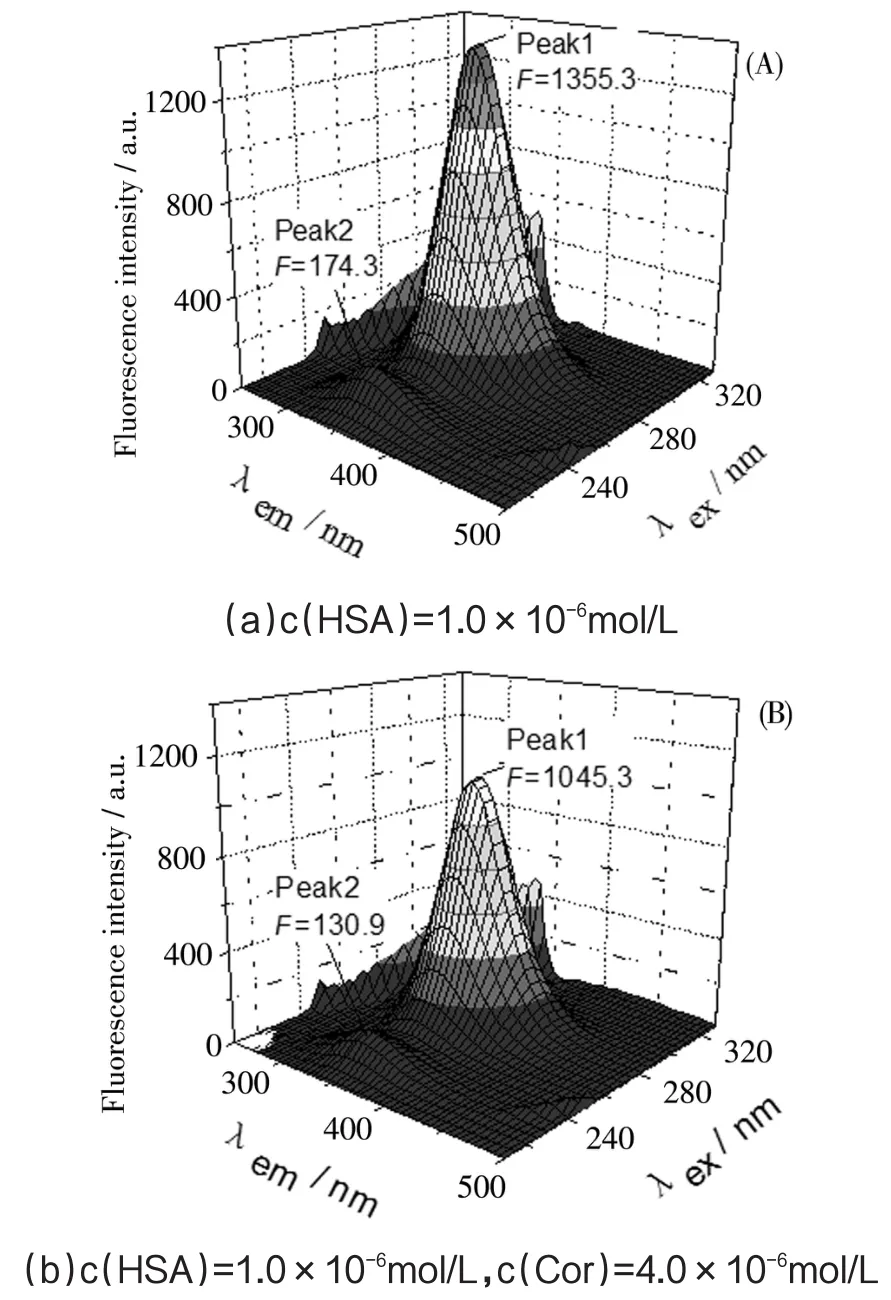
图7 Cor与HSA相互作用的三维荧光光谱
3 结论
在模拟人体血液pH值条件下,采用荧光猝灭法、位点竞争实验、同步荧光和三维荧光光谱对Cor与HSA的相互作用进行了研究,获得了Cor-HSA体系的猝灭机制、结合常数、结合位点数、结合距离、结合位置、作用力类型和构象变化等相关信息。结果表明,Cor可引起HSA内源荧光产生静态猝灭,两者间形成1∶1复合物,其结合作用较强。Cor主要与HSA的位点III结合,其结合距离为9.33nm,疏水作用对两者间的相互作用起着重要作用。另外,Cor的加入对HSA构象影响不显著。因此,HSA可以作为Cor的有效载体,HSA在贮存和转运Cor的过程中只微弱改变色氨酸所处的微环境,Cor对HSA没有毒害作用。
[1]吴雨,韩忠保,马嘉泽,等.同步荧光光谱法结合分子对接研究金雀花碱与牛血清白蛋白间相互作用[J].光谱学与光谱分析,2016,36(3):765-769.
[2]Tang J H,Lian N,He X H,et al.Investigation of the interaction between sophoricoside and human serum albumin by optical spectroscopy and molecular modeling methods[J].J Mol Struct,2008,889(1):408-414.
[3]何文英,姚小军,陈光英.胡椒碱分子键合人血清白蛋白位点的表征[J].中国生物化学与分子生物学报,2010,26(3):268-274.
[4]吴秋华,周欣,臧晓欢,等.白藜芦醇与人血清白蛋白相互作用的光谱研究[J].光谱学与光谱分析,2009,29(1):226-230.
[5]申炳俊,金丽虹,张佳佳,等.对-香豆酸与人血清白蛋白相互作用的荧光和表面增强拉曼光谱研究[J].发光学报,2016,37(10):1159-1165.
[6]Li Y,Yao X,Jin J,et al.Interaction of rhein with human serum albumin investigation by optical spectroscopic technique and modeling studies[J].Biochim Biophys Acta,2007,1774(1):51-58.
[7]Adesina S K,Idwu O,Ogundaini A O,et al.Antimicroboal constituents of the leaves of acalypha wilke aadalypha hiapida[J].Phytother Res,2000,14(5):371-374.
[8]Olson J K,Miller S D.Microglia initiate central nervoussysteminnateandadaptiveimmuneresponses through multiple TLRs[J].Journal of Immunology,2004,173(6):3916-3924.
[9]陈一燕,陈崇宏.柯里拉京药理活性研究进展[J].中国现代应用药学,2010,27(5):390-394.
[10]Villamor J P,Zaton A M L.Data plotting of warfarin binding to human serum albumin[J].Journal of Biochemical and Biophysical Methods,2001,48(1):33-41.
[11]张黎伟,张新祥.亲和毛细管电泳法和荧光法研究氟喹诺酮类药物与牛血清白蛋白的相互作用[J].高等学校化学学报,2008,29(4):694-699.
[12]蔡晓明,张岩,予龙,等.高效亲和色谱法测定2种中药成分与人血清白蛋白的结合率[J].色谱,2011,29(4):358-361.
[13]Zhou Y L,Y LI Z.Studies of the interaction betweenpoly(diallyldimethylammoniumchloride)and DNA by spectroscopic methods[J].Colloids and Surfaces A,2004,233(1-3):129-135.
[14]Wang Q,He J W,Duan Y K,et al.Spectroscopy and docking simulations of the interaction between lochnericine and bovine serum albumin[J].Luminescence,2015,30(2):240-246.
[15]Lakowicz J R,Weber G.Quenching of fluorescence by oxygen:a probe for structural fluctuations in macromolecules[J].Biochemistry,1973,12(21):4161-4170.
[16]Yue Y Y,Chen X G,Qin J,et al.A study of the binding of CI Direct Yellow 9 to human serum albuminusingopticalspectroscopyandmolecular modeling[J].DyesandPigments,2008,79(2):176-182.
[17]张勇,张贵珠,王月梅,等.光谱法研究丝裂霉素、血清白蛋白以及金属离子间的相互作用[J].分析科学学报,2000,16(6):445-449.
[18]Huang S,Qiu H N,Lu S Y,et al.Study on the molecularinteractionofgraphenequantumdots with human serum albumin:Combined spectroscopicandelectrochemicalapproaches[J].Journalof Hazardous Materials,2014,285C(S2-3):18-26.
[19]Ross P D,Subramanian S.Thermodynamic of proein association reactions:forces contributing to stability[J].Biochemistry,1981,20(11):3096-3102.
[20]黄英,王娟,郭改英,等.光谱法研究硫鸟嘌呤与七元瓜环及牛血清白蛋白的超分子相互作用[J].高等学校化学学报,2013,34(2):375-380.
Study on Interaction of Corilagin and HSA by Fluorescence Spectroscopies
SHEN Bingjun1,MIAO Miao2,LIU Hui2,LI Ping2,ZHOU Jinxiu2,CAO Yuning2,JIN Lihong2,TIAN Jian1
(1.Laboratory of Clean Energy Technology,Changchun University of Science and Technology,Changchun 130022;2.School of Life Science and Technology,Changchun University of Science and Technology,Changchun 130022)
Under the simulative physiological conditions(pH=7.4,ionic strength 0.1mol/L)the interaction between Corilagin(Cor)and human serum albumin(HSA)was investigated by fluorescence spectroscopy,competition experiment,synchronous fluorescence and 3D fluorescence.Results showed that the main quenching mechanism between Cor and HSA was a static quenching process.All the magnitude binding constants(KA)were 2.79×103(298K),2.22×104(304K)and 8.41×104L/mol(310K).According to Van't Hoff equation,the interaction between Cor and HSA was mainly hydrophobic interaction.The binding distances between Cor and HSA was 9.33nm based on Förster energy transformation.It was pointed out by marker competition experiments that the primary binding site for Cor was located at site III in the HSA.3D dimensional,synchronous and fluorescence spectrum showed that the conformation of HSA did not change apparently with the addition of Cor.
corilagin;human serum albumin;fluorescence spectrum;competition experiment
O657.3
A
1672-9870(2016)06-0075-06
2016-09-26
国家自然科学基金(21153003);吉林省教育厅(201574);长春理工大学博士后基金(2014年)
申炳俊(1977-),男,博士研究生,助理研究员,E-mail:bjshen@cust.edu.cn
田坚(1956-),男,教授,博士生导师,E-mail:tianjian@cust.edu.cn
