基于微流控芯片的环境卫生检验分析系统及装置
2016-02-07蒋西然章燕秦红梅于宁刘国杰覃开蓉王晓晰
蒋西然,章燕,秦红梅,于宁,刘国杰,覃开蓉,王晓晰
1.大连理工大学 生物医学工程系,辽宁大连 116024;2.辽宁省卫生计生委卫生计生监督局,辽宁 沈阳 110005;3.辽宁中医药大学 第一临床学院,辽宁 沈阳110032;4.中国医科大学 公共基础学院运动医学教研室,辽宁 沈阳 110122
基于微流控芯片的环境卫生检验分析系统及装置
蒋西然1,章燕2,秦红梅2,于宁3,刘国杰4,覃开蓉1,王晓晰4
1.大连理工大学 生物医学工程系,辽宁大连 116024;2.辽宁省卫生计生委卫生计生监督局,辽宁 沈阳 110005;3.辽宁中医药大学 第一临床学院,辽宁 沈阳110032;4.中国医科大学 公共基础学院运动医学教研室,辽宁 沈阳 110122
近年来,微流控芯片在环境及医学卫生检测分析领域发展迅速,已经开发出多种实用性较强的芯片系统和设备。这些芯片装置具有便携性强和消耗低的特点,在一些领域的实际应用中已经逐渐取代了常规技术方法。本文总结前人的研究成果,结合本实验室的经验,阐述微流控芯片系统的开发和设备构建的研究进展及应用前景。
微流控芯片;环境卫生检验;便携式设备;医疗设备
微流控芯片(Microfuidics,Lab on a Chip),也称为微电动机械系统(Micro Electromechanical System,MEMS)或微型全分析系统(Miniaturized Total Analysis Systems,uTAS),是以微型化、集成化和自动化为技术特点,交叉集成了生物医学、机械微加工和电子信息等多门学科技术,着眼于解决在极微小反应体系(微升、纳升或皮升)内进行的生物、化学等反应分析过程,从而实现在宏观实验条件下难以完成的科学任务[1]。微流控芯片技术自20世纪90年代初期诞生以来,已经经历了二十多年的发展历程,随着弹性聚二甲基硅氧烷材料(Polydimethylsiloxane,PDMS)的普及使用和加工工艺的日益成熟,芯片的制作成本已经降至较低水平,目前即使是在较为简陋的实验室条件下,也可以对较为精密的芯片结构(约数十至数百微米精度)进行加工制作[2]。在芯片内薄层PDMS微阀门和微泵的作用下,可以在芯片内部实现复杂的操控。通过整合其它微型电器元件如传感器探头、薄片电阻、温控薄膜和微型CCD等,能够开发出以微流控芯片为核心反应单元的小型化检验分析系统和设备[3]。目前,国内外已有多家企业在进行微流控芯片检验分析装置的开发,有一些已经走向市场进行实际应用,具有微型便携、低消耗低成本和自动化程度高的优势,取得了良好的应用效果。可以预见在不远的将来,这些基于微流控芯片的新一代生物医学检验分析装置有望取代现有的常规仪器设备,尤其在便携式检验分析和个性化医疗领域将发挥其巨大优势。本文结合本实验室的研究经验和成果,对几种微流控检验分析系统的原理及应用前景进行阐述和探讨。
1 PCR微流控芯片系统
聚合酶链式反应(Polymerase Chain Reaction,PCR)是一项常规体外核酸分子检验技术,最早于1986年由Mullis等[4]提出,具有操作简单、成本较低和特异性强的特点,在临床医学和环境监测中应用广泛。PCR技术含有三个反应步骤,即高温解链、低温退火和中温延伸。在耐高温聚合酶、引物和模板的共同作用下,能够在短时间内生成数十乃至数百万倍的核酸扩增。常规的PCR热循环扩增反应仪主要由精密温控开关和镀金金属孔板构成,在仪器内对金数孔板的温度进行精确操控,从而实现PCR扩增所需的三个不同温度循环。通常三温度带热循环的次数约为25~35个循环,反应耗时约2~3 h[5]。
基于微流控芯片的PCR技术最早于2002年由Fakhari等人提出,主要包括两种类型:静态型和流动型。静态型是在芯片内构建一个反应腔,将微缩后的PCR反应体系注入到腔内,再将芯片放置于加热模块上,周期性地进行升温、降温,从而实现PCR反应所需的热循环,常用半导体加热片、聚酰亚胺加热膜或氧化铟锡玻璃作为加热器[6]。流动型是指在芯片内构建一条或多条连通的微管道,将PCR反应液体注入管道并在管道内流动,依次分别流经高温和低温区,从而实现热循环[7]。图1为本实验室构建的一块流动型PCR扩增芯片,芯片以PDMS和玻璃为制材,管道宽度250 μm,灌注蓝色染料作为标识。该PCR芯片为一次性使用,可以实现25~30个循环扩增,总反应时间只需30~40 min。

图1 流动型PCR微流控芯片
由于静态型PCR芯片受限于反应腔室的固定体积,不利于根据需要增减反应体系的总量,因此近年针对流动式PCR芯片的研究较多。在流动型PCR芯片内,反应液是连续不断流动的,热传导效率更高,按照流动状态的不同又可分为循环流动型和连续流动型芯片。图2为连续流动型PCR芯片装置[8]。整套系统尺寸约10 cm×10 cm×5 cm,重量约300 g,可以由电池供电,适用于便携式临床检验或环境微生物的现场分析。
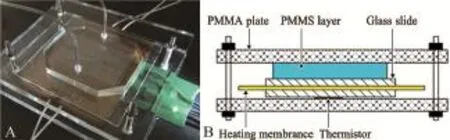
图2 一种连续流动型PCR芯片系统[8]
PCR微流控芯片系统的主要优势有:① 微流控芯片内的微通道尺寸通常在微米级别,具有比表面积大的特点(比常规的反应管的比表面积大10~20倍左右),热传导效率更高,芯片内升温和降温都较快,可大幅缩短反应分析所需的时间;② 微流控芯片内的反应体系可以等比例缩小数十乃至数百倍,可达到纳升或皮升级别,可大幅降低成本;③ 以微流控芯片为核心反应单元,与其它外围设备(例如针对荧光实时定量PCR产物进行分析的荧光激发和检测探头等)相整合,可以将PCR扩增产物直接作为模板直接进入后续分析反应,实现多个反应和分析过程的集成化[9]。目前,国内几家企业已经生产出实用性很强的芯片PCR设备,可以针对常见的致病微生物进行快速检验。这些芯片大多采用PMMA或PC作为制作材料,成本较低,配套有微型加热薄膜和光学检测仪等外围设备,成熟度较高。
2 LAMP微流控芯片系统
LAMP技术最早于本世纪初由日本学者提出,是一种恒温条件下的核酸扩增技术。在4~6条引物及Bst聚合酶的作用下,可以在恒温(约60~65℃)条件进行延伸扩增。LAMP技术的化学反应耗时较短,检验灵敏度较高,因此近年来得到了很多研究者的关注[10]。国内多家企业已经开发了基于微流控芯片的LAMP分析设备。图3为一种半开放式LAMP扩增微流控芯片系统,可以一次针对四种样品进行并行检验分析[11]。

图3 一种LAMP微流控芯片系统[11]
LAMP扩增的DNA产物量极大(比PCR反应高2~3个数量级),这些大量产生的核酸片段容易导致空气气溶胶污染,从而造成假阳性分析结果。因此,对于LAMP分析设备而言,系统的密闭性十分必要,需要避免LAMP扩增产物离开芯片扩散到空气中。为此,本实验室前期开发了一种封闭性较好的双层微流控芯片,见图4。该芯片系统采用PDMS为制作材料,以矿物油对芯片管道的进液和出液孔进行封闭,能够一次针对五中样本进行高通量分析。
在外围控制系统方面,主要采用微量进液蠕动泵,通过塑料管和针头连接与芯片的管道,用以对芯片内的流体进行操控。反应产生的荧光信号通过CCD采集卡实时获取并传输到电脑中进行分析。当前,国内的北京博奥公司已经开发出便携式LAMP微流控检验设备,配套有旋转驱动装置,采用旋转离心力作为芯片液体的驱动动力。同时内置光学探头,可以对LAMP反应产生的荧光信号进行实时采集。

图4 一种密闭性良好的LAMP微流控芯片
3 核酸微阵列微流控芯片系统
核酸微阵列杂交是现代医学和环境卫生检验领域中常用的一种高通量分析技术,可以对样本中的核酸分子进行快速捕获和判断,但常规微阵列设备价格昂贵,操作复杂,不利于大范围普及应用[12]。本课题组前期开发了基于微流控芯片的小型化核酸微阵列杂交设备,具有便携性强,成本低廉的优势。图5所示为本课题组开发的静态微阵列杂交芯片系统[8]。该系统为一次性使用,成本低廉,可以一次针对六种不同的靶标物进行高通量检验分析。

图5 一种静态核酸杂交芯片系统[8]
核酸微阵列微流控芯片设备的主要优势在于通量高,采用超高密度集成的设计方案,可以在数平方厘米的载体表面固定数百个核酸探针,能一次针对数十或数百种靶标物进行分析[13]。但是,目前对该类检验分析设备的开发较少,主要原因是杂交分析的结果读取需要精度较高的荧光激发和采集系统,而搭建这一系统的成本较高[14]。此外,静态杂交反应依赖被动分子扩散,耗时相对较长,当前最新的微阵列杂交系统是采用流动式杂交的方式,可以进一步缩短分析所需的时间[15]。
4 免疫分析微流控芯片系统
基于微流控芯片的的免疫检验分析技术的基本原理是将常规免疫反应体系按照一定的比例缩小,使其适合芯片内的管道和反应腔室的容积,同时,在芯片内构建半透阀结构,将抗体固定在微珠表面,在芯片内的微免疫柱内完成免疫分析[16]。免疫微流控芯片的优势主要有:试剂消耗量低、反应速度快、分析精度高和反应通量高。图6所示为本课题组构建的一种免疫微流控芯片系统[17]。
灌注在芯片微反应柱内的微珠表面事先固定有特异性抗体,可以对流经反应柱的样品中的特异性靶标物进行结合和捕获。而后,在带有荧光标记的二抗作用下显色,结果可由微型CCD采集到计算机中进行亮度分析,从而对样品中靶标物的含量进行初步判断。这种免疫微流控芯片系统已应用于检测环境水体中的疟原虫,与常规检测系统相比,具有更高的稳定性和检测灵敏度[17]。

图6 含有微免疫分析柱的微流控芯片系统[17]
5 展望
微流控芯片技术自诞生以来一直到世界各国研究者的广泛关注。2010年之前,大部分研究者都处于基础研究阶段,即对微流控芯片的制造、结构和功能进行不断改进、完善。近年,已经有多种实用性较强的微流控芯片检验分析设备相继问世,进入医院临床、环境卫生监测等实际应用中,取得了良好效果。我国在此领域起步较早,研究水平处于世界前列,但距离开发出成熟稳定的微流控检验分析设备还有一定的距离。随着个性化医疗和现场快检的需求日益增加,微流控芯片作为检验分析的核心反应单元,有望在不远的将来大量取代现有的常规仪器系统,有助于实现检验分析设备的微型便携、低消耗和高通量。
[1]Whitesides GM.The origins and the future of microfuidics[J].Nature,2006,442:368-373.
[2]蒋西然,李灵,于宁,等.微流控芯片快速检测空气气流中金黄葡萄球菌的研究[J].水动力学研究与进展,2015,30(6):619-623.
[3]Lilehoj PB,Huang MC,Truong N,et al.Rapid electrochemical detection on a mobile phone[J].Lab Chip,2013,13(15):2950-2955.
[4]Mullis K,Faloona F,Scharf S,et al.Specific enzymatic amplification of DNA in vitro:the polymerase chain reaction[J].Cold Spring Harb Symp Quant Biol,1986,51 Pt 1:263-273.
[5]Mo XT,Zhou YP,Lei H,et al.Microbalance DNA probe method for the detection of specifc bacteria in water[J].Enzyme Microb Tech,2002,30(5):583-589.
[6]Hoffmann J,Trotter M,von Stetten F,et al.Solid-phase PCR in a picowell array for immobilizing and arraying 100,000 PCR products to a microscope slide[J].Lab Chip,2012,12(17):3049-3054.
[7]Kricka LJ,Wilding P.Microchip PCR[J].Anal Bioanal Chem,2003,377:820-825.
[8]Jiang X,Shao N,Jing W,et al.Microfuidic chip integrating high throughput continuous-flow PCR and DNA hybridization for bacteria analysis[J].Talanta,2014,122:246-250.
[9]Jiang X,Jing W,Zheng L,et al.A Continuous-flow highthroughput microfluidic device for airborne bacteria PCR detection[J].Lab Chip,2014,14:671-676.
[10]Fang X,Chen H,Xu L,et al.A portable and integrated nucleic acid amplifcation microfuidic chip for identifying bacteria[J].Lab Chip,2012,12,1495-1499
[11]Yuan H,Liu YC,Jiang XR,et al.Microfluidic chip for rapid analysis of cerebrospinal fluid infected with Staphylococcus aureus[J].Anal Methods,2014,6:2015-2019.
[12]Zheng L,Fu Y,Jiang X,et al.Microfluidic system for highthroughput immunoglobulin-E analysis from clinical serum samples[J].Talanta,2015,143:83-89.
[13]靳连群,李君文,王升启,等.基因芯片技术检测环境中常见致病菌的初步研究[J].中华微生物学和免疫学杂志,2003,23(1):74-78.
[14]Peytavi R,Raymond FR,Gagné D,et al.Microfuidic device for rapid (<15 min) automated microarray hybridization[J].Clin Chem,2005,51(10):1836-1844.
[15]Wang L,Li PC.Optimization of a microfluidic microarray device for the fast discrimination of fungal pathogenic DNA[J].Anal Biochem,2010,400(2):282-288.
[16]Jing W,Jiang X,Zhao W,et al.Microfluidic platform for direct capture and analysis of airborne Mycobacterium tuberculosis[J].Anal Chem,2014,86(12):5815-5821.
[17]Zhao W,Zhang L,Jing W,et al.An integrated microfuidic device for rapid serodiagnosis of amebiasis[J].Biomicrofuidics,2013,7(1):011101.
Microfuidics-Based Environmental Health Assessment System &Device
Microfuidic technique is developing rapidly in the felds of environmental health assessment and clinical identifcation. Many practicable and robust chip systems and devices have been developed in the past few years. The chip-based devices have various advantages such as portability and low consumption,which makes them practical and partly replaced the traditional techniques. In this study,research progress on microfuidic-based devices has been summarized. The development of microfuidic systems and the construction methods have been introduced and discussed based on our previous works.
microfuidics;environmental health assessment;portable devices;medical devices
JIANG Xi-ran1,ZHANG Yan2,QIN Hong-mei2,YU Ning3,LIU Guo-jie4,QIN Kai-rong1,WANG Xiao-xi4
1. Department of Biomedical Engineering,Dalian University of Technology,Dalian Liaoning 116024,China;2. Liaoning Health and Family Planning Inspection,Shenyang Liaoning 110005,China;3. The First Clinical College,Liaoning University of Traditional Chinese Medicine,Shenyang Liaoning 110032,China;4. Sports Teaching and Research Room,College of Public Foundation,China Medical University Shenyang Liaoning 110122,China
R318.6;TN409
A
10.3969/j.issn.1674-1633.2016.09.002
1674-1633(2016)09-0005-04
2016-08-26
国家自然科学基金项目(81501833);辽宁省自然科学基金(2015020574)。
本文作者:蒋西然,讲师,博士,研究方向:微流控芯片。
王晓晰,技师。
通讯作者邮箱:xiaoxiwang@cmu.edu.cn
