二氢槲皮素与二氢杨梅素抗炎活性对比研究
2016-02-07王佳奇陈凯王月亮李莹刘一桐高铭彤李靖毓丁传波宋明铭刘文丛
王佳奇,陈凯,王月亮,李莹,刘一桐,高铭彤,李靖毓,丁传波,宋明铭,刘文丛
(吉林农业大学中药材学院, 长春 130118)
二氢槲皮素与二氢杨梅素抗炎活性对比研究
王佳奇,陈凯,王月亮,李莹,刘一桐,高铭彤,李靖毓,丁传波,宋明铭,刘文丛*
(吉林农业大学中药材学院, 长春 130118)
构建巨噬细胞验证模型,比较研究二氢槲皮素(Dihydroquercetin,taxifolin, TF)和二氢杨梅素(Dihydromyricetin, DMY)体外抗炎活性。以1 mg/L的脂多糖(LPS)诱导RAW264.7巨噬细胞建立了体外炎症模型;通过细胞毒性试验(MTT)法检测细胞存活率;Griess试剂法测定细胞上清液中NO(一氧化氮)释放量;ELISA法检测上清液中细胞因子IL-1β(白细胞介素-1β)、IL-6(白细胞介素-6)、TNF-α(肿瘤坏死因子α)和PGE2(前列腺素E2)的含量变化;通过RT-PCR法检测IL-1β、IL-6、TNF-α基因表达情况。MTT试验结果表明,二氢槲皮素和二氢杨梅素各剂量组没有表现出对巨噬细胞RAW264.7的细胞毒性。同时,二氢槲皮素高中低剂量组和二氢杨梅素高中低剂量组均能显著抑制脂多糖诱导细胞对NO、PGE2的释放(P<0.01),且均表现出剂量依赖性;二氢槲皮素高中低剂量组和二氢杨梅素高中低剂量组均能有效降低IL-1β、IL-6、TNF-α基因的表达,同时能够降低脂多糖诱导细胞产生细胞因子IL-1β、IL-6、TNF-α的含量。二氢槲皮素和二氢杨梅素均具有良好的体外抗炎作用,且二氢槲皮素的抗炎作用较好。
二氢槲皮素;二氢杨梅素;RAW264.7细胞;炎症
二氢槲皮素和二氢杨梅素是两种典型的类黄酮化合物,它们有相似的母体结构,其差别仅为B环5’位上是否存在酚羟基。它们的结构如图1所示。目前,体外抗炎作用一般多以脂多糖(LPS)诱导小鼠巨噬细胞RAW264.7为模型,然后通过测定用药前后炎症因子含量的变化以及相关基因的表达量研究药物的抗炎活性。有研究表明[1-3],二氢槲皮素(taxifolin, TF)和二氢杨梅素(Dihydromyricetin, DMY)均具有抗炎活性,对一些炎症模型均体现出良好的抗炎效果。但目前就市场价格,二氢槲皮素非常昂贵,是二氢杨梅素的10倍,本实验以二氢槲皮素和二氢杨梅素作为研究对象,将两种类黄酮化合物的抗炎活性进行对比研究,旨在为抗炎药物的开发利用提供依据。
图1 二氢杨梅素和二氢槲皮素化学结构图
1 材料与方法
1.1 材料 二氢槲皮素(TF) HPLC>97%,实验室自制;二氢杨梅素(DMY),HPLC>98%,批号:K140511, 西安开来生物工程有限公司。小鼠巨噬细胞RAW264.7购自中科院上海生命科学研究院细胞库。
1.2 试剂及仪器 地塞米松(Dexamethasone,DXM)、脂多糖(Lipopolysaccharide,LPS), Sigma;二甲基噻唑(MTT), Amresco;二甲基亚砜(DMSO),Sigma;青链双抗,Gibco;DMEM高糖培养基,hyclone;小牛血清,hyclone;小鼠肿瘤坏死因子-α(TNF-α)酶联免疫分析试剂盒,小鼠白介素-6(IL-6)酶联免疫分析试剂盒,小鼠白介素-1β(IL-1β)酶联免疫分析试剂盒,小鼠前列腺素E2(PGE2)酶联免疫试剂盒均购自R&D公司;蒸馏水(吉林农业大学)。
美国Costar 6孔和24孔细胞培养板; 美国Forma Scientific CO2细胞培养箱; 倒置显微镜(Olympas); 北京六一电泳仪;美国BIORAD 凝胶成像仪;美国SBP PCR仪;Haier -70 ℃低温冰箱;美国Thermo Electron MK3型酶标仪。
1.3 细胞培养 小鼠巨噬细胞RAW264.7培养于DMEM培养基中, 内含10%灭活新生小牛血清及100 U/mL青霉素和100 μg/mL链霉素, 置于37 ℃、5.0% CO2饱和湿度的培养箱中培养。
1.4 MTT法测定二氢槲皮素和二氢杨梅素毒性 取对数生长期的RAW264.7细胞至离心管内,调整细胞浓度为1×105个细胞/mL,以100 μL/孔的量铺至96孔板中,于5% CO2、37 ℃培养箱中继续培养24 h。根据实验要求,加入含不同浓度的TF(2.5,5,10,20,40 μg/mL)和DMY(2.5,5,10,20,40 μg/mL)DEME高糖培养液,每孔100 μL,空白组加入等体积的DMEM高糖培养液,培养24 h,每孔各做三个平行孔。在终止细胞培养前4 h,加入20 μL/孔MTT(5 mg/mL)。终止细胞培养后,轻轻吸去上清,每孔加入150 μL DMSO溶液,震荡5 min,待甲瓒充分溶解,用酶标仪测定570 nm处的各孔吸光度,相对于空白组计算细胞存活率。
1.5 ELISA法检测RAW264.7细胞培养上清液中细胞因子(TNF-α,IL-6和IL-1β)和PGE2的水平 取对数生长期的RAW264.7细胞至离心管内,调整细胞浓度为1×105个细胞/mL,以500 μL/孔的量铺至24孔板中,于5% CO2、37 ℃培养箱中继续培养24 h。实验分为9组,即空白对照组,LPS模型组,阳性对照组,TF高、中、低剂量组和DMY高、中、低剂量组,每组设三个平行组。弃上清,空白对照组和LPS对照组加入DMEM培养液,阳性对照组加入含DXM的DEME高糖培养液250 μL,给药组分别加入含不同浓度的TF和DMY的DEME高糖培养液250 μL,干预2 h,向空白对照组加入DMEM高糖培养基,其余组加入含1 mg/L LPS的DEME高糖培养液250 μL,培养24 h。培养结束时,吸取细胞上清液,上清液按照TNF-α,IL-6,IL-1β和PGE2酶联免疫检测试剂盒说明书测定其中TNF-α,IL-6,IL-1β和PGE2的水平。
1.6 NO的检测 取对数生长期的RAW264.7细胞至离心管内,调整细胞浓度为1×105个细胞/mL,以500 μL/孔的量铺至24孔板中,于5% CO2、37 ℃培养箱中继续培养24 h。实验分为9组,即空白对照组,LPS模型组,阳性对照组,TF高、中、低剂量组和DMY高、中、低剂量组。弃上清,空白对照组和LPS对照组加入DMEM培养液,阳性对照组加入含DXM的DEME高糖培养液250 μL,给药组分别加入含不同浓度的TF和DMY的DEME高糖培养液250 μL,干预2 h,向空白对照组加入DMEM高糖培养基,其余组加入含1 mg/L LPS的DEME高糖培养液250 μL,培养24 h。培养结束时,吸取培养液100 μL于另一96孔细胞培养板,每孔各加入100 μL Griess reagent 试剂(1% sulfanilamide 和0.1% N-[1-naphthyl]- ethylenediamine dihydrochloride in 5% phosphoric acid),室温避光放置10 min,于540 nm处测定OD值。
1.7 RT-PCR检测TNF-α,IL-6,IL-1β mRNA的表达 取对数生长期的RAW264.7细胞至离心管内,调整细胞浓度为4×105个细胞/mL,将细胞以2 mL/孔的量接种于6孔板中,在5% CO2、37 ℃培养箱中培养24 h后弃除培养液,空白对照组和LPS对照组加入DMEM培养液,阳性对照组加入含DXM的DEME高糖培养液2 mL,给药组分别加入含不同浓度的TF和DMY的DEME高糖培养液2 mL,干预2 h,向空白对照组加入DMEM高糖培养基,其余组加入含1 mg/L LPS的DEME高糖培养液2 mL,培养24 h。去除细胞上清液,用PBS洗涤细胞两次,然后利用高纯总RNA快速提取试剂盒提取细胞中RNA,取1 μg总RNA配置逆转录反应体系,逆转录合成cDNA,并以此为模板利用Bio Teke super RT Kit试剂盒进行扩增。PCR反应中使用的引物序列如表1所示。PCR扩增产物10 μL经1.5%琼脂糖凝胶电泳,运用数码凝胶成像分析系统拍照,成像观察。

表1 引物序列
2 结果与分析
2.1 二氢槲皮素及二氢杨梅素的细胞毒性评价 选取药物浓度为2.5~40 μg/mL的二氢槲皮素和二氢杨梅素分别作用于RAW264.7细胞24 h,采用MTT法测得不同浓度的TF和DMY对小鼠RAW264.7细胞是否具有毒性作用,从而确定使用剂量。如图2所示,药物浓度在2.5~20 μg/mL内的TF组和DMY组与空白组相比,细胞活力没有显著差异(P>0.05),结果表明TF在2.5~20 μg/mL,DMY在2.5~20 μg/mL范围内对小鼠RAW264.7细胞没有细胞毒性作用。
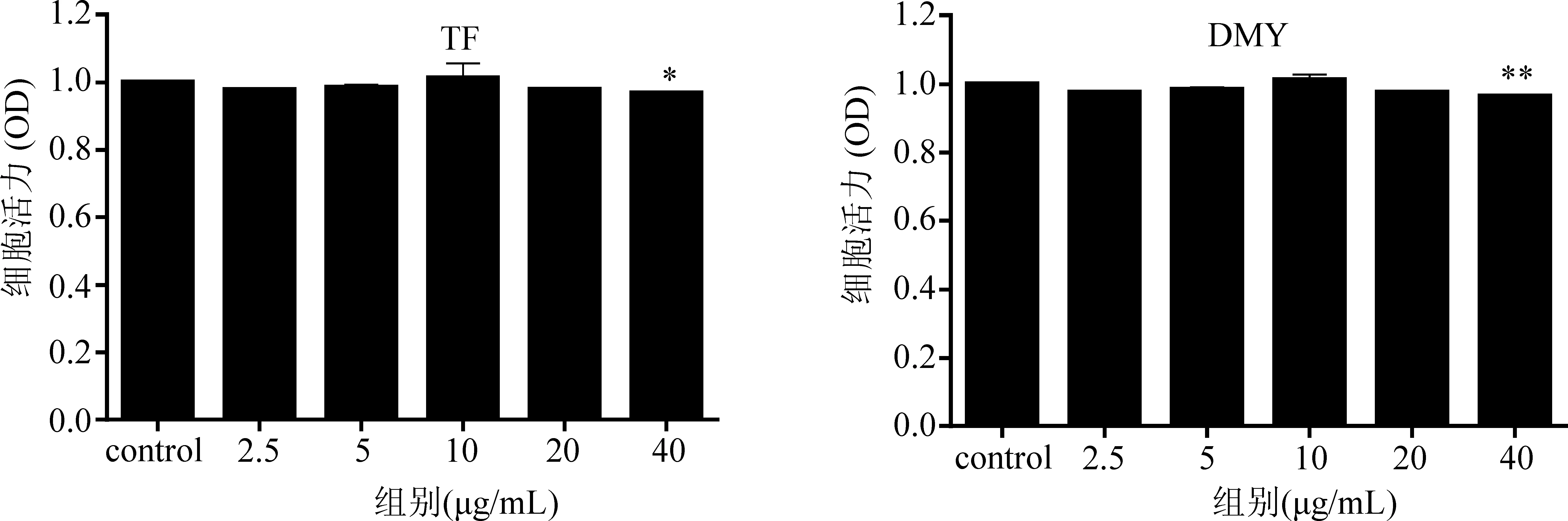
图2 TF和DMY对小鼠RAW264.8细胞活力的影响(*P<0.05,**P<0.01与空白对照组比较)
2.2 TF和DMY对LPS刺激的小鼠RAW264.7细胞释放炎症介质NO、PGE2的影响 由表2可知,LPS模型组NO、PGE2含量与空白组相比均显著升高。TF和DMY各剂量组对LPS刺激的小鼠RAW264.7细胞释放NO、PGE2均具有不同程度的抑制作用,且呈剂量依赖性关系。TF高剂量组的NO含量与阳性对照组相比无显著性差异。

表2 TF和DMY对LPS诱导的RAW264.7细胞释放炎症介质NO、PGE2的影响
注:##P<0.01与空白对照组比较;**P<0.01与LPS组比较;△△P<0.01与阳性对照组比较
2.3 TF和DMY对LPS刺激的小鼠RAW264.7细胞分泌细胞因子(TNF-α,IL-6和IL-1β)的影响 与空白对照组相比,LPS模型组细胞因子含量均显著升高。与LPS模型组相比,TF和DMY各剂量组对炎症模型细胞IL-1β、IL-6和TNF-α的分泌量均显著性降低,并且随着药物浓度的升高,分泌的水平逐渐降低,呈剂量依赖性关系。TF高剂量组的细胞因子IL-6含量,与阳性对照组相比无显著性差异(表3)。
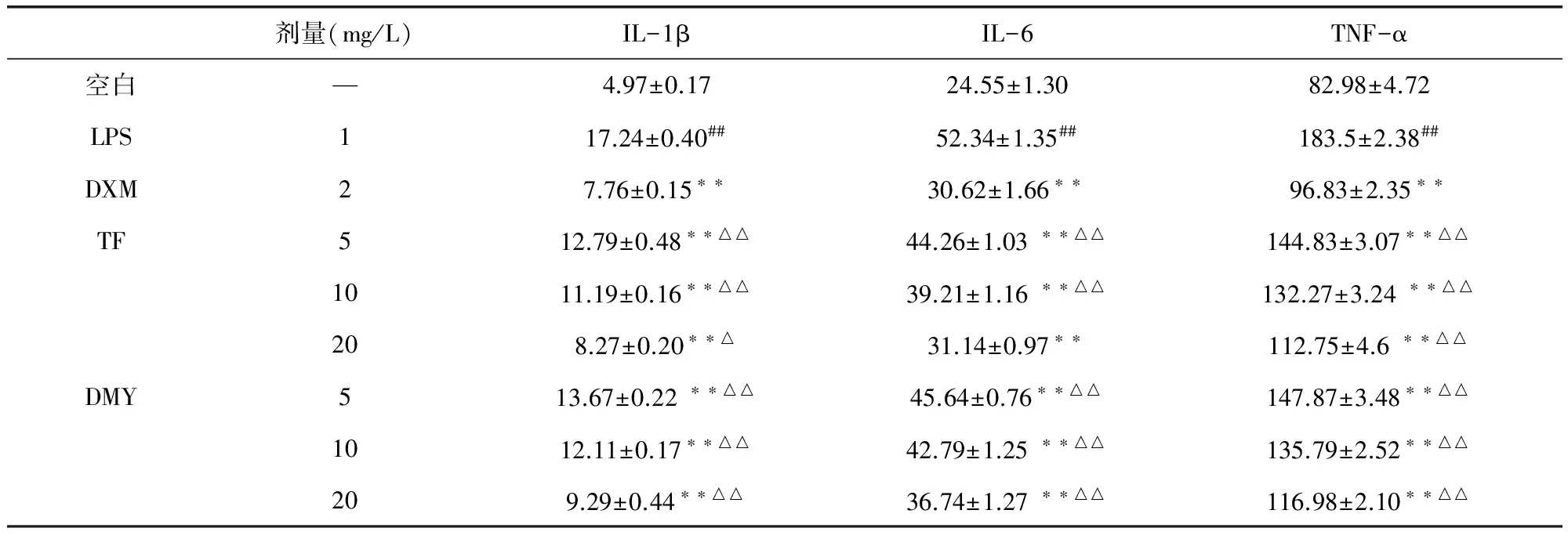
表3 TF和DMY对LPS诱导的RAW264.7细胞IL-1β、IL-6和TNF-α分泌的影响
##P<0.01与空白对照组比较;**P<0.01与LPS组比较;△P<0.05、△△P<0.01与阳性对照组比较
2.4 TF和DMY对LPS刺激的小鼠RAW264.7细胞基因TNF-α,IL-6和IL-1β mRNA表达的影响 试验结果表明(图3),LPS构建巨噬细胞验证模型导致细胞中TNF-α,IL-6和IL-1β mRNA表达量提高,由于这三种细胞因子是炎症反应中的关键标志物,因此通过PCR鉴定验证成功构建了炎症模型。地塞米松通过抑制细胞因子TNF-α,IL-6和IL-1β 基因的表达而表现出了对炎症反应的抑制作用。相比之下,二氢槲皮素高中低剂量组和二氢杨梅素高中低剂量组对TNF-α,IL-6和IL-1β基因表达也分别表现出了不同的抑制作用,其中二氢槲皮素高剂量组对三种细胞因子的基因表达量的抑制作用最为明显。
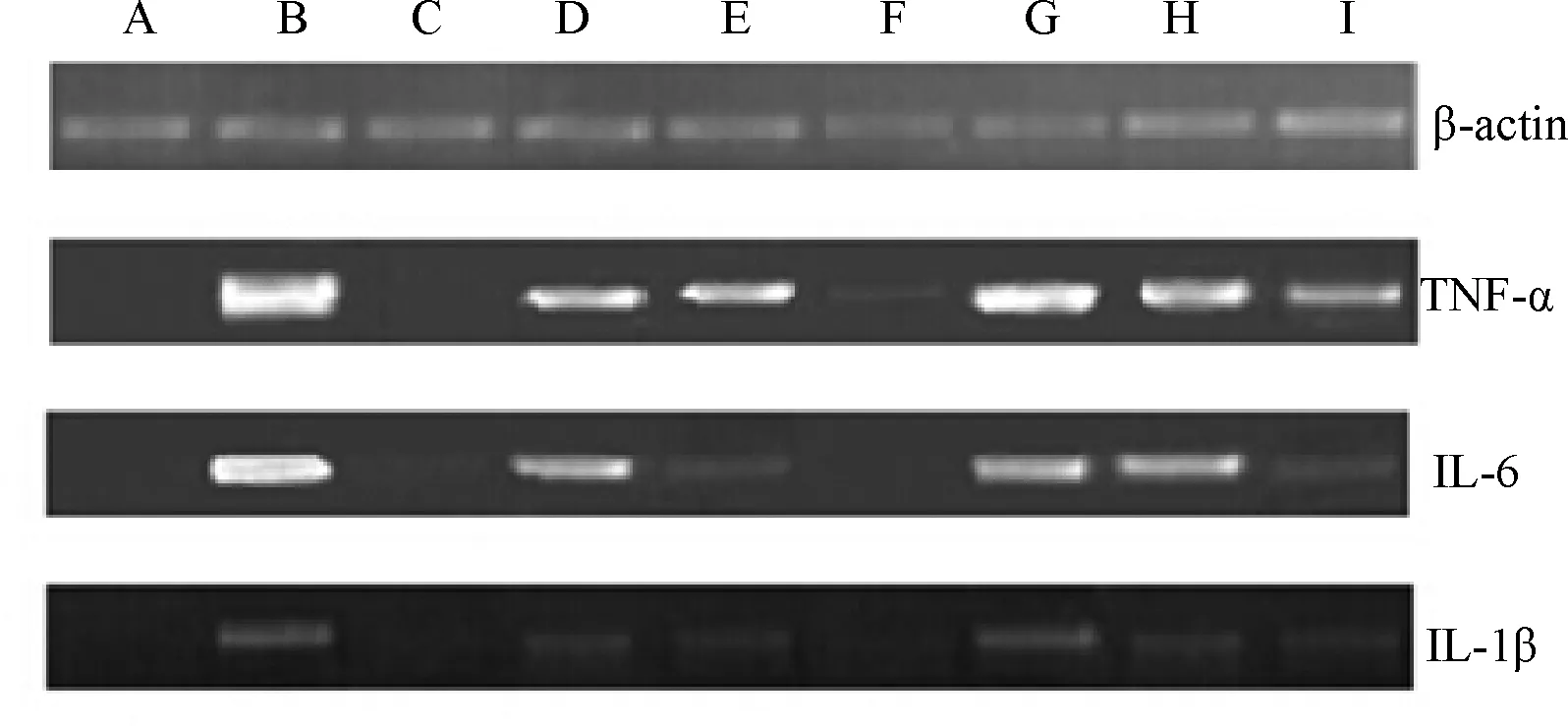
A:空白对照组 B:LPS模型组 C:阳性对照组 D~E:二氢槲皮素低剂量组(5mg/L)、中剂量组(10 mg/L)、高剂量组(20 mg/L) G~I:二氢杨梅素低剂量组(5 mg/L)、中剂量组(10 mg/L)、高剂量组(20 mg/L)图3 TF和DMY对LPS诱导的RAW264.7细胞基因TNF-α,IL-6和IL-1β mRNA表达的影响
3 讨论与小结
炎症是指机体受到了自身及外界损害或者处于应激状态时,呈现的以快速动力循环、快速代谢反应为特征的生理及病理过程。在多数的细胞和动物实验中常用脂多糖诱导炎症发生[4-7]。巨噬细胞会在炎症启动的过程中通过激活机体自身的免疫系统,释放具有生物活性的酯类介质、细胞因子及活性氧等炎症介质起着至关重要的作用[8-9]。
3.1 二氢槲皮素及二氢杨梅素的细胞毒性评价 本实验以脂多糖(LPS)诱导小鼠RAW264.7巨噬细胞为模型,将二氢槲皮素和二氢杨梅素的体外抗炎活性进行对比。首先采用MTT法检测了二氢槲皮素和二氢杨梅素对小鼠RAW264.7巨噬细胞的细胞毒性影响。结果显示,药物浓度在2.5~20 μg/mL内的二氢槲皮素组和二氢杨梅素组与空白组相比,细胞活力没有显著差异(P>0.05),结果表明二氢槲皮素在2.5~20 μg/mL,二氢杨梅素在2.5~20 μg/mL范围内对小鼠RAW264.7细胞没有细胞毒性作用。有研究证实,医学上将选择性调节细胞因子表达水平的方法用于炎症疾病治疗[10-11],因而只要可以增加抗炎细胞因子分泌或抑制促炎细胞因子表达的药物均可用于治疗炎性疾病。
3.2 二氢槲皮素及二氢杨梅素对炎症介质的影响 在炎症发生的过程中,参与介导炎症反应,具有调节作用的内源性化学因子称为炎症介质。在这些炎症介质中,有两种主要的炎症介质共同参与了机体的抗炎反应,即NO和PGE2。一氧化氮(NO)主要是由诱生性一氧化氮合酶(iNOS)催化生成的,当机体受到某些因素(TNF、LPS等)刺激时,iNOS蛋白大量合成,导致大量NO释放,从而对机体产生影响。有研究发现,脓毒血症和急慢性炎症的发生都与NO有关[12-13],而极微量的PGE2就可以对机体引发炎性反应[14-16]。本实验通过对细胞培养液中NO和PGE2的含量检测发现:与空白对照组相比,LPS对照组NO和PGE2分泌量显著增加;与LPS对照组相比,二氢槲皮素和二氢杨梅素各剂量组对LPS刺激的小鼠RAW264.7细胞释放NO和PGE2均具有不同程度的抑制作用,且呈剂量依赖性关系。因此可推想二氢槲皮素和二氢杨梅素的抗炎作用大概与其抑制PGE2和NO的合成相关。
3.3 二氢槲皮素及二氢杨梅素对炎症因子的影响 当机体被LPS刺激后,体内巨噬细胞会分泌出大量细胞因子。其中抗炎因子TNF-α在整个炎症反应进程中起到最为关键的作用。TNF-α可以诱导IL-6、IL-1β等细胞因子的产生和释放[17-18],从而启动细胞因子级联反应[19],增强血管通透性。白细胞介素-1β(IL-1β)作为IL-1基因家族的一员,可由LPS刺激直接产生,也可以通过TNF-α诱导产生,是一种具有广泛调节作用的促炎因子,诱导TNF、IL-6及其自身分泌,并同TNF互相促进彼此释放。此外,LPS诱导产生的发热反应与炎症的主要诱发者IL-6有密切关系。当机体因炎症感染初期,血液中IL-6表达量一般会相对较高,然而当血液中IL-6的表达量持续增高,便会对机体形成重大的损害,如烧伤、器官衰竭等[20]。因此阻断炎症反应持续发展的核心就是通过约束这些细胞因子的过度表达,恢复细胞因子网络的平衡状态。通过对细胞上清液中细胞因子含量的检测结果显示,当小鼠RAW264.7细胞被LPS刺激后, LPS组的TNF-α、IL-6和IL-1β的含量与空白对照组相比显著升高,说明体外炎症模型造模成功。与LPS模型组相比,TF和DMY各剂量组对炎症模型细胞IL-1β、IL-6和TNF-α的分泌量均显著性降低,并且随着药物浓度的升高,分泌的水平逐渐降低,呈剂量依赖性关系。TF高剂量组的细胞因子IL-6含量,与阳性对照组相比无显著性差异。结果表明,二氢槲皮素和二氢杨梅素可以通过抑制炎症细胞因子的释放起到抗炎作用。
综上所述,二氢槲皮素和二氢杨梅素均可呈剂量依赖性的抑制LPS刺激的小鼠RAW264.7细胞释放炎症介质NO、PGE2,并且降低IL-1β、IL-6、TNF-α基因的表达,阻碍分泌细胞因子IL-1β、IL-6和TNF-α,起到抗炎作用。通过对比发现,二氢槲皮素比二氢杨梅素抗炎活性更好,但对它们的抗炎的作用机理需要进行更加深入的研究,从而为抗炎药物的开发利用提供依据。
[1] Zhu Hong, Tang Sheng-an, Qin Nan,etal. Anti-inflammatory constituents from Inula japonica [J]. China Journal of Chinese Materia, 2014, 39(1):83-88.
[2] 梁婷.二氢杨梅素抗炎及抗过敏作用的研究[D].沈阳:沈阳药科大学,2007.
[3] 陈立峰, 董倩倩,张琼.二氢杨梅素对大鼠免疫性慢性胃炎胃粘膜的保护作用及其机制[J]. 中国药理学与毒理学杂志,2009,23(5):381-387.
[4] 李景,吴阳阳,周海松,等.青藤碱对细菌内毒素刺激的小鼠及巨噬细胞嘌呤受体A2A、P2X7表达的影响[J].广州中医药大学学报,2016,33(1):97-102.
[5] 平舜,王凯,张江临,等.茶蜂花粉提取物BPE对LPS诱导的Raw264.7细胞的体外抗炎症作用[J].食品与生物技术学报,2015,34(12):1302-1307.
[6] 戴艺,徐明生,上官新晨,等.绿原酸对小鼠腹腔巨噬细胞免疫调节作用的研究[J].天然产物研究与开发,2015(27):2128-2133.[7] 谢斌,吴蓓,欧阳辉,等.杏香兔耳风中5种单体对LPS诱导RAW264.7细胞内NO生成的影响[J].2015,46(12):60-62.
[8] Kim M M,Kim S K. Effect of phloroglucinol on oxidative stress and inflammation [J]. Food Chem Toxicol, 2010,48(10):2925-2933.[9] Kim S, Jung E, Kim J H,etal. Inhibitory effects of (-)-α-bisabolol on LPS-induced inflammatory response in RAW264.7 macrophages[J]. Food Chem Toxicol, 2011, 49(10):2580-2585.
[10]Takeuchi O, Sato S, HoriuchiT,etal. Cutting edge: role of Toll-like receptor 1 in mediating immune response to microbial lipoproteins [J]. J Immun, 2002, 169(1):10-14.
[11]Su H, Bidere N, Zheng L,etal. Requirement for caspase-8 in NF-kappaB activation by antigen receptor[J]. Science, 2005, 307(5714):1465-1468.[12]Cerny O, Kamanova J, Masin J,etal. Bordetella pertussis Adenylate Cyclase Toxin Blocks Induction of Bactericidal Nitric Oxide in Macrophages through cAMP-Dependent Activation of the SHP-1 Phosphatase [J]. J Immunol, 2015, 195(10):4901-4913.
[13]Lee K J, Yeo M G. Homeopathic Rhus toxicodendron has dual effects on the inflammatory response in the mouse preosteoblastic cell line MC3T3-e1[J]. Homeopathy, 2016, 105(1):42-47.
[14]Shi R, Wang Q, Ouyang Y,etal. Picfeltarraenin IA inhibits lipopolysaccharide-induced inflammatory cytokine production by the nuclear factor-kB pathway in human pulmonary epithelial A549 cells[J]. Oncol Lett, 2016, 11(2):1195-1200.
[15]Tursun X, Zhao Y, Alat Z,etal. Anti-Inflammatory Effect of Rose rugosa Flower Extract in Lipopolysaccharide-Stimulated RAW264.7 Macrophages [J]. Biomol Ther(Seoul), 2016, 24(2):184-190.
[16]Jung Y Y, Hong J T, Han S B,etal. Effect of lxeris dentata Nakai Extract on Nitric Oxide Production and Prostaglandin E2 Generation
in LPS-stimulated RAW264.7 Cells [J]. Immune Netw, 2015, 15(6):325-330.
[17]Alizan A, Khalil J. Tumour Necrosis Factor: Implications forsurgical patients [J]. ANZ J Surg, 2006, 76(11):1010-1016.
[18]Tom L, Christian T. Intracellular survival pathways in the liver [J]. Liver International, 2006, 26(10):1163-1174.
[19]Wouter M, Kooloos D J. Potential role of pharmacogentics in anti-TNF treatment of rheumatoid arthritis and crohn’s disease [J]. Drug Discovery Today, 2007, 12(3/4):125-131.
[20]Park W Y, Goodman R B, Steinberg K P,etal. Cytokine balance in the lungs of patients with acute respiratory distress syndrome [J]. AmJ Respir Crit Care Med, 2001, 164(10):1896-1903.
(编辑:侯向辉)
Comparison of Anti-inflammatory Activity of Dihydroquercetin and Dihydromyricetin
WANG Jia-qi, CHEN Kai, WANG Yue-liang, LI Ying, LIU Yi-tong, GAO Ming-tong,LI Jing-yu, DING Chuan-bo, SONG Ming-ming, LIU Wen-cong*
(CollegeofTraditionalChineseMedicine,JilinAgriculturalUniversity,Changchun130118,China)
Construction of macrophages to validate the model, comparative study dihydroquercetin(also known as taxifolin, TF) and dihydromyricetin(DMY)invitroanti-inflammatory activity was made. To 1 mg/L lip polysaccharide (LPS) - induced RAW264.7 macrophagesinvitromodel of inflammation was established;Cell viability was detected by the cytotoxicity test (MTT) method;Griess reagent method was used to determine the amount of NO released from cell supernatant;The content of cytokine IL-1β, IL-6, TNF-α and PGE2in supernatant was detected by ELISA assay; Gene expression were detected with the methods of RT-PCR. TF and DMY 2.5~20 μg/mL showed no cytotoxicity on macrophages of RAW264.7. Meanwhile, TF high, medium and low dose group and DMY high, medium and low dose group significantly inhibited LPS-induced cells to release of NO and PGE2(P<0.01), and showed a dose-dependent manner; TF high, medium and low dose group and DMY high, medium and low dose group could effectively reduce IL-1β, IL-6, TNF-α gene expression, while reducing LPS-induced cells to produce cytokines levels. Dihydroquercetin and DMY have good anti-inflammatory effectsinvitroand anti-inflammatory effect of TF was better.
dihydroquercetin; dihydromyricetin; RAW264.7 cells; inflammation
科技型中小企业创新创业基金项目(20160308002YY)
王佳奇,硕士研究生,从事中药新药研究与开发。
刘文丛。E-mail:jwlw6803@126.com
2016-05-13
A
1002-1280 (2016) 07-0046-07
S859.796
