猪脂肪组织酵母双杂交文库的构建及质量鉴定
2016-02-06陈俊峰张家庆白献晓任巧玲
陈俊峰,王 璟,张家庆,高 翔,白献晓,任巧玲,
高彬文1,马 强1,郭红霞1,邢宝松1*
(1.河南省农业科学院 畜牧兽医研究所,河南 郑州 450002; 2.郑州市兽药饲料监察所,河南 郑州 450052)
猪脂肪组织酵母双杂交文库的构建及质量鉴定
陈俊峰1,王 璟1,张家庆1,高 翔2,白献晓1,任巧玲1,
高彬文1,马 强1,郭红霞1,邢宝松1*
(1.河南省农业科学院 畜牧兽医研究所,河南 郑州 450002; 2.郑州市兽药饲料监察所,河南 郑州 450052)
为了研究猪脂肪细胞分化的蛋白质之间的相互作用,采用LR重组反应的方法,构建猪脂肪组织酵母双杂交文库。结果显示,酵母双杂交文库的库容量为5.28×106CFU。随机挑取的24个克隆均带有插入片段,重组率100%,片段大小多数为1~2 kb,表明构建的文库质量较高。
猪; 脂肪组织; 酵母双杂交; cDNA文库
脂肪组织在胚胎发育晚期出现,仔猪出生后迅速增长,是一种高度分化的组织。脂肪组织生长包括新脂肪细胞的生成和脂肪细胞体积的增大。在新生动物中,主要表现为新脂肪细胞的生成,即脂肪细胞的分化;成年动物则以脂肪细胞体积增大为主,但仍保留了脂肪细胞分化的能力。猪脂肪组织既是脂肪的储存库,同时也是内分泌器官[1-2],其分泌的主要活性因子包括瘦素(leptin)、1型纤溶酶原激活物抑制剂(plasminogen activator inhibitor type 1,PAI-1)、肿瘤坏死因子α(tumor necrosis factor-α,TNFα)、脂连素(adiponectin,APN)、酰化刺激蛋白(acylation stimulation protein,ASP)等[3]。脂肪细胞的分化途径主要由3个核心转录因子协同调节:CCAAT/增强子结合蛋白家族(CAAT/enhancer binding protein,C/EBP)、过氧化物酶体增殖物激活受体家族(peroxisome proliferator activated receptor,PPAR)和类固醇调节元件结合蛋白(sterol regulatory element binding protein 1,SREBP1)[4]。脂肪细胞分化过程十分繁杂,还有许多因子的作用尚不清楚,通过酵母双杂交文库筛选互作蛋白是研究蛋白质相互作用的一种重要方法。
酵母双杂交的原理是通过将已知目的蛋白(诱饵蛋白,bait protein)与酵母DNA结合结构域(DNA bindingdomain,BD)序列融合后表达产生融合蛋白BD-Bait;另一方面未知的捕获蛋白(prey protein)与酵母转录激活结构域(transcriptiobal activation domain,AD)序列融合,在酵母中表达融合蛋白AD-Prey。若已知的诱饵蛋白与未知捕获蛋白相互作用,在酵母宿主中,BD和AD联系在一起,从而激活下游报告基因的表达[5-6]。通过对捕获到的蛋白质进行序列分析,可确定与目的蛋白产生互作的蛋白质。因此,能否构建高质量的脂肪组织是酵母双杂交文库蛋白质筛选的关键。为此,本研究构建猪脂肪组织酵母双杂交文库,以期为筛选与已知的脂肪代谢关键基因互作的未知蛋白奠定基础。
1 材料和方法
1.1 试验材料
1.1.1 供试动物 3头2月龄大白猪由郑州某猪场提供。
1.1.2 主要试剂 TRIzol 试剂、FastTrack®MAG mRNA isolation 试剂盒、CloneMiner Ⅱ cDNA Library Construction 试剂盒、PureLink®Hipure Plasmid Filter Midiprep 试剂盒、LR ClonaseTMⅡ Enzyme Mix、ElectroMAXTMDH10BTMT1 Phage Resistant Cells、1 kb Plus DNA Ladder均购自Invitrogen公司,DEPC 水购自Beyotime公司。
1.1.3 质粒 pDONR222、pGADT7-DEST购自Invitrogen公司。
1.2 脂肪组织总RNA提取、mRNA分离与纯化
取3头猪,采集背部皮下脂肪组织各1 g,混合预冷,放入液氮研成粉末,然后转入50 mL RNase free离心管中,加入20 mL的Trizol试剂,按说明书提取总RNA。用1%琼脂糖凝胶电泳检测完整性,并进行浓度检测,然后利用FastTrack®MAG mRNA isolation 试剂盒,对提取的脂肪组织总RNA进行mRNA的分离与纯化,用1%琼脂糖凝胶电泳检测mRNA质量,并检测浓度与纯度。
1.3 cDNA初级文库构建
1.3.1 cDNA第一链的合成 取上一步获得的mRNA,分别加入Glycogen (20 μg/μL) 1 μL,5 mol/L NH4OAc 100 μL和无水乙醇1 000 μL,于-80 ℃静置15 min,然后4 ℃、14 000 r/min离心25 min,去上清;加入1 mL 70%乙醇洗涤沉淀,4 ℃、14 000 r/min离心3 min,去上清;室温晾干后溶于7 μL DEPC水中。加入1 μL生物素标记的引物biotin-attB2-Oligo(dT) (30 pmol/L),混匀后65 ℃变性5 min,冷却到45 ℃放置2 min;分别加入5×First Strand Buffer 4 μL,DTT(0.1 mol/L)2 μL,dNTPs(10 mmol/L)1 μL,45 ℃孵育2 min,加入5 μL SuperScript Ⅲ反转录酶混匀,45 ℃水浴1 h,合成cDNA第一链。
1.3.2 cDNA第二链的合成 上述产物先后加入如下组分:DEPC处理水 91 μL,5×Second Strand Buffer 30 μL,10 mmol/L dNTPs 3 μL,DNA Ligase (10 U/μL) 1 μL,DNA Polymerase Ⅰ(10 U/μL)4 μL,RNaseH(2 U/μL) 1 μL,总计150 μL,于16 ℃孵育2 h;然后加入T4 DNA Polymerase 2 μL,于16 ℃反应5 min后,加入0.5 mol/L EDTA(pH值8.0)10 μL终止反应;利用酚/氯仿/异戊醇法抽提,加入18 μL DEPC处理水溶解cDNA。
1.3.3 cDNA连接三框attB1重组接头 按顺序分别加入如下组分:cDNA 6 μL,5× Adapter Buffer 10 μL,attB1 Adapter(1 μg/μL) 4 μL,0.1 mol/L DTT 8 μL,T4 DNA Ligase(1 U/μL) 6 μL,DEPC水16 μL,共计50 μL,混匀后于16 ℃连接过夜。3种接头分别各连接1份。
1.3.4 cDNA BP重组 将带有接头的cDNA进行分离纯化后,加入如下组分:cDNA 14 μL,pDONR222(250 ng/μL) 1 μL,BP Clonase Ⅱ enzyme mix 4 μL,总计20 μL,混匀置于25 ℃反应16~20 h,将其重组到载体pDONR222。
1.3.5 转化大肠杆菌DH10B构建初级文库 分别将重组产物、感受态细胞DH10B 50 μL,加入-80 ℃预冷的电转杯,置于冰上45 min,电转化后加入SOC培养基1 mL,转入新的15 mL离心管,37 ℃恒温摇床培养1 h;取菌液10 μL用于库容量鉴定;余下产物加入甘油至终含量20%,-80 ℃保存。
1.3.6 初级cDNA文库质量鉴定 构建好的初级文库分别进行库容量、重组率和插入片段长度鉴定。吸取10 μL原液按1∶1 000稀释后,取出50 μL稀释液涂布于LB(含50 μg/mL Kan)平板上,37 ℃过夜培养,计数。计算公式为:文库总库容=平板上的克隆数/50×103×文库菌液总体积。随机挑取24个克隆进行菌落PCR鉴定,引物为pDONR222载体上的通用引物 M13F和M13R。
1.4 酵母双杂交文库构建
1.4.1 初级文库质粒提取 将初级文库菌液接种到100 mL肉汤培养基(含50 μg/mL Kan),30 ℃ 、250 r/min摇菌培养至OD600为1.0,提取文库质粒。
1.4.2 LR重组反应 将得到的初级文库质粒稀释到300 ng/μL,取1 μL分别加入如下组分:pGADT7-DEST (300 ng/μL) 1 μL,LR Clonase Ⅱ Mix 4 μL,ddH2O 14 μL,总计20 μL,混匀后置于25 ℃反应16~20 h。
1.4.3 转化大肠杆菌DH10B构建酵母双杂交文库 重组产物加入2 μL Proreinase K,37 ℃反应15 min,然后75 ℃反应10 min,使重组酶失活。乙醇沉淀重组产物后加入8 μL TE Buffer,吹打至重组产物完全溶解。电转化同1.3.5,取10 μL用于文库质量鉴定,剩余培养物加入甘油至终含量20%,于-80 ℃保存。
2 结果与分析
2.1 RNA提取、mRNA分离与纯化结果
从图1可以看出,有2条清晰的条带28S和18S,且亮度比值接近2∶1,经检测,质量浓度为3 781.7 ng/μL,A260/A280为2.01,说明提取的RNA纯度和完整性均能满足文库构建的要求。
从图2可以看出,分离到的mRNA呈均匀的弥散状态,表明mRNA未降解。经检测,mRNA质量浓度为18.8 ng/μL,A260/A280为2.11,达到下一步试验要求。

M.1 kb Plus DNA Ladder; 1.猪脂肪组织提取的总RNA
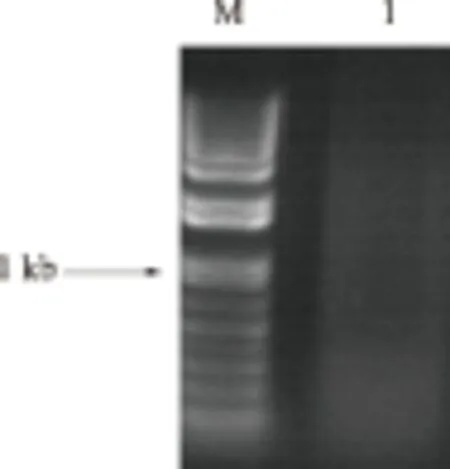
M.1 kb Plus DNA Ladder; 1.猪脂肪组织mRNA
2.2 初级cDNA文库质量检测
分离纯化后的mRNA反转录后合成第一链和第二链cDNA,分别与attB1的三框接头进行连接,分离收集后重组于pDONR222载体,转化到大肠杆菌DH10B摇菌培养,获得初级cDNA文库。稀释后的菌液涂布LB平板培养计数,经计算,文库总库容数为7.56×106CFU。24个克隆均有插入片段的阳性克隆,插入片段平均大于1.5 kb,表明重组率很高,且重组的cDNA片断的序列完整性较好(图3)。cDNA文库可以用于下一步的酵母双杂交文库构建。
M.1 kb Plus DNA Ladder; 1—24.初级cDNA文库挑取的克隆子PCR产物
2.3 酵母双杂交文库质量检测
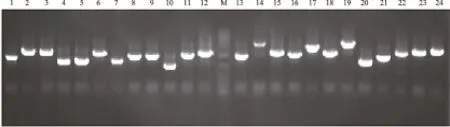
初级文库提取质粒后经过重组到酵母菌载体pGADT7-DEST,转化到大肠杆菌DH10B培养,菌液稀释后涂布LB平板培养计数。结果显示,酵母双杂交文库的库容量为5.28×106CFU。24个克隆均带有插入片段,其中有2个小于1 kb,2个大于2 kb,其余大小均在1~2 kb。结果表明构建的酵母双杂交文库完整性较好,且重组率为100%(图4),说明构建的酵母双杂交文库质量较好。

M.1 kb Plus DNA Ladder; 1—24.酵母双杂交文库挑取的克隆子PCR产物
3 结论与讨论
3.1 关于文库扩增
由于文库本身包含的克隆并不是单一的,而是多种克隆的集合体,在扩增过程中难免会出现扩增效率的不均一。在37 ℃条件下扩增文库,扩增速度过快,很容易造成文库的冗余率上升,拷贝数较低或较难扩增的质粒也容易丢失。30 ℃扩增更能保证文库的稳定性。
3.2 文库的质量鉴定
文库的库容量能否满足需求取决于样本中表达出的mRNA的种类和每种mRNA序列的拷贝数。对于一般的样本来说,一个库容量在106以上的文库是对该样本的所有转录本的上百倍的覆盖,即使是低丰度的mRNA也应有数千个克隆的存在,文库的代表性能够得到很好的保证。本试验构建的初级文库和酵母双杂交文库总容量数分别达到7.56×106CFU和5.28×106CFU。此外,PCR检测显示重组率达100%,表明文库构建的质量很好,能很好地满足后续利用酵母双杂交文库筛选互作蛋白等研究。
3.3 酵母双杂交文库与猪脂肪分化网络研究
胴体性状是猪最重要的经济性状之一,其脂肪沉积是影响胴体性状的主要因素。脂肪细胞分化主要由PPAR、C/EBP和SREBP1等几个核心转录因子调节,其中,PPARγ主要是诱导脂肪细胞的分化[7]。SREBP-1c通过调节与脂肪合成和葡萄糖代谢有关的基因调控动物体内的脂肪合成[8-10]。C/EBPα与SREBP1协同作用增加PPARγ的转录活性并促使细胞产生PPARγ相应的配体。在小鼠的脂肪分化研究中,另一个重要的转录抑制因子——脂肪细胞增强子结合蛋白(adipocyte enhancer binding protein,AEBP1)也被证实与脂肪细胞分化有关。利用酵母双杂交技术,筛选了与小鼠AEBP1互作的因子G蛋白异源三聚体γ5亚基(Gγ5),发现AEBP1的转录抑制功能通过Gγ5进行调节[11]。本研究构建了猪脂肪组织酵母双杂交文库作为捕获蛋白池,利用已知的蛋白质筛选与之相互作用的其他因子,将有助于进一步弄清猪脂肪组织的分化途径,完善其调控网络。
[1] Ahima R S,Flier J S.Adipose tissue as an endocrine organ[J].Trends in Endocrinology and Metabolism,2000,11(8):327-332.
[2] Wozniak S E,Gee L L,Wachtel M S,etal.Adipose tissue:The new endocrine organ?[J].Digestive Diseases and Sciences,2009,54(9):1847-1856.
[3] Ouchi N,Kihara S,Arita Y,etal.Adipocyte-derived plasma protein,adiponectin,suppresses lipid accumulation and class A scavenger receptor expression in human monocyte-derived macrophages[J].Circulation,2001,103(8):1057-1063.
[4] Kim J B,Wright H M,Wright M,etal.ADD1/SREBP1 activates PPARgamma through the production of endogenous ligand[J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(8):4333-4337.
[5] Keegan L,Gill G,Ptashne M.Separation of DNA bind from the transcription activating function of eukaryotic regulatory protein[J].Science,1986,231(4739):699-704.
[6] Ma J,Ptashne M.A new class of yeast transcriptional activators[J].Cell,1987,51(1):113-119.
[7] Saladin R,Fajas L,Dana S,etal.Differential regulation of peroxisome proliferator gamma 1(PPARgamma1)and PPARgamma2 massenger RNA expression in the early stages of adipogenesis[J].Cell Growth & Differentiation:the Molecular Biology Journal of the American Association for Cancer Research,1999,10(1):43-48.
[8] Li J N,Mahmoud M A,Han W F,etal.Sterol regulatory element-binding protein-1 participates in the regulation of fatty acid synthase expression in colorectal neoplasia[J].Experimental Cell Research,2000,261(1):159-165.
[9] Foretz M,Guichard P,Ferre P,etal.SREBP-1 is a major meditor of insulin action on the hepatic expression of glucokinase and lipogenesis related genes[J].Proceedings of the National Academy of Sciences,1999,96(22):12737-12742.
[10] Becard D,Hainault I,Azzout-Marniche D,etal.Adenovirus-mediated overexpression of sterol regulatory element binding protein-1c mimics insulin effects on hepatic gene expression and glucose homeostasis in diabetic mice[J].Diabetes,2001,50(11):2425-2430.
[11] Park J G,Muise A,He G P,etal.Transcriptional regulation by the g5 subunit of a heterotrimeric G protein during adipogenesis[J].EMBO Journal,1999,18(14):4004-4012.
Construction and Identification of Yeast Two-hybrid Library From Porcine Adipose Tissue
CHEN Junfeng1,WANG Jing1,ZHANG Jiaqing1,GAO Xiang2,BAI Xianxiao1,REN Qiaoling1, GAO Binwen1,MA Qiang1,GUO Hongxia1,XING Baosong1*
(1.Institute of Animal Husbandry and Veterinary,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China; 2.Zhengzhou Supervisory Institute of Veterinary Drugs and Feedstuffs,Zhengzhou 450052,China)
A yeast two-hybrid cDNA library from porcine adipose tissue was constructed by LR reaction to study on protein-protein interaction of porcine adipocyte.The results showed that the yeast two-hybrid library contained 5.28×106independent clones.All randomly selected 24 clones have recombination,and the recombination rate was 100%.The sizes of most inserts were 1—2 kb in length.These results indicated that the library constructed has high quality.
porcine; adipose tissue; yeast two-hybrid; cDNA library
2016-04-10
河南省农业科学院优秀青年科技基金项目(2013YQ21)
陈俊峰(1979-),男,湖北天门人,副研究员,博士,主要从事猪分子遗传与育种研究工作。 E-mail:afeng008@163.com
*通讯作者:邢宝松(1969-),男,河南新密人,副研究员,博士,主要从事猪分子遗传与育种研究工作。 E-mail:baosong@126.com
Q51
A
1004-3268(2016)10-0138-04
