侵染河南省番茄的番茄黄化曲叶病毒及伴随卫星DNA分子的基因组特征
2016-02-06王浩权汪伦记邱智军
王浩权,纠 敏,汪伦记,邱智军,黄 狮,张 敏
(河南科技大学 食品与生物工程学院/洛阳市微生物发酵工程技术研究中心,河南 洛阳 471023)
侵染河南省番茄的番茄黄化曲叶病毒及伴随卫星DNA分子的基因组特征
王浩权,纠 敏*,汪伦记,邱智军,黄 狮,张 敏
(河南科技大学 食品与生物工程学院/洛阳市微生物发酵工程技术研究中心,河南 洛阳 471023)
从河南省长葛市的番茄病株上分离到4份病毒分离物HNCG1、HNCG2、HNCG3和HNCG4,为明确病原类型及其亲缘关系,首先采用检测双生病毒的简并引物进行检测,均能从样品中扩增出约500 bp的片段,4个序列同源性达99%。对HNCG4基因组DNA-A全序列测定表明,其全长为2 781 bp,与番茄黄化曲叶病毒(TYLCV)省内分离物(HNSQ1、HNNY1、HNLY1、HNQX)及其临近省份的河北分离物(TYLCV LF)、北京分离物(TYLCV BJ3)亲缘关系较近,序列同源性均达99%。进一步研究发现,HNCG1和HNCG4均伴随有1 347 bp的卫星DNAβ,而HNCG2和HNCG3中未检测到DNAβ。序列比对结果表明,HNCG1和HNCG4的DNAβ之间序列同源性为100%,与越南TYLCV分离物DX2的卫星DNAβ序列同源性最高,达88%。根据以上结果,引起河南省长葛市番茄黄化曲叶病的病毒为TYLCV,部分分离物伴随有卫星DNA分子。
番茄黄化曲叶病毒; DNA-A; DNAβ; 双生病毒; 番茄
双生病毒是一种单链DNA植物病毒,具有孪生颗粒形态,已在多种经济作物上引起严重危害[1-3]。我国云南、广东、广西、海南和河南等地的番茄、烟草及番木瓜等多种经济作物及杂草寄主均受到双生病毒的侵染,给农业生产造成极大损失[4-7]。由于双生病毒的基因组结构、传播介体和其侵染的寄主范围有所不同,可将其分为玉米线条病毒属(Mastrevirus)、甜菜曲顶病毒属(Curtovirus)、番茄伪曲顶病毒属(Topocuvirus)和菜豆金色花叶病毒属(Begomovirus)。其中菜豆金色花叶病毒属病毒危害最为严重,发生也最为广泛。在自然条件下,这类病毒多数是通过烟粉虱(Bemisiatabaci)进行大范围传播,因此其也被称为粉虱传双生病毒[8]。菜豆金色花叶病毒属病毒中的多数病毒为双组分病毒,基因组含有2条相似大小的DNA,即DNA-A和DNA-B双组分序列,大小均为2.5~3.0 kb。另一部分菜豆金色花叶病毒属病毒为单组分病毒,这类病毒分布相对较少,基因组中仅含有DNA-A,序列长度约为2.8 kb[9]。近年来,在全国暴发的一些单组分双生病毒中,还逐渐发现其伴随有卫星DNAβ分子,并与之形成双生病毒/DNAβ病害复合体[10]。
粉虱传双生病毒在热带、亚热带及部分温带地区多有发生,到目前为止,已报道有39个国家和地区的番茄、烟草、棉花等作物遭受到毁灭性的危害[2]。近年来,我国江苏、河南、浙江等地也陆续报道发现类似双生病毒引发的病状,多种双生病毒先后被报道[11-13]。为了明确粉虱传双生病毒在河南省长葛市番茄上的侵染状况及进化起源,在长葛市采集番茄病毒病样品进行病原的分子鉴定,发现引起长葛市番茄黄化曲叶病的病毒分离物为番茄黄化曲叶病毒(tomato yellow leaf curl virus,TYLCV),其中部分病毒分离物伴随有卫星DNAβ,并对病毒分离物及其伴随卫星DNA分子进行亲缘关系分析,为研究双生病毒在河南省的传播和防控提供科学依据。
1 材料和方法
1.1 材料
1.1.1 毒源 病毒分离物HNCG1、HNCG2、HNCG3和HNCG4分离自河南省长葛市表现植株矮缩、顶叶卷曲黄化的番茄病株。
1.1.2 试剂Taq酶、克隆载体pMD18-T及T4 DNA连接酶均购自宝生物工程(大连)有限公司,所用引物均由上海生工生物工程有限公司合成。
1.2 DNA提取
叶片总DNA的提取参考刘玉乐等[14]的方法。称取10 mg 新鲜番茄病叶,加100 μL 0.5 mol/L NaOH,匀浆后低速离心,上清液用0.1 mol/L Tris-HCl(pH值8.0)稀释100倍,取1 μL作模板进行PCR扩增。
1.3 PCR扩增、克隆和序列测定
根据谢艳等[15]报道的检测粉虱传双生病毒的简并引物PA(5′-TAATATTACCKGWKGVCCSC-3′)和PB(5′-TGGACYTTRCAWGGBCCTTCACA-3′)(K=G或T;W=A或T;V=A,C或G;S=C或G;Y=C或T;R=A或G;B=C,T或G)进行PCR,扩增到的特异片段包含双生病毒基因间隔区(IR)序列和部分外壳蛋白(CP)基因,片段大小约500 bp,然后进行T载体克隆和序列测定。根据测序结果,利用DNAMAN软件设计特异性引物HN-F(5′-AACAGATTCAGGGAATTCATTTAG-3′)和HN-R(5′-CGGAAGCCCAGAATATACAGAATG-3′),扩增近全长的DNA-A。DNAβ全长序列扩增参考谢艳等[16]的方法。通过1%琼脂糖凝胶电泳分离PCR产物,经凝胶回收试剂盒回收纯化后,克隆到pMD18-T载体上,送南京金斯瑞生物科技有限公司测序。
1.4 序列分析
DNA序列用DNAMAN Version 6.0进行处理与分析。采用NCBI序列比对工具BLAST程序nucleotide blast进行序列比对,多序列比较分析采用Clustal W,进化树构建采用MEGA 5.05中的邻近相邻法(Neighbor-Joining)。用于DNA-A和DNAβ序列比较和进化分析的其他序列分别列于表1和表2。

表1 用于构建系统发育树的30种TYLCV分离物
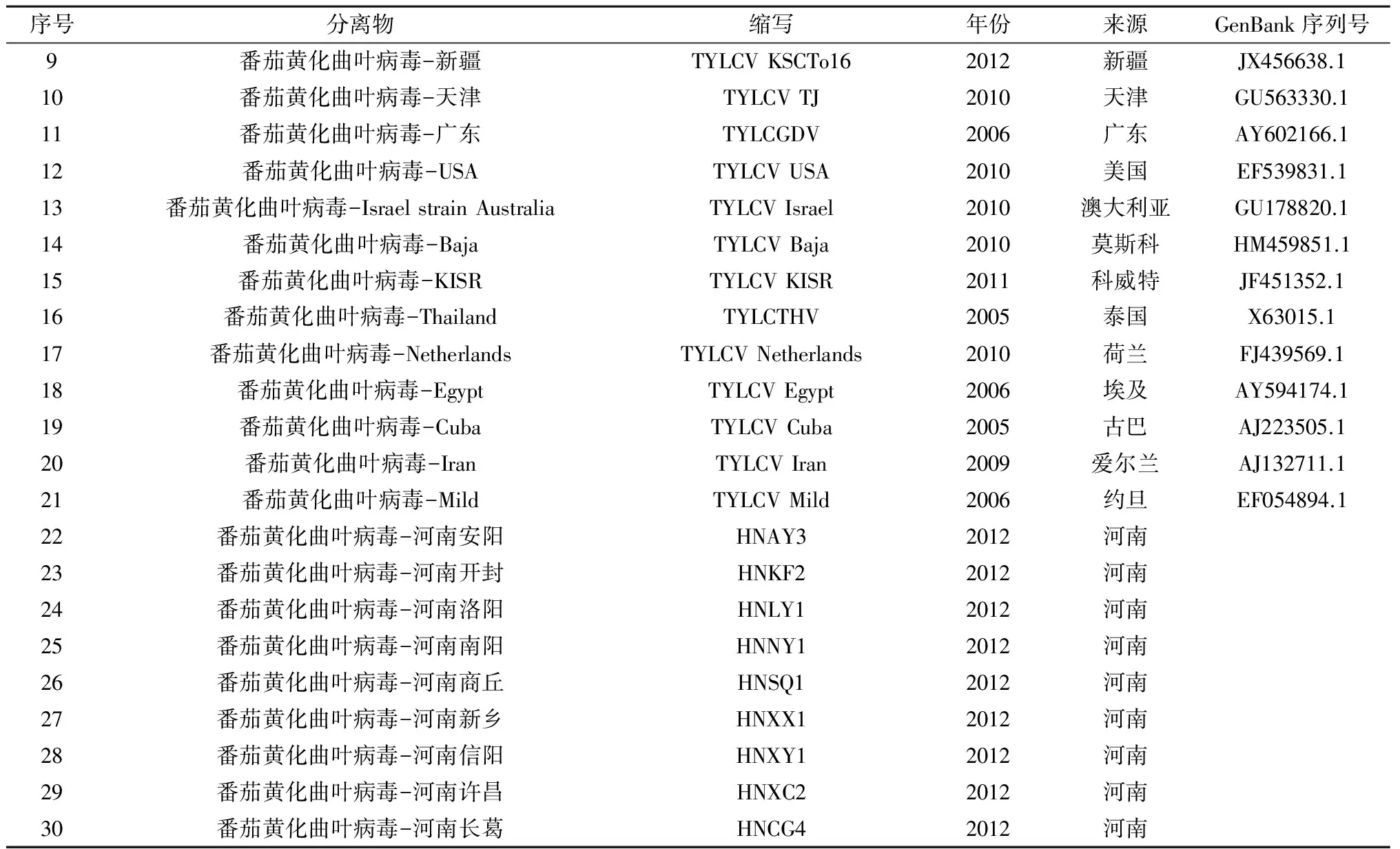
续表1 用于构建系统发育树的30种TYLCV分离物
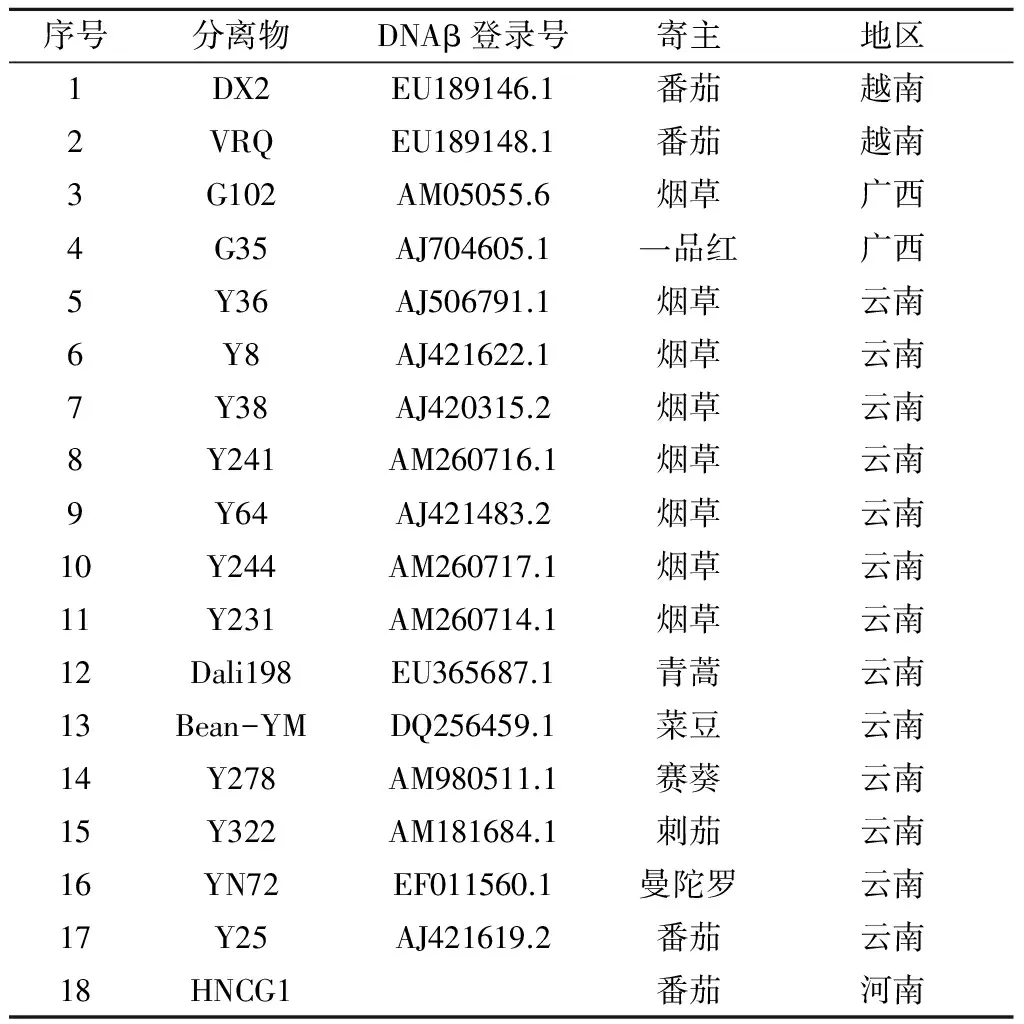
表2 用于序列比较的TYLCV分离物及伴随的卫星DNA
2 结果与分析
2.1 病毒分离物HNCG4基因组DNA-A结构
以提取的HNCG1、HNCG2、HNCG3和HNCG4基因组DNA为模板,PA和PB为扩增引物,PCR扩增后电泳检测,均得到约500 bp的特异性条带。对产物进行纯化克隆并测序,发现HNCG1、HNCG2、HNCG3和HNCG4中这一段序列同源性高达99%,故此推测它们为同一双生病毒的不同分离物。选取其中HNCG4进行全序列测定,拼接后发现,HNCG4 DNA-A全长2 781 bp,具有典型的Begomovirus属病毒的基因组结构特征,共编码6个开放阅读框(open reading frame,ORFs)。其中,病毒链编码2个ORFs,即AV1(308—1 084 bp,编码CP)和AV2(148—498 bp,编码病毒移动相关蛋白),互补链编码4个ORFs,分别为AC1(1 542—2 615 bp,编码复制酶)、AC2(1 226—1 633 bp,编码转录激活蛋白)、AC3(1 081—1 485 bp,编码复制增强蛋白)和AC4(2 171—2 464 bp,编码复制或转录调控因子)。在基因AC1与AV2之间有313 bp的IR序列,该区含有保守序列TAATATTAC、TATA box、正向重复序列GGTGTCT。
2.2 HNCG4 DNA-A与其他TYLCV分离物的同源性比较
TYLCV的株系有TYLCV-Israel、TYLCV-Mild及TYLCV-Iran等[17]。通过对分离物DNA-A基因组全序列同源性比对,发现HNCG4分离物与TYLCV-Israel株系同源性高达98.7%,远高于与其他株系的同源性(92%以下)。依据同种双生病毒基因组序列同源性大于94%被认为是同一株系的不同变种[18],认为采自河南省长葛市的HNCG4分离物属于TYLCV-Israel株系。
基于DNA-A全序列构建HNCG4分离物与其他已报道各分离物的系统进化树(图1),可以得知HNCG4 DNA-A与TYLCV省内分离物(HNSQ1、HNNY1、HNLY1、HNQX)及其临近省份的河北分离物(TYLCV-LF)、北京分离物(TYLCV BJ3)亲缘关系较近,序列同源性均达99%,而与其他分离物的DNA-A亲缘关系较远。

图1 基于DNA-A全序列构建的TYLCV
2.3 病毒伴随的DNAβ分子结构及与其他已报道DNAβ的同源性比较
利用特异引物β01/β02对DNAβ全长进行PCR扩增,从分离物HNCG1和HNCG4中均得到一特异性条带,长约1.3 kb,说明分离物HNCG1和HNCG4均伴随有卫星DNAβ。序列测定表明,HNCG1和HNCG4 DNAβ序列全长均为1 347 bp,两者序列相似性为100%。基因组的结构分析表明,HNCG样品中病毒卫星DNAβ具有一般双生病毒的卫星基因组结构特征(图2):互补链编码一个由113个氨基酸组成的βC1蛋白;一个相对保守的区域——卫星病毒保守区域(SCR),保守9核苷酸序列TAATATT/AC在其3′端;基因组764—1 001 bp处有一个腺嘌呤(A)的富集区域(A-rich区),A的重复数最高为11个(位于898—908 bp)。除茎环结构TAATATT/AC外,DNAβ与其辅助病毒DNA-A
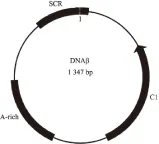
1指保守9核苷酸序列TAATATT/AC的切割位点
基因组序列之间基本没有同源性。
HNCG1 DNAβ与其他TYLCV分离物DNAβ的全序列同源性比较表明,它与来自越南的TYLCV分离物VRQ、DX2伴随卫星DNA分子的同源性较高,分别为87%、88%,并与其聚为一支(图3),而与其他双生病毒DNAβ的同源性均在71%以下,并且,该样品的卫星DNAβ序列与中国其他番茄黄化曲叶病毒分离物伴随的卫星DNAβ序列同源性均较低。
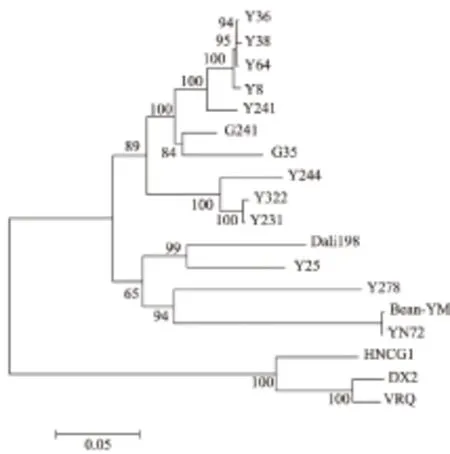
图3 基于DNAβ全序列构建的系统进化树
3 结论与讨论
从河南省长葛市番茄上分离到HNCG1、HNCG2、HNCG3和HNCG4分离物,用PA和PB即双生病毒简并引物进行PCR扩增,均得到约500 bp片段,且4个序列之间同源性高达99%,推测它们可能为同一病毒。分析HNCG4 DNA-A序列和BLAST比对发现,HNCG4 DNA-A与TYLCV省内分离物及其临近省份的河北分离物、北京分离物亲缘关系较近,序列同源性均达99%。双生病毒科病毒全基因组核苷酸序列之间,如果同源性小于89%,一般被认为是不同病毒;如果大于89%,可认为是同一病毒的不同株系[19]。由此,认为HNCG4是TYLCV的一个分离物,TYLCV是引起河南番茄黄化曲叶病的主要病原[7]。
PCR检测结果表明,HNCG1和HNCG4还伴随有卫星DNA分子。近年来,有关单组分双生病毒伴随有卫星DNA分子的报道不断增多[20-23]。同种双生病毒的卫星DNA分子之间序列同源性达72%~99%,而不同双生病毒的卫星DNA分子之间序列同源性为36%~57%[10]。HNCG1和HNCG4伴随的卫星DNA分子与已报道的TYLCV越南分离物DX2、VRQ伴随的卫星DNA分子序列同源性分别为88%、87%,因此,HNCG1和HNCG4伴随的卫星DNA分子与TYLCV越南分离物DX2、VRQ为同种双生病毒的卫星DNA分子。
本研究仅在HNCG1和HNCG4分离物中检测到伴随DNAβ的现象,而在HNCG2和HNCG3分离物内未检测到。另外,采自河南省不同地区的59份分离物中,除了HNCG1和HNCG4以外,也均未检测到DNAβ的存在[12],这也许是大田中TYLCV致病不一定都需要卫星DNA分子的伴随。之前已有一些相似的报道,云南烟草曲叶病毒(tobacco leaf curl Yunnan virus,TbLCYNV)[24]和广西番茄曲叶病毒(tomato leaf curl Guangxi virus,ToLCGxV)[25]仅有一部分分离物伴随有卫星DNA分子,并且卫星DNA分子也未加重症状的表现。
张辉[13]在对侵染我国番茄双生病毒种类鉴定过程中发现,侵染河南番茄的病毒除TYLCV以外,还有中国番木瓜曲叶病毒(papaya leaf curl China virus,PaLCuCNV),并且该病毒伴随有卫星DNAβ。因此,有关河南省内番茄病毒病的病原类型以及是否存在伴随DNAβ,还有待进一步的病毒样品采集及分子检测。通过对双生病毒及其伴随卫星进行检测,能够进一步提高对双生病毒发病情况的关注度,有利于预防该病毒病在河南省内大面积暴发。另外,有关HNCG1和HNCG4分离物中伴随的卫星DNA分子在TYLCV致病中的作用,也有待做进一步的研究。
[1] Harrison B D,Robinson D J.Natural genomic and antigenic variation in whitefly-transmitted geminiviruses(begomoviruses)[J].Annual Review of Phytopathology,1999,37:369-398.
[2] Moffat A S.Plant pathology: Geminiviruses emerge as serious crop threat[J].Science,1999,286:1835.
[3] Zhou X P,Liu Y L,Robinson D J,etal.Four DNA-A variants among Pakistani isolates of cotton leaf curl virus and their affinities to DNA-A of geminivirus isolates from okra[J].Journal of General Virology,1998,79:915-923.
[4] Zhou X P,Xie Y,Zhang Z K.Molecular characterization of a distinct begomovirus infecting tobacco in Yunnan,China[J].Archives of Virology,2001,146:1599-1606.
[5] 谢艳,周雪平,张仲凯,等.从云南分离的烟草曲顶病毒为菜豆金色花叶病毒属的一个新种[J].科学通报,2001,46(17):1459-1462.
[6] 洪益国,蔡健和,王小凤,等.中国南瓜曲叶病毒: 一个双生病毒新种[J].中国科学(B辑),1994,24(7):608-613.
[7] 黄狮,纠敏,李萌,等.河南省番茄黄化曲叶病毒的分子鉴定及序列分析[J].河南农业科学,2014,43(7):85-89.
[8] Rybick E P,Briddon R W,Brown J K,etal.Family Geminiviridae[C]//Van Regenmortel M H V,Fauquet C M,Bishop D H L,etal.Virus taxonomy:Seventh report of the international committee on taxonomy of viruses.New York:Academic Press,2000:285-297.
[9] Lazarowitz D G.Geminiviruses: Genome structure and gene function[J].Critical Reviews in Plant Sciences,1992,11(4):327-349.
[10] Zhou X P,Xie Y,Tao X R,etal.Characterization of DNAβ associated with begomoviruses in China and evidence for co-evolution with their cognate viral DNA-A[J].Journal of General Virology,2003,84:237-247.
[11] 孙海霞,季英华,熊如意,等.2008年侵染江苏省番茄的粉虱传双生病毒发生分布[J].江苏农业学报,2009,25(6):1278-1281.
[12] 黄狮.河南省番茄上双生病毒的分子鉴定[D].洛阳: 河南科技大学,2014.
[13] 张辉.侵染我国番茄双生病毒种类鉴定及致病性分析[D].杭州: 浙江大学,2009.
[14] 刘玉乐,蔡健和,李冬令,等.中国番茄黄化曲叶病毒——双生病毒的一个新种[J].中国科学(C辑),1998,28(2):148-153.
[15] 谢艳,张仲凯,李正和,等.粉虱传双生病毒的TAS-ELISA及PCR快速检测[J].植物病理学报,2002,32(2):182-186.
[16] 谢艳,周雪平,李正和,等.与烟草曲叶病毒伴随的新型DNA分子鉴定[J].科学通报,2002,47(10): 768-771.
[17] Wu J B,Dai F M,Zhou X P.First report of tomato yellow leaf curl virus in China[J].Plant Disease,2006,90:1359.
[18] Fauquet C M,Briddon R W,Brown J K,etal.Geminivirus strain demarcation and nomenclature[J].Archives of Virology,2008,153(4):783-821.
[19] Fauquet C M,Bisaro D M,Briddon R W,etal.Revision of taxonomic criteria for species demarcation in the family Geminiviridae,and an updated list of begomovirus species[J].Archives of Virology,2003,148:405-421.
[20] 徐幼平,周雪平.侵染广西烟草的中国番茄黄化曲叶病毒及其伴随的卫星DNA分子的基因组特征[J].微生物学报,2006,46(3):358-362.
[21] 李桂新,范三微,李正和,等.侵染云南白肋烟的中国番茄黄化曲叶病毒及伴随卫星DNA分子的基因组特征[J].农业生物技术学报,2003,11(5):525-530.
[22] 廖白璐,刘勇,谢艳,等.刺茄中分离的中国番茄黄化曲叶病毒及伴随的卫星DNA分子的全基因组结构[J].植物病理学报,2007,37(2):138-143.
[23] Yang X L,Guo W,Ma X Y,etal.Molecular characterization ofTomatoleafcurlChinavirus,infecting tomato plants in China,and functional analyses of its associated betasatellite[J].Applied and Environmental Microbiology,2011,77:3092-3101.
[24] Xie Y,Jiang T,Zhou X P.Agroinoculation shows tobacco leaf curl Yunnan virus is a monopartite begomovirus[J].European Journal of Plant Pathology,2006,115:369-375.
[25] Xu Y P,Cai X Z,Zhou X P.Tomato leaf curl Guangxi virus is a distinct monopartite begomovirus species[J].European Journal of Plant Pathology,2007,118:287-294.
Genomic Characterization of DNA-A and Associated Satellite DNA Molecule of Tomato Yellow Leaf Curl Virus Infecting Tomato in Henan
WANG Haoquan,JIU Min*,WANG Lunji,QIU Zhijun,HUANG Shi,ZHANG Min
(College of Food and Bioengineering,Henan University of Science and Technology/Luoyang Engineering and Technology Research Center of Microbial Fermentation,Luoyang 471023,China)
Four virus isolates including HNCG1,HNCG2,HNCG3 and HNCG4 were obtained from tomato plants showing leaf curl symptom in Changge city,Henan province.In order to clear the pathogens and find out the genetic relationship between each other,PCR was adopted firstly to detect the tomato samples using degenerate primers for geminiviruses.A 500 bp fragment was obtained from all the samples,and the nucleotide sequence identity between the four isolates reached 99%.The complete DNA-A sequence of HNCG4 was determined to be 2 781 bp.Comparisons showed that the DNA-A of HNCG4 had the highest sequence identity(99%) with that of tomato yellow leaf curl virus(TYLCV) isolates HNSQ1,HNNY1,HNLY1,HNQX from Henan,and TYLCV LF,TYLCV BJ3 isolated from adjacent Hebei and Beijing,respectively.PCR analysis demonstrated that isolates HNCG1 and HNCG4 were associated with DNAβ component of 1 347 bp,but isolates HNCG2 and HNCG3 were not.Sequence comparisons revealed that DNAβ of HNCG1 and HNCG4 was 100% similar to each other,and they shared the highest sequence identity(88%) with that of TYLCV Vietnam isolate DX2.In conclusion,leaf curl symptom of tomato in Changge city was caused by TYLCV,and partial isolates of the virus were associated with DNAβ molecule.
tomato yellow leaf curl virus; DNA-A; DNAβ; geminivirus; tomato
2016-02-19
国家自然科学基金项目(31101443); 河南省科技攻关计划项目(122102110197)
王浩权(1991-),男,河南登封人,在读硕士研究生,研究方向:烟粉虱与双生病毒的互作机制。 E-mail:664366923@qq.com
*通讯作者:纠 敏(1971-),女,河南杞县人,副教授,博士,主要从事烟粉虱与双生病毒的互作机制研究。 E-mail:jiumin0912@163.com
S436.412.1
A
1004-3268(2016)10-0071-06
