河南省大蒜病毒病的分子检测
2016-02-06孙新艳史亚娟王振跃燕照玲
孙新艳,史亚娟,王振跃,燕照玲,孙 虎*,施 艳*
(1.河南农业大学 植物保护学院,河南 郑州 450002; 2.河南省农业科学院,河南 郑州 450002)
河南省大蒜病毒病的分子检测
孙新艳1,史亚娟1,王振跃1,燕照玲2,孙 虎2*,施 艳1*
(1.河南农业大学 植物保护学院,河南 郑州 450002; 2.河南省农业科学院,河南 郑州 450002)
为了明确引起河南省大蒜病毒病的病原,采用RT-PCR方法对采集的表现矮缩症状的大蒜样品分别用5对引物进行检测,结果表明,在大蒜样品中同时检测到洋葱黄矮病毒(onion yellow dwarf virus,OYDV)、韭葱黄条病毒(leek yellow stripe virus,LYSV)和青葱潜隐病毒(shallot latent virus,SLV)3种病毒,没有检测到大蒜普通潜隐病毒(garlic common latent virus,GarCLV)和青葱X病毒(allexiviruses)。根据测序结果进行序列和遗传进化分析发现,河南省OYDV分离物与SLV分离物在进化树上都单独形成一分支,其中OYDV与其他分离物的核苷酸同源性为94.8%~96.9%,SLV与其他分离物的核苷酸同源性在86.5%~88.5%,河南省LYSV分离物与墨西哥分离物的同源性达到99.4%,亲缘关系最近。试验中同时检测到3种病毒,说明河南省大蒜病毒病为多种病毒复合侵染。
大蒜病毒病; 分子检测; 序列分析; 河南省
大蒜为百合科葱属多年生草本植物,营养丰富,可食用或供调味,亦可入药,具有很高的食用价值和医药价值,备受消费者和国际医学界的青睐,其经济价值不可小觑[1]。我国栽培大蒜的历史由来已久,河南省是我国大蒜的重要产区。大蒜在生长和储存中易感染多种病毒[2],目前已报道侵染大蒜的病毒有洋葱黄矮病毒(onion yellow dwarf virus,OYDV)、韭葱黄条病毒(leek yellow stripe virus,LYSV)、青葱潜隐病毒(shallot latent virus,SLV)、大蒜普通潜隐病毒(garlic common latent virus,GarCLV)和青葱X病毒(allexiviruses)[3-4]。病毒的侵染会造成大蒜品质下降和严重减产,进而造成巨大的经济损失。
快速而高效的检测方法对大蒜病毒病的检测起着非常重要的作用。植物病毒检测方法有电子显微镜技术、血清学检测方法和分子生物学技术等。血清学发展迅速,但是在应用中受到多方面的限制,例如大蒜病毒病通常是复合侵染,检测时不易获得所有病毒的抗体。分子生物学技术是目前检测病毒灵敏度最高的方法,特异性强,并且检测结果准确率高。常用的分子生物学检测方法有聚合酶链式反应(PCR)技术、核酸斑点杂交技术和 dsRNA 电泳技术等[5-6],其中反转录聚合酶链式反应(RT-PCR)是目前病毒病分子检测中最常用的方法之一。
由于大蒜为无性繁殖作物,随着种植年限的增加,病毒病危害加重,给河南省大蒜产业的发展造成了严重的影响[7]。要从根本上解决病毒病的危害,鉴定病原尤为重要。本试验采用RT-PCR方法对河南省中牟大蒜产区感病的大蒜样品进行检测,以期明确河南省引起大蒜病毒病的病原,为该病毒病的监测和防控提供理论依据。
1 材料和方法
1.1 材料
供试样品:2015年8月在河南省中牟县采集表现矮缩症状的大蒜病样。
试剂及仪器:Trizol购自美国Ambion公司;M-MLV反转录酶购自美国Promega公司;ExTaqMix购自TaKaRa公司;PCR产物纯化试剂盒购自生工生物工程(上海)股份有限公司;PCR仪产自美国ABI公司; Alpha凝胶成像系统购自美国ProteinSimple公司。
1.2 方法
1.2.1 引物的设计与合成 根据已有的报道合成5对引物[8-9],分别用于检测OYDV、LYSV、SLV、allexiviruses、GarCLV,由南京金斯瑞生物技术有限公司合成。
表1 5对检测大蒜病毒病的引物

病毒引物名称序列(5'→3')片段大小/bpOYDVOYDV-FTAATGGCACATTTCAGTGATGC365OYDV-RTCCGTGTCCTCTTCCGTTGTLYSVLYSV-RTGCAGAACTGAGCATGGGTA404LYSV-FGTAAGGTTGGTTGTGCGTGTSLVSLV-FGAGCGAAAGTAGATTCAACAAAC592SLV-RCCTTATCAGACCCTCAAGTGGTallexivirusesAllexiviruses-FCCTGCTAAGCTATATGCTGA183Allexiviruses-RGTAAGTTTAGCGATATCAACGarCLVGarCLV-FAAATGTTAATCGCTAAACGACC451GarCLV-RCWRCCATTAAAACGTAGCAGC
1.2.2 大蒜样品总RNA的提取及RT-PCR扩增 利用Trizol法提取大蒜样品总RNA,通过1%的琼脂糖凝胶电泳分析总RNA,并通过Nanodrop 2000检测RNA的纯度和浓度。以总RNA为模板进行反转录,体系为:5×MLV Buffer 4 μL、10 mmol/L dNTP 1 μL、随机引物1 μL、RNasin 0.5 μL、RNA 4 μL、M-MLV 1 μL、DEPC H2O补足20 μL。以反转录产物cDNA为模板进行PCR扩增,20 μL反应体系为:ddH2O 8.6 μL、cDNA 1 μL、20 μmol/L 正向引物和反向引物各0.2 μL、ExTaqMix 10 μL;反应条件:94 ℃ 5 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 40 s,共35个循环。采用琼脂糖凝胶电泳检测PCR产物,纯化后送南京金斯瑞生物技术有限公司进行测序。
1.2.3 序列分析 测序结果采用NCBI网站中的BLAST程序nucleotide blast进行比对,经Clustal W进行同源性分析,运用MEGA 5.0软件采用邻接法构建系统进化树。
2 结果与分析
2.1 大蒜样品总RNA的纯度与浓度检测
将提取的大蒜总RNA进行琼脂糖凝胶电泳分析(图1),可见28S和18S条带清晰,说明提取的RNA纯度较好;进一步通过Nanodrop进行RNA纯度和浓度分析,2个样品的OD260/280接近2.0,OD260/230大于2.0,表明总RNA的纯度较高,质量浓度在600 ng/μL以上(表2),满足试验要求,可以用于进一步的分析。
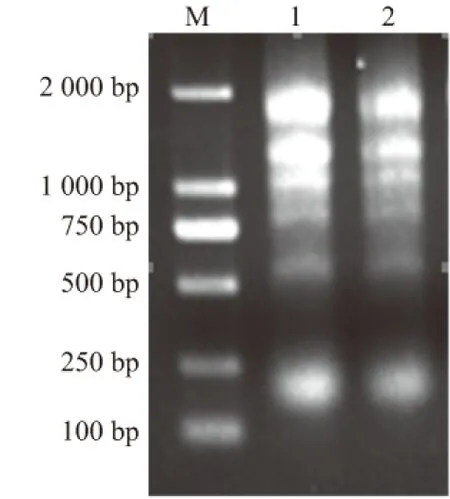
M为DL2000 DNA分子质量标准; 1、2为同一个样品的2个重复,下同
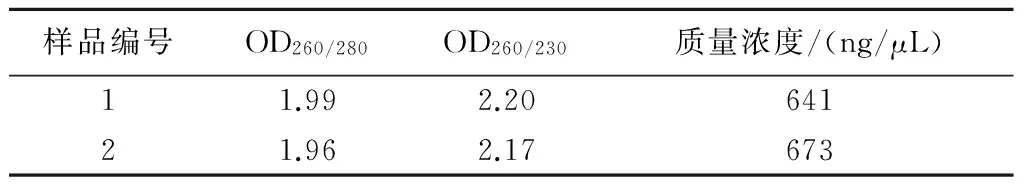
样品编号OD260/280OD260/230质量浓度/(ng/μL)11.992.2064121.962.17673
2.2 大蒜样品的RT-PCR扩增
以反转录得到的cDNA为模板,分别用每对引物对2个样品进行PCR扩增,电泳检测结果显示,能够扩增出365 bp、404 bp、592 bp的条带,分别与OYDV、LYSV和SLV目标条带大小对应(图2),在2个样品中均未扩增出GarCLV和allexiviruses的对应条带。说明在发病的大蒜样品中检测到OYDV、LYSV和SLV,而未检测到GarCLV和allexiviruses。
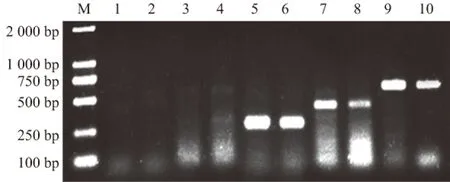
M:DL2000 DNA分子质量标准; 1、2:采用allexiviruses引物扩增;3、4:采用GarCLV引物扩增; 5、6:采用OYDV引物扩增;7、8:采用LYSV引物扩增; 9、10:采用SLV引物扩增
2.3 病毒的遗传进化分析
根据NCBI BLAST分析,OYDV河南分离物(GenBank:KU170218)与其他分离物的核苷酸同源性为94.8%~96.9%,从系统进化树(图3)中可以看出河南省OYDV分离物与其他分离物处于不同的分支,说明河南省OYDV分离物变异相对较大。LYSV河南分离物(GenBank:KU170217)与墨西哥分离物(GenBank:KF597283)和中国分离物(GenBank:DQ299382)的核苷酸同源性分别为99.4%和98.3%,与其他分离物的同源性均低于90%,在进化树上与墨西哥分离物位于同一分支,亲缘关系较中国分离物近(图4)。SLV河南分离物(GenBank:KU170216)与其他分离物的核苷酸同源性在86.5%~88.5%,处于不同的分支(图5),说明河南省SLV分离物与其他地区分离物之间的变异较大[10-13]。

图3 河南省OYDV分离物的系统进化树

图4 河南省LYSV分离物的系统进化树

图5 河南省SLV分离物的系统进化树
3 结论与讨论
本试验利用5对引物对大蒜样品进行RT-PCR检测,结果在大蒜病样中同时检测到OYDV、LYSV 和SLV 3种病毒,未检测到GarCLV和allexiviruses的存在。Chen等[14]在中国24省28份大蒜花叶症状样品中都同时检测到了SLV、LYSV和OYDV,与本试验的结果一致。Hu等[8]在湖南大蒜病毒病样品中检测到allexiviruses、OYDV、LYSV和SLV,检测率分别为50.9%、40.3%、28.3%和58.5%,在超过54%的样品中检测出2种以上病毒。张威等[15]的研究结果表明,在黑龙江省大蒜病毒病田间样品中LYSV、GarCLV、OYDV、SLV、GarLV(garlic latent virus,大蒜潜隐病毒)的检出率分别为95%、86%、74%、50%、78%,其中LYSV、GarCLV和GarLV的检出率较高。说明大蒜病毒病在田间危害主要是以复合侵染为主[16],不同地区占优势地位的病毒有所区别,这可能与不同地区病毒的寄主范围和介体差别有关。本研究中检测到了3种病毒的混合侵染,下一步需扩大检测范围,进一步确定河南省大蒜上的优势病毒种类。通过鉴定河南省大蒜病毒病的病原,将有利于积极有效地防控大蒜病毒病,并为大蒜病毒病的深入研究奠定基础。
[1] 潘月红.我国大蒜产业发展分析与展望[J].中国食物与营养,2012,18(9):22-26.
[2] 孔素萍,段乃彬,曹齐卫,等.大蒜鳞茎盘培养诱导簇生芽和微鳞茎[J].天津农业科学,2010,16(2):152.
[3] 徐培文,刘宪华,曲士松,等.中国主要大蒜品种和品系的病毒检测[J].山东农业科学,2000(2):27-28.
[4] 刘晓雪,程智慧.大蒜种质超低温保存及脱毒技术研究进展[J].中国蔬菜,2013(2):12-19.
[5] 金羽,文景芝.植物病毒检测方法研究进展[J].黑龙江农业科学,2005(3):37-40.
[6] 刘沛然,王四清.建兰花叶病毒及齿兰环斑病毒的检测方法[J].热带作物学报,2009,30(1):99-103.
[7] 佟广涛.大蒜种性退化原因及防止措施[J].现代农业科技,2010(17):151,153.
[8] Hu X X,Lei Y,Wang P,etal.Development of a multiplex reverse transcription-PCR assay for simultaneous detection of garlic viruses[J].Journal of Integrative Agriculture,2015,14(5):900-908.
[9] Majumder S,Baranwal V K.Simultaneous detection of four garlic viruses by multiplex reverse transcription PCR and their distribution in Indian garlic accessions[J].Journal of Virological Methods,2014,202:34-38.
[10] 黄狮,纠敏,李萌,等.河南省番茄黄化曲叶病毒的分子鉴定及序列分析[J].河南农业科学,2014,43(7):85-89.
[11] Conci V C,Canavelli A,Lunello P,etal.Yield losses associated with virus-infected garlic plants during five successive years[J].Plant Disease,2003,87(12):1411-1415.
[12] 刘瑞丽,袁媛,王振跃,等.引起玉米粗缩病的水稻黑条矮缩病毒河南分离物的分子特征[J].植物病理学报,2015,45(1):101-105.
[13] Park K S,Bae Y J,Jung E J,etal.RT-PCR-based detection of six garlic viruses and their phylogenetic relationships[J].Journal of Microbiology and Biotechnology,2005,15(5):1110-1114.
[14] Chen J,Chen J,Adams M J.Molecular characterization of a complex mixture of viruses in garlic with mosaic symptoms in China[J].Arch Virol,2001,146:1841-1853.
[15] 张威,白艳菊,申宇,等.黑龙江省大蒜病毒病原鉴定及病毒病发生情况调查[J].东北农业大学学报,2010,41(7):21-26.
[16] 周桂珍,曹鸣庆,裘季燕,等.京郊大蒜病毒病的研究及其鳞茎中病毒的脱除[J].植物病理学报,1989,19(3):145-149.
Molecular Detection of Garlic Virus Disease in Henan Province
SUN Xinyan1,SHI Yajuan1,WANG Zhenyue1,YAN Zhaoling2,SUN Hu2*,SHI Yan1*
(1.College of Plant Protection,Henan Agricultural University,Zhengzhou 450002,China; 2.Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
To determine the pathogen causing garlic dwarf,garlic samples showing dwarf symptom were collected for RT-PCR analysis using five primer pairs.The results showed that onion yellow dwarf virus (OYDV),leek yellow stripe virus (LYSV) and shallot latent virus (SLV) were detected in the sample,while garlic common latent virus (GarCLV) and shallot X virus (allexiviruses) were not found.According to the sequence and genetic evolution analysis,OYDV and SLV Henan isolates both belonged to a separate branch with the nucleotide homology with other isolates between 94.8% and 96.9% for OYDV and between 86.5% and 88.5% for SLV.LYSV Henan isolate was closely related to Mexio isolate with the homology of 99.4%.This test simultaneously detected three kinds of viruses,indicating that garlic virus disease in Henan was induced by complex infection of a variety of viruses.
garlic virus disease; molecular detection; sequence analysis; Henan province
2015-10-23
河南省高等学校青年骨干教师资助计划项目(2014GGJS-037)
孙新艳(1991-),女,河南登封人,在读硕士研究生,研究方向:植物病毒学。E-mail:xinyansun123@163.com
*通讯作者:孙 虎(1980-),男,河南驻马店人,副研究员,博士,主要从事植物真菌病害研究。 E-mail:clearshu167@163.com; 施 艳(1981-),女,江苏太仓人,副教授,博士,主要从事植物病毒与寄主互作研究。 E-mail:shiyan00925@126.com
S436.33
A
1004-3268(2016)03-0102-04
