郑州市宠物源大肠杆菌生物被膜表型与耐药谱型分析
2016-02-06兰亚莉
兰亚莉
(河南省农业科学院 畜牧兽医研究所,河南 郑州 450002)
郑州市宠物源大肠杆菌生物被膜表型与耐药谱型分析
兰亚莉
(河南省农业科学院 畜牧兽医研究所,河南 郑州 450002)
为分析郑州市宠物源大肠杆菌的生物被膜表型与耐药谱型,分别采用微量肉汤稀释法和改良结晶紫法对194株宠物源大肠杆菌进行耐药率和生物被膜形成能力检测。结果表明,弱生物被膜表型菌株比例最高,占63.4%;耐药谱多样性是造成生物被膜形成能力差异的主要原因,但耐药谱中抗菌药物种类对生物被膜表型能力的影响不明显。
大肠杆菌; 生物被膜表型; 耐药谱型
大肠杆菌是人和动物的主要共生菌之一,抗原性复杂,血清型多样,已经成为宠物最主要的感染病原,其造成的感染分为肠道感染和肠道外感染,大肠杆菌肠道外感染引起的疾病临床症状和病理变化多样,如尿道感染、腹膜炎、伤口感染、肺炎、败血症等。随着广谱抗生素的广泛应用,甚至是滥用,大肠杆菌的耐药现象呈逐年加重趋势,给临床大肠杆菌感染疾病的治疗带来了很大困难,导致感染持续发展。在兽医临床领域,越来越多的感染如手术感染、呼吸系统感染和泌尿生殖系统感染都与生物被膜的形成有关。Fletcher等[1]研究发现,大肠杆菌能够形成生物被膜,使得大肠杆菌能够利用自身分泌的多糖基质、纤维蛋白、脂蛋白等多糖蛋白的复合物,使其相互粘连并将其自身克隆聚集缠绕其中,以对抗不利的环境,逃避抗生素的杀死或机体免疫系统的清除作用,从而造成机体的持续性感染[2-3]。本试验通过药物敏感性试验和生物被膜形成能力分析,探讨宠物源性大肠杆菌的耐药性及其与生物被膜形成的相关性,为兽医临床正确选择和使用抗菌药物提供参考和指导。
1 材料和方法
1.1 样本来源、培养基和抗菌药物
215个试验样本于2013年1月—2014年6月期间采自郑州市3家动物医院就诊的犬只(其中包括肛门拭子145个、尿液样本63个和鼻咽拭子7个)。 质控大肠杆菌菌株ACTT25922为西南民族大学生命科学与技术学院兽医药理实验室保存。MH肉汤、LB肉汤、15e肠杆菌科细菌生化编码鉴定管均购自杭州天和微生物试剂有限公司,试验中使用的抗菌药物购自中国兽药监察所。
1.2 方法
1.2.1 样本分离培养及鉴定 按照常规大肠杆菌分离方法对临床采集的215个样本进行大肠杆菌的分离、培养和生化鉴定。
1.2.2 药敏试验 按照美国临床试验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)推荐的微量肉汤稀释法操作程序进行[4]。
1.2.2.1 抗菌药物的配制 根据CLSI推荐的微量肉汤稀释法中抗菌药物的配制方法进行,试验前根据各抗菌药物的理化性质将其配置成母液质量浓度均为工作质量浓度的10倍备用(其中恩诺沙星、头孢噻呋母液质量浓度为640 μg/mL,阿莫西林、多西环素、氟苯尼考、链霉素、卡那霉素、氨苄西林的母液质量浓度为5 120 μg/mL,阿米卡星、安普霉素、庆大霉素、新霉素的母液浓度为5 120 U/mL)。
1.2.2.2 菌液的制备 将已纯化并鉴定的大肠杆菌在麦康凯琼脂平板上划线,培养12~16 h后,挑取3~5个相同的单菌落接种于3 mL LB肉汤,37 ℃静止培养过夜后,将菌液调到0.5麦氏比浊度,备用。
1.2.2.3 药敏试验 用多通道移液枪将灭菌MH肉汤加入到96孔细胞培养板中,除第1列每孔180 μL,其余各孔100 μL,然后将配制好的抗菌药工作液分别加入第1列的各孔,每孔20 μL,之后反复吹打,混匀药物后取100 μL移至第2列,依次稀释至第11列,这样每列的药物分别依次进行2倍稀释,第12列为阳性对照,每种药物做3个重复。将浓度相当于0.5麦氏比浊度的菌悬液,经MH肉汤1∶1 000稀释后向每孔加100 μL。密封后置于恒温培养箱中,37 ℃孵育12~16 h后判断结果。
1.2.2.4 结果判定 当阳性对照孔(不含抗生素)内细菌明显生长,以不出现浑浊孔所对应的最低药物质量浓度作为该药物的最小抑菌浓度(MIC)。
1.2.3 大肠杆菌生物被膜形成能力半定量分析 参照文献[4-7]的步骤略作改进,具体操作步骤如下:首先在无菌96孔平底组织培养板中加入200 μL经1∶100稀释的菌液,阴性对照加入相应量的TB肉汤。平板盖盖子后37 ℃培养24 h,之后弃去每孔内培养液,分别用250 μL灭菌PBS溶液漂洗3次。在洗涤过程中要剧烈甩动以彻底弃去孔内未粘附的浮游菌,孔壁上粘附的细菌用200 μL 99%甲醇固定15 min后弃去,室温自然风干。然后用200 μL 2%结晶紫染色5 min后弃去,将96孔微量培养板在流动的自来水下冲洗掉多余的染料。自然风干过夜,结合在孔内的染料用160 μL 33%冰乙酸溶解,用酶标仪测定各孔的OD570值。每株细菌接种4孔,所有的菌株进行3次重复并取其平均值作为最终的试验结果。根据OD570值的不同将生物被膜表型分为4组:OD570≤1ODC,无成膜能力(-);1ODC
2 结果与分析
2.1 菌株分离鉴定结果
采集的样本经过分离、纯化培养和生化鉴定,共分离出大肠杆菌194株,其中肠源145株,鼻咽源7株,尿道源42株。
2.2 分离菌株药敏试验结果
从图1可以看出,分离菌株对恩诺沙星、氟苯尼考、阿莫西林、氨苄西林、多西环素的耐药比例均超过70%,其中对氨苄西林耐药的占90.21%;对安普霉素、阿米卡星、庆大霉素、头孢噻呋耐药水平较低,分别占23.71%、21.13%、7.73%、36.08%。对链霉素、新霉素、卡那霉素耐药水平居中,分别占57.73%、41.75%、56.19%。
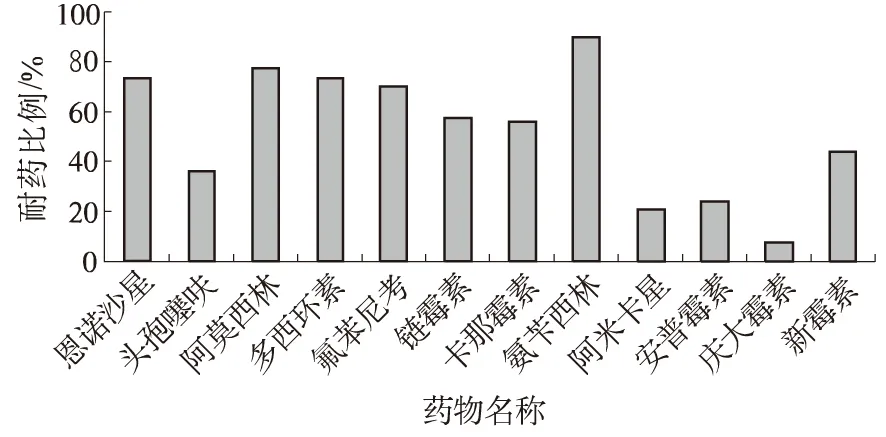
图1 分离大肠杆菌对试验药物的敏感性
2.3 不同来源大肠杆菌成膜能力分析
194株大肠杆菌生物被膜表型分析结果如表1所示。从表1可以看出,除了3株尿道源大肠杆菌表现出强生物被膜形成能力外,其他大肠杆菌主要呈现弱生物被膜表型,且在肠源大肠杆菌中,弱生物被膜表型菌株比例最高,占71.0%。而在肠源和鼻咽源分离的大肠杆菌中,没有表现出强生物被膜形成能力的菌株。
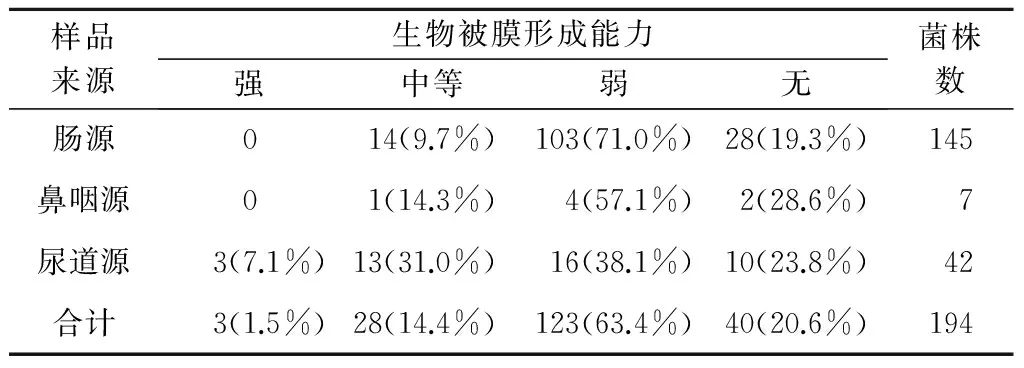
表1 不同来源大肠杆菌生物被膜形成能力
注:括号外为菌株数,括号内为百分比。
2.4 耐药谱分布与成膜能力表型相关性分析
强成膜能力组3株菌的耐药谱是4耐、7耐、9耐;中等成膜能力组的28株大肠杆菌耐药谱主要分布在7~10耐,7、8、9、10耐分别占中等成膜能力表型的17.86%、21.43%、14.29%、17.86%,共占71.43%;弱成膜能力组123株大肠杆菌耐药谱主要分布在5~10耐,5、6、7、8、9、10 耐药谱菌株分别占弱成膜能力表型的13.82%、13.01%、14.63%、12.20%、14.63%、13.82%,共占82.11%;无成膜能力组的40株大肠杆菌耐药谱主要分布在5~9耐,5、6、7、8、9耐药谱占无成膜能力表型的比例均在15%及以下,共占60.00%。
此外,本研究结果显示,强成膜能力菌株数的耐药谱比较分散,另外3个成膜表型的菌株耐药谱主要集中在5~10耐,其中,弱成膜能力和无成膜能力耐药谱型的菌株所占比例均不超过15%。可见,耐药谱多样性是造成生物被膜形成能力差异的主要原因,但耐药谱中抗菌药物种类对生物被膜表型能力的影响不明显。
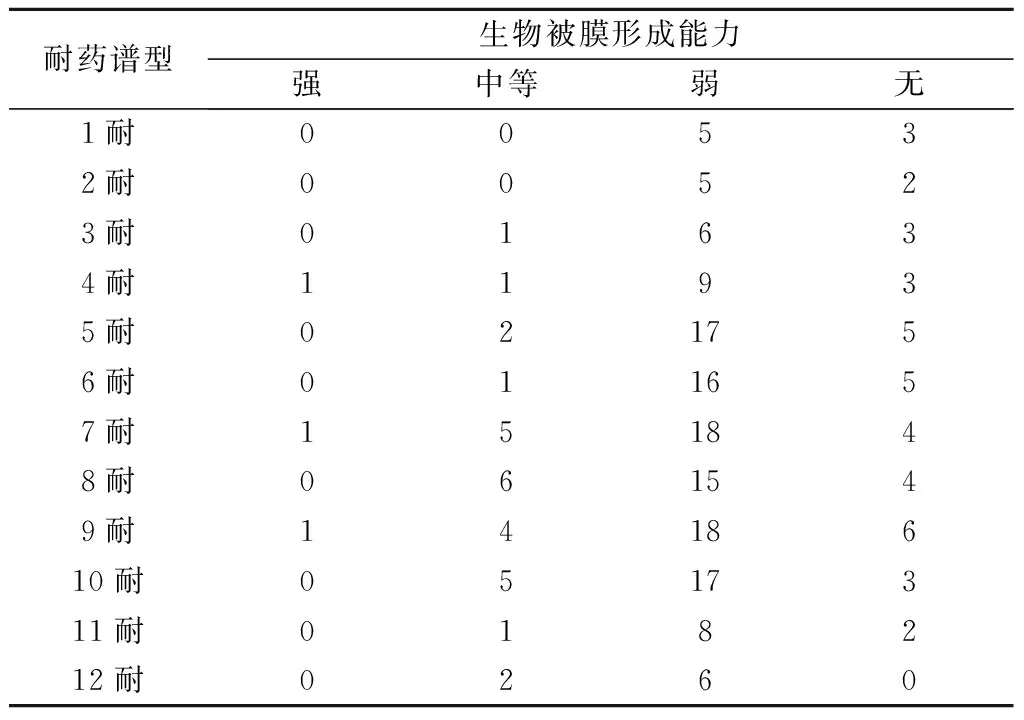
表2 不同生物被膜形成能力大肠杆菌的耐药谱型分析 株
3 结论与讨论
本研究结果初步反映了宠物治疗过程中大肠杆菌的耐药现象。大肠杆菌已经成为动物尿道炎性疾病的主要病原,而泌尿道感染也是进一步形成尿道结石的主要诱因[8-10]。在本研究采集的尿道炎症疾病的63个宠物尿样中,42例分离到大肠杆菌,占66.7%,应该引起临床重视。同时,在临床诊疗的过程中借助药敏试验筛选出敏感药物,可增加疾病的治愈率。试验结果表明,在采集样本的3家宠物医院,由于长期使用常用抗菌药物,使得70%以上分离的大肠杆菌对恩诺沙星、阿莫西林、氨苄西林等耐药,特别是对氨苄西林的耐药比例高达90.21%,提示在今后治疗大肠杆菌感染的过程中应避免使用耐药率较高的药物,尽量使用敏感药物,以提高治疗效果[11-13]。本研究结果表明,中等、弱、无成膜能力表型的大肠杆菌的耐药谱型数量无明显差异,耐药谱多样性可能是造成生物被膜形成能力差异的主要原因,但耐药谱中抗菌药物种类对生物被膜的表型能力的影响不明显。
[1] Fletcher M.The physiological activity of bacteria attached to solid surfaces[J].Adv Microbiol Physiology,1991,32(6):53-85.
[2] Patel R.Biofilms and antimicrobial resistance[J].Clin Orthop Relat Res,2005,437:41-47.
[3] Naves P,Delprado G,Hueives L,etal.Correlation between virulence factors andinvitrobiofilm formation byEscherichiacolistrains [J].Microb Pathog,2008,45:86-91.
[4] 陈国强,曹华英,姚振国,等.重症监护病房鲍氏不动杆菌的耐药性调查[J].中华医院感染学杂志,2011,21 (4):794-795.
[5] Stepanovic S,Cirkovic I,Ranin L,etal.Biofilm formation bySalmonellaspp.andListeriamonocytogeneson plastic surface[J].Letters Applied Microb,2004,38(5):428-432.
[6] 陈朝喜,廖晓平,朱恒乾,等.百余株宠物源性大肠杆菌的生物被膜表型与耐药谱型分析[J].中国兽医科学,2010,40(9):886-889.
[7] 陈朝喜,朱恒乾,廖晓萍,等.大肠埃希菌耐药谱型、基因型和生物膜表型关系研究[J].动物医学进展,2011,32(4):59-62.
[8] Stewart P S.Antimicrobial tolerance in biofilms[J].Microbiol Spectr,2015,3(3).Doi:10.1128/microbiolspec.
[9] Cao B,Christophersen L,Thomsen K,etal.Antibiotic penetration and bacterial killing in aPseudomonasaeruginosabiofilm model[J].Antimicrob Chemother,2015,70(7):2057-2063.
[10] Araújo PA,Mergulhão F,Melo L,etal.The ability of an antimicrobial agent to penetrate a biofilm is not correlated with its killing or removal efficiency[J].Biofouling,2014,30(6):675-683.
[11] Lebeaux D,Ghigo J M,Beloin C.Biofilm-related infections:Bridging the gap between clinical management and fundamental aspects of recalcitrance toward antibiotics[J].Microbiol Mol Biol Rev,2014,78(3):510-543.
[12] Vrany J D,Stewart P S,Suci P A.Comparison of recalcitrance to ciprofloxacin and levofloxacin exhibited byPseudomonasaeruginosabiofilms displaying rapid-transport characteristics[J].Antimicrob Agents Chemother,1997,41(6):1352-1358.
[13] Nikaido H.Multiple antibiotic resistance and efflux[J].Curr Opin Microbiol,1998,1(5):516-523.
Study on Biofilm Phenotype and Drug Resistance Pattern in Pet-broneE.coliin Zhengzhou
LAN Yali
(Insititute of Animal Husbandry and Veterinary Research,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
To study biofilm phenotype and drug resistance pattern in pet-broneE.coliin Zhengzhou,broth microdilution method and improved crystal violet method were used for antimicrobial agent susceptibility testing and biofilm-forming detection of 194 clinicalE.coliisolates.The results showed that the percentage of weak biofilm-forming ability strains was the highest,accounting for 63.4% and the diversity of drug resistance patterns was the key factor affecting biofilm-forming ability,while it was not so dramatic significant for biofilm-forming ability based on the antibiotic types in different drug resistance patterns.
E.coli; biofilm phenotype; drug resistance pattern
2015-08-20
河南省财政预算项目(20137919)
兰亚莉(1966-),女,陕西蒲城人,研究员,本科,主要从事宠物源人兽共患细菌病研究。 E-mail:yali2005haonan@sina.com
S855.1
A
1004-3268(2016)01-0135-03
