猪Tetherin基因的克隆及序列分析
2016-02-06李盈辉徐彦召孙林霞张庆帅徐亚茹
李盈辉,王 青,徐彦召,孙林霞,张庆帅,徐亚茹,田 柳
(河南科技学院 动物科学学院,河南 新乡 453003)
猪Tetherin基因的克隆及序列分析
李盈辉,王 青,徐彦召*,孙林霞,张庆帅,徐亚茹,田 柳
(河南科技学院 动物科学学院,河南 新乡 453003)
为研究猪Tetherin基因的功能,应用RT-PCR手段从感染猪繁殖与呼吸障碍综合征病毒的猪肺脏组织扩增得到猪源Tetherin基因,将其克隆到pMD19-T载体并进行测序,采用分子生物学软件将其编码的蛋白质序列与其他来源的Tetherin蛋白序列进行比对分析,采用真核转染的方法研究其在MARC-145细胞中的定位情况。结果显示,克隆得到的猪源Tetherin基因全长534 bp;猪源Tetherin蛋白与牛、绵羊、猫、人、黑猩猩、猫头鹰、猕猴Tetherin蛋白同源性分别为41.5%、44.1%、42.3%、43.7%、45.4%、35.6%、42.1%; 猪源Tetherin蛋白为跨膜蛋白,该蛋白定位在MARC-145细胞的细胞膜中。
猪;Tetherin基因; 序列分析
Tetherin蛋白,又称为CD317或BST-2,1995年最早从类风湿性关节炎骨髓液细胞系中克隆成功,研究发现,Tetherin蛋白在人骨髓瘤细胞中表达量极高,同时在终末分化的B细胞、T细胞、骨髓基质细胞、树突状细胞、巨噬细胞等与免疫相关的细胞,以及某些受到病毒感染的肿瘤细胞中均有表达[1-4]。近年来研究发现,Tetherin蛋白具有调节机体免疫细胞生长发育(如B细胞生长发育)和抗病毒的功能。研究者最早在人的艾滋病病毒(HIV)上证实了Tetherin蛋白具有抗病毒功能,Tetherin蛋白能够将艾滋病病毒颗粒粘附在母细胞的外膜上,阻止病毒继续感染相邻的靶细胞,进而阻止艾滋病病毒的扩散[5-8]。随后研究者进一步证实,Tetherin蛋白还可以抑制卡波氏肉瘤病毒(KSHV)、Ebola病毒、Lassa病毒和Marburg病毒等有包膜病毒的释放,进而发挥抗病毒功能[9-11]。
目前,关于人类Tetherin基因的研究较多[5-12],而关于猪源Tetherin基因的研究尚未见报道。为此,本研究依据已发表的人源Tetherin基因序列,设计特异性引物,通过RT-PCR方法获得了猪源Tetherin基因,分析了猪源Tetherin蛋白与其他来源Tetherin蛋白的差异性,并初步验证了其在MARC-145细胞中的分布情况,旨在为进一步研究Tetherin蛋白的生物学功能奠定基础。
1 材料和方法
1.1 载体、菌种和试剂
大肠埃希菌感受态细胞(K12)、MARC-145细胞、pEGFP-C3载体均由河南科技学院预防兽医学实验室自制和保存;M-MLV反转录酶、rTaq酶、dNTP、T4 DNA 连接酶、pMD19-T载体、DL2000 DNA Marker均购自宝生物工程(大连)有限公司;RNA提取试剂盒购自QIAGEN公司(美国);高糖DMEM培养基、胎牛血清、0.25%胰蛋白酶消化液、氨苄青霉素购自索莱宝生物科技有限公司;质粒DNA小量提取试剂盒和胶回收试剂盒均购自OMEGA公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1 猪源Tetherin基因的克隆 按RNA提取试剂盒说明书从感染猪繁殖与呼吸障碍综合征病毒的猪肺脏组织(来源于新乡市辉县某猪场送检的病料)细胞中提取总RNA。依据M-MLV产品说明书,以随机引物Oligo(dT)为反转录引物合成PCR扩增的第一链cDNA。反转录过程的反应体系:总RNA 21 μL,Oligo(dT)随机引物(50 μmol/L)2 μL,dNTP(10 mmol/L) 4 μL,RNase inhibitor 1 μL(20 U),M-MLV 4 μL(10 U),加5×M-MLV Buffer 8 μL,总反应体系为40 μL。反转录的反应程序为:42 ℃ 水浴1 h,95 ℃ 灭活 5 min,4 ℃保存,作为下一步PCR反应的模板。根据GenBank中已公布的Tetherin基因序列(NM_001161755)设计特异性扩增引物,上游引物(PIG-TE-UP):5′-ATGAATTCATGTCACCTAGTTTGTATTCC-3′,其下划线的序列为EcoR Ⅰ酶切位点;下游引物(PIG-TE-DP):5′-TTCTCGAGTCAGGTCAGCAGGGCA-TTGAG-3′,其下划线的序列为XhoⅠ酶切位点。猪源Tetherin基因的PCR扩增反应体系为:反转录产物11 μL,上、下游引物(PIG-TE-UP/DP)(10 μmol/L)各2 μL,dNTP(2.5 mmol/L) 4 μL,10×Buffer 5 μL,rTaq酶(2 U/μL) 1 μL,灭菌双蒸水25 μL,共计50 μL。PCR的反应条件为:94 ℃ 5 min;94 ℃ 30 s,62 ℃ 30 s,72 ℃ 30 s,共30个循环;最后72 ℃延伸5 min,4 ℃保存。PCR结束后取5 μL PCR产物进行琼脂糖凝胶电泳鉴定,观察PCR产物电泳条带的大小以及特异性。随后参照OMEGA公司的胶回收试剂盒说明书纯化回收Tetherin基因片段。
1.2.2 克隆载体的构建 将纯化好的Tetherin基因片段与pMD19-T载体连接,连接体系为:PCR纯化产物7 μL,pMD19-T载体 1 μL,10×T4 DNA连接酶Buffer 1 μL,T4 DNA连接酶1 μL,于16 ℃连接过夜。将连接产物转化至K12感受态细胞,在含有氨苄青霉素的LB培养基中37 ℃培养过夜。经氨苄青霉素抗性筛选和菌液PCR方法进行鉴定,提取鉴定为阳性的菌液质粒并将其送往生工生物(上海)股份有限公司测序鉴定,并将阳性质粒命名为pMD-Te。
1.2.3 猪源Tetherin蛋白的生物信息学分析 用DNASTAR和MEGA 5.0软件分析上述猪源Tetherin蛋白序列,用于比对的参考序列包括Uniprot蛋白质数据库上发表的牛、绵羊、猫、人、黑猩猩、猫头鹰及猕猴源Tetherin蛋白;运用在线的序列跨膜区预测软件TMHMM Server V.2.0(http://www.cbs.dtu.dk/services/TMHMM/)和SMART软件(http://smart.embl-heidelberg.de/)预测猪源Tetherin蛋白的跨膜区位置。
1.2.4 猪源Tetherin蛋白在MARC-145细胞中的表达 将获得的猪源Tetherin基因通过分子生物学手段克隆至真核表达载体pEGFP-C3中,经PCR扩增、双酶切鉴定正确后,将重组质粒转染MARC-145细胞验证其在细胞中的表达情况,具体转染步骤和方法参见文献[13]。转染48 h后,将细胞置于荧光显微镜下观察其表达情况及在MARC-145细胞中的定位情况。
2 结果与分析
2.1 猪源Tetherin基因的RT-PCR扩增结果
根据GenBank中已公布的Tetherin基因序列(NM_001161755),通过RT-PCR方法克隆猪源Tetherin基因(图1)。经电泳分析,得到了大小约为500 bp的片段。
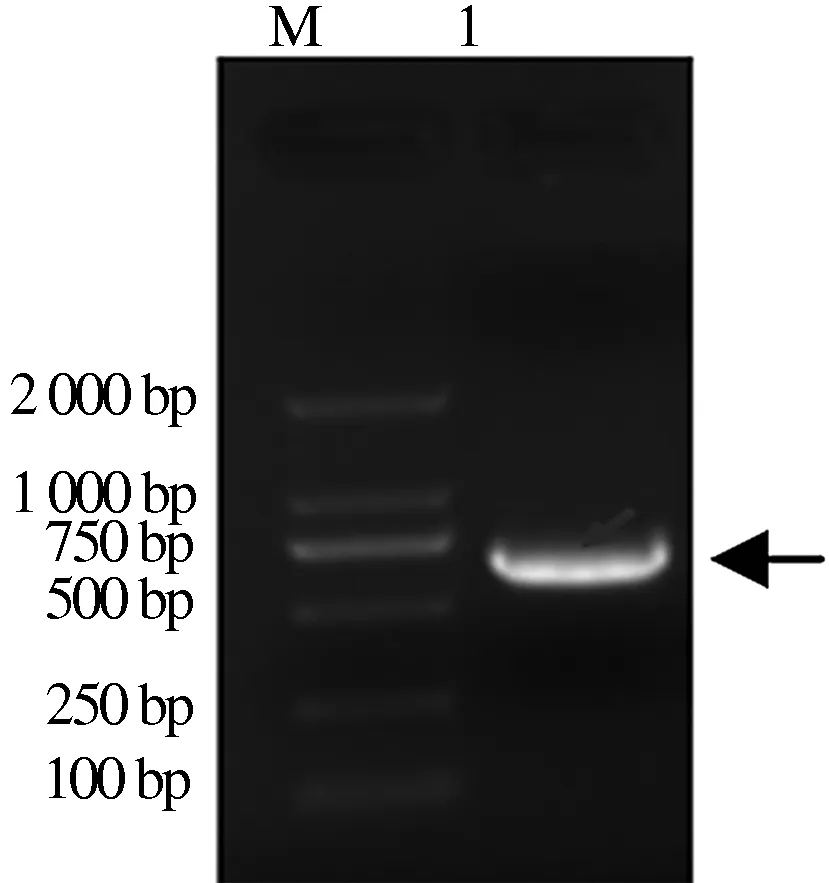
M.DNA标准DL2000; 1.Tetherin基因的RT-PCR扩增产物图1 Tetherin基因的RT-PCR扩增
2.2 重组载体的鉴定结果
运用PCR和双酶切(EcoR Ⅰ和XhoⅠ)方法对构建好的克隆载体pMD-Te进行鉴定,结果表明,该载体中含有符合预期大小的目的条带(图2),经测序鉴定,所得到的猪源Tetherin基因全长534 bp,共编码177个氨基酸。

M.DNA标准DL2000; 1.重组质粒pMD-Te双酶切鉴定; 2.重组质粒pMD-Te的PCR鉴定图2 重组质粒pMD-Te的鉴定
2.3 猪源Tetherin蛋白的生物信息学分析
将扩增到的猪源Tetherin基因序列翻译成蛋白质序列,并与Uniprot蛋白质数据库上近年来发表的牛、绵羊、猫、人、黑猩猩、猫头鹰、猕猴源Tetherin蛋白进行比较(图3),结果显示:猪源Tetherin蛋白序列与上述来源的Tetherin蛋白序列的同源性分别为41.5%、44.1%、42.3%、43.7%、45.4%、35.6%、42.1%。且不同来源的Tetherin蛋白长度也不相同,其中以猫头鹰的Tetherin蛋白最长(含有191个氨基酸),羊的Tetherin蛋白最短(含有156个氨基酸)。猪Tetherin蛋白比羊源Tetherin蛋白多21个氨基酸,但比其他来源的Tetherin蛋白均短。
对猪源Tetherin蛋白的跨膜区预测结果显示,Tetherin蛋白为跨膜蛋白,其中27—49位和154—176位氨基酸为其跨膜区所在位置,1—26位氨基酸为其胞外区,50—153位氨基酸为其胞内区(图4)。
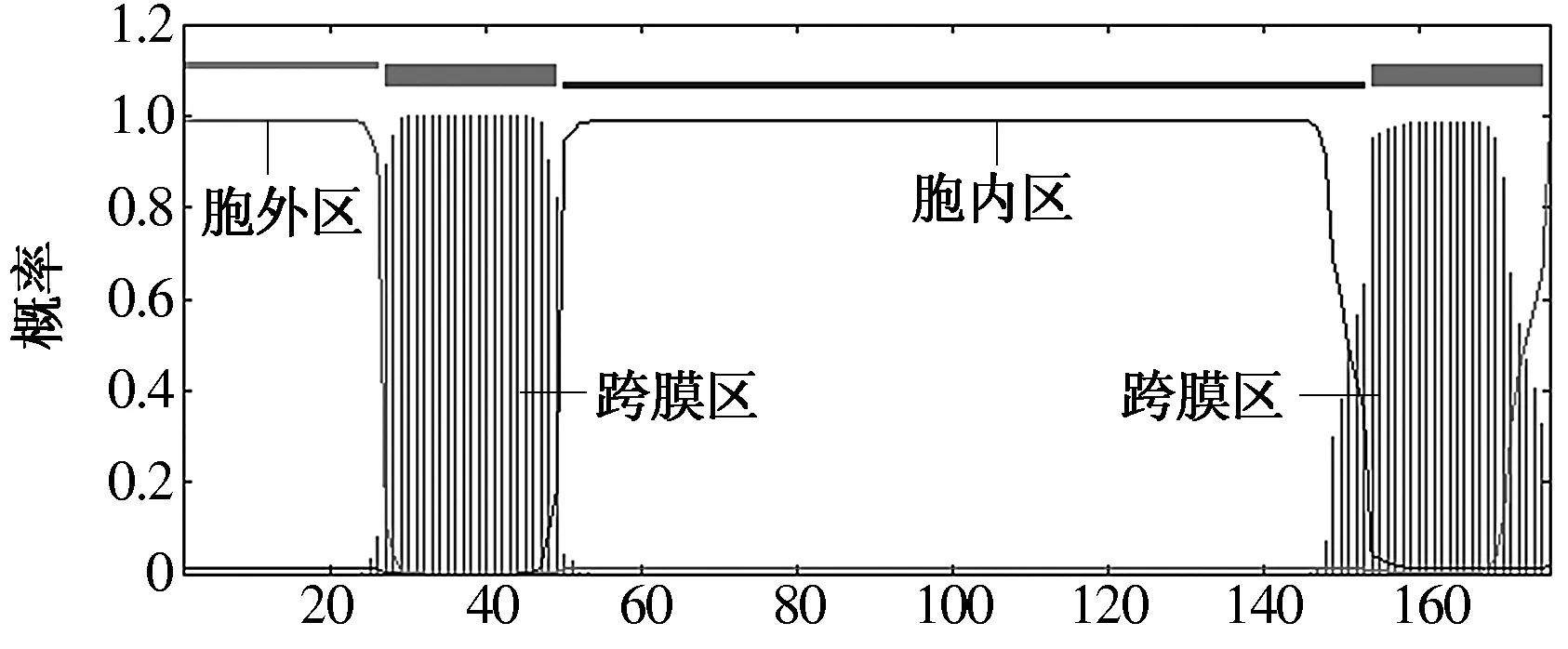
图4 Tetherin蛋白的跨膜区预测
2.4 猪源Tetherin蛋白在MARC-145细胞中的表达
由图5可以看出,转染重组质粒的细胞在荧光显微镜下显示出绿色荧光,且荧光主要分布于转染细胞的细胞膜上,而转染空载体的细胞中荧光分布均匀。
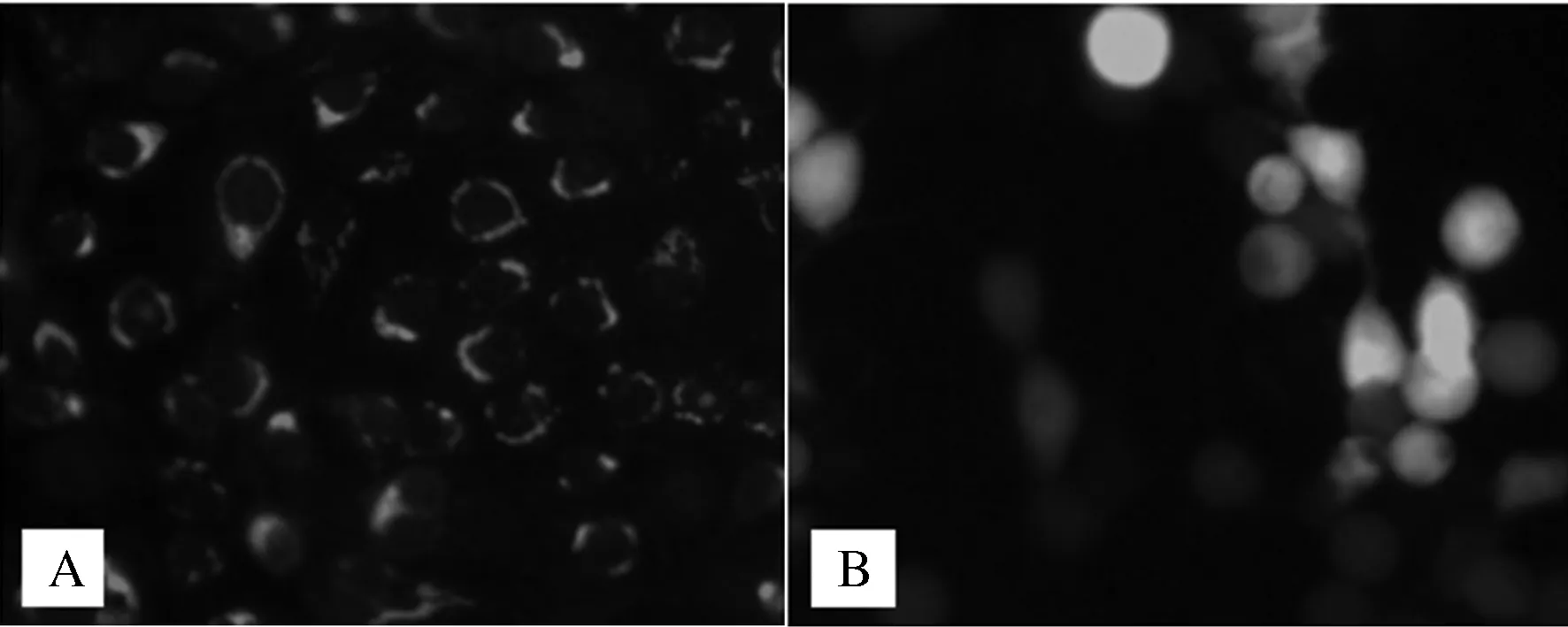
A.转染重组质粒的MARC-145细胞;B.转染空载体的MARC-145细胞图5 Tetherin蛋白在MARC-145细胞中的定位
3 结论与讨论
本研究成功克隆了猪源Tetherin基因(534 bp),编码177个氨基酸,比羊源Tetherin蛋白多21个氨基酸,但比其他来源的Tetherin蛋白均短。同源性分析显示,猪源Tetherin蛋白与其他来源的Tetherin蛋白同源性约为40%,这表明不同来源的Tetherin蛋白同源性较低。这种氨基酸序列上的差异可能是由于该蛋白在进化过程中正向选择的结果。分析发现,不同来源的Tetherin蛋白之间存在着保守的氨基酸位点,如亮氨酸(L)、天冬酰胺(N)、丝氨酸(S)、半胱氨酸(C)、谷氨酸(E)、精氨酸(R)及丙氨酸(A)等,这些保守的氨基酸位点可能与其发挥生物学功能直接相关[4,14]。因此,今后针对猪源Tetherin蛋白功能的研究可以围绕这些保守的位点开展。
Tetherin蛋白的抗病毒生物学功能主要是通过其膜定位的特性得以实现。本研究初步证明了猪源Tetherin蛋白的膜定位特性,为进一步研究Tetherin蛋白对动物源性病毒的作用以及开发动物抗病毒药物奠定基础。
[1] Rollason R,Korolchuk V,Hamilton C,etal.Clathrin-mediated endocytosis of a lipid-raft-associated protein is mediated through a dual tyrosine motif[J].J Cell Sci,2007,120(Pt 21):3850-3858.
[2] Kupzig S,Korolchuk V,Rollason R,etal.Bst-2/HM1.24 is a raft-associated apical membrane protein with an unusual topology[J].Traffic,2003,4(10):694-709.
[3] Neil S J,Zang T,Bieniasz P D.Tetherininhibits retrovirus release and is antagonized by HIV-1 Vpu[J].Nature,2008,451:425-430.
[4] 尹鑫,魏萍,王晓钧.天然免疫限制因子Tetherin的抗病毒机理研究进展[J].生物化学与生物物理进展,2014,41(1):32-40.
[5] Miyagi E,Andrew A J,Kao S,etal.Vpu enhances HIV-1 virus release in the absence of Bst-2 cell surface down-modulation and intracellular depletion[J].Proc Natl Acad Sci U S A,2009,106(8):2868-2873.
[6] Nomaguchi M,Fujita M,Adachi A.Role of HIV-1 Vpu protein for virus spread and pathogenesis[J].Microbes Infect,2008,10(9):960-967.
[7] 贾彦辉,徐庆刚.宿主细胞对HIV-1复制的限制性[J].生物学杂志,2013,30(3):64-67.
[8] 庞晓静,胡斯奇,张悦,等.BST-2和Vpu相互作用抑制剂筛选模型的建立[J].病毒学报,2012,28(6):633-638.
[9] Jouvenet N,Neil S J,Zhadina M,etal.Broad-spectrum inhibition of retroviral and filoviral particle release byTe-therin[J].J Virol,2009,83(4):1837-1844.
[10] Kaletsky R L,Francica J R,Agrawal-Gamse C,etal.Tetherin-mediated restriction of filovirus budding is antagonized by the Ebola glycoprotein[J].Proc Natl Acad Sci U S A,2009,106(8):2886-2891.
[11] Sakuma T,Noda T,Urata S,etal.Inhibition of Lassa and Marburg virus production byTetherin[J].J Virol,2009,83(5):2382-235.
[12] Ishikawa J,Kaisho T,Tomizawa H,etal.Molecular cloning and chromosomal mapping of a bone marrow stromal cell surface gene,BST2,that may be involved in pre-B-cell growth[J].Genomics,1995,26(3):527-534.
[13] 王青,胡建和,徐彦召,等.H5N1禽流感病毒HA基因的重组腺病毒表达载体的构建[J].河南农业科学,2010(7):92-96.
[14] 杨怡姝,王小利,李泽琳,等.新型内在抗病毒分子Tetherin[J].病毒学报,2010,26(1):71-75.
Cloning and Sequence Analysis of SwineTetherinGene
LI Yinghui,WANG Qing,XU Yanzhao*,SUN Linxia,ZHANG Qingshuai,XU Yaru,TIAN Liu
(Department of Animal Science,Henan Institute of Science and Technology,Xinxiang 453003,China)
In order to study the function ofTetheringene,theTetheringene was detected in swine lung tissue cells which were infected with porcine reproductive and respiratory syndrome virus by the method of RT-PCR.The obtained fragment was ligated into pMD19-T vector and sequenced.The sequences of Tetherin protein was analyzed and predicted by bioinformatics.And the localization was verified in MARC-145 cells.The result showed that the full-length gene ofTetherinwas successfully cloned,which contained 534 base pairs(bp).Sequence analysis showed 41.5% identity with bovine,44.1% with sheep,42.3% with cat,43.7% with human,45.4% with chimpanzee,35.6% with owl,42.1% with macaque.Secondary structure prediction and location assay in MARC-145 cells showed that this protein was a transmembrane protein.
porcine;Tetheringene; sequence analysis
2015-07-28
2013年地方高校国家级大学生创新创业训练计划项目(201310467050)
李盈辉(1993-),男,河南商丘人,在读本科生,研究方向:分子病原学与免疫学。
*通讯作者:徐彦召(1984-),男,河南许昌人,讲师,博士,主要从事分子病原学与免疫学研究。E-mail:haoxyz@163.com
S855.3
A
1004-3268(2016)01-0131-04
