几种园林植物生理特性和土壤酶活性的研究
2016-02-06徐景文
徐景文
(郑州大学 自然资源与生态环境研究所,河南 郑州450001)
几种园林植物生理特性和土壤酶活性的研究
徐景文
(郑州大学 自然资源与生态环境研究所,河南 郑州450001)
以郑州城区道路中几种园林绿化植物为试材,研究和比较了其生理特性和土壤酶活性,为选择合适的绿化树种及合理的生态景观配置提供科学依据。结果表明:植物叶片超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、多酚氧化酶(PPO)和苯丙氨酸解氨酶(PAL)活性均表现为草本>乔木>灌木,对于SOD、POD、CAT活性,草本、灌木、乔木之间差异均达到显著水平;对于PAL、PPO活性,草本植株显著高于灌木和乔木。植物根区土壤脲酶、酸性磷酸酶、转化酶、蔗糖酶活性均表现为草本>乔木>灌木,其中土壤脲酶活性在三者之间差异显著,土壤酸性磷酸酶、转化酶、蔗糖酶活性均表现为草本和乔木显著高于灌木。几种园林植物根区土壤酶活性随着土层深度的增加呈降低趋势,表现出明显的表聚性,同一土层,总体表现为出草本>乔木>灌木,局部有所波动。
园林绿化植物; 生理特性; 土壤酶活性
土壤作为生态系统中的重要组成部分,在生态系统的物质循环和能量流动方面起着重要作用[1-3]。土壤酶主要来源于土壤微生物、植物和土壤动物,能够参与多种反应(如矿化-同化、氧化-还原等),是有机质代谢及污染物降解的驱动力和土壤质量的重要生物学指标,能够较全面地反映土壤环境质量和土壤肥力[4-6]。
园林绿化植物是城市-自然-景观复合生态系统的一部分,在减少阳光辐射、吸尘、增大空气湿度、净化空气、调节气候、改善城市生态环境等方面有着重要的作用[7-9]。近年来,有关园林植物越来越受到国内外学者的广泛关注,而人们关注的焦点也主要集中在城市生态系统园林植物种类、区系、规划和景观等方面[10-11],忽视了园林植物的生理特性及土壤酶活性在城市建设过程中发挥的重要作用。为此,以郑州市城区主要园林植物(草本、灌木、乔木)为研究对象,对其生理特性和土壤酶活性进行研究,为选择适合的绿化树种及园林生态景观植物的配置提供理论依据,以期为进一步制定并实施合理的城市绿化建设规划提供科学依据。
1 材料和方法
1.1 研究区概况
郑州市地处河南省中部偏北,112°42′~114°14′E、34°16′~34°58′N,西依嵩山,北临黄河,东南部为广阔的黄淮平原。属暖温带大陆性季风气候,四季分明,年平均气温为14.4 ℃,极端最高温度为 42.3 ℃,极端最低温度为-17.9 ℃;年降水量为652.9 mm,多集中在夏季(6—8月),占全年降水量的 52.3%。地带性森林植被是落叶阔叶林。土壤类型较多,自西向东依次分布为棕壤土、红黏土、褐土、潮褐土、潮土等,以褐土和潮土分布面积最大,分别占土壤面积的 64.4%和 30.17%。经过3 a大规模造绿工程的实施,郑州市基本形成了形式多样、物种丰富、布局合理,与自然环境协调一致的园林绿化格局。
1.2 样品采集
1.2.1 植物样品 2014年10月初,下雨后在郑州市不同街道选择几种园林植物,从植株不同方向均匀采集上、中、下足够多的成熟叶片,将叶片小心封存于锥形瓶内,带回实验室测定生理指标。采集的园林植物主要包括草本(三叶草,豆科;金鱼草,玄参科;早熟禾,禾本科;麦冬,百合科;醡浆草,醡浆草科)、灌木(小檗,小檗科;小叶黄杨,黄杨科;丁香,木犀科;榆叶梅,蔷薇科;金银木,忍冬科)和乔木(合欢,豆科;龙爪榆,榆科;银杏,银杏科;皂荚,豆科;国槐,豆科)。
1.2.2 土壤样品 在所采集植物叶片的根区,采用多点混合取样法采集0~10 cm、10~20 cm、20~30 cm土层土壤,去除根系杂物和砾石等大颗粒物质后过2 mm筛,用于测定土壤酶活性。
1.3 测定项目及方法
1.3.1 生理指标 采集一部分新鲜植物叶片,洗净后于65 ℃烘箱中烘干,粉碎后过1.5 mm筛,采用凯氏定氮法测定叶片全氮含量,钒钼黄吸光光度法测定叶片全磷含量。另一部分新鲜叶片除去叶脉研磨混合,以80%丙酮溶液为溶剂,采用分光光度法测定叶片叶绿素a、b含量;采用考马斯亮蓝G-250染色法测定叶片可溶性蛋白含量;采用蒽酮比色法测定叶片可溶性糖含量;采用茚三酮比色法测定叶片游离脯氨酸含量;采用硫代巴比妥酸法测定叶片丙二醛含量;采用NBT光化还原法测定叶片超氧化物歧化酶(SOD)活性;采用愈创木酚法测定过氧化物酶(POD)活性;采用过氧化氢分解法测定过氧化氢酶(CAT)活性;采用分光光度计法测定多酚氧化酶(PPO)活性;采用液氮分离纯化法测定苯丙氨酸解氨酶(PAL)活性[12-13]。
1.3.2 土壤酶活性 土壤蔗糖酶活性采用3,5-二硝基水杨酸比色法测定,脲酶活性采用苯酚钠比色法测定,酸性磷酸酶活性采用磷酸苯二钠法测定,转化酶活性采用分光光度法测定[14]。
1.4 数据处理
采用Excel 2010进行数据的统计和整理,采用SPSS 17.0进行方差分析,采用LSD方法进行多重比较。
2 结果与分析
2.1 几种园林植物叶片生理特性
2.1.1 防御相关酶活性 由表1可知,植物叶片SOD、POD、CAT、PAL、PPO活性均表现为草本>乔木>灌木,其中SOD、POD、CAT活性在草本、灌木、乔木之间的差异均达到显著水平,草本SOD活性分别是灌木、乔木的1.47、1.06倍,草本POD活性分别是灌木、乔木的1.29、1.19倍,草本CAT活性分别是灌木、乔木的1.42、1.26倍;PAL、PPO活性均表现为草本显著高于灌木和乔木,草本PAL活性分别是灌木、乔木的1.30、1.14倍,草本PPO活性分别是灌木、乔木的1.31、1.26倍,而灌木和乔木之间的差异不显著。综上,草本植物的防御酶活性高于乔木和灌木。

表1 几种园林植物叶片防御相关酶活性
注:同列不同小写字母表示在0.05水平差异显著。
2.1.2 非酶类生理指标 由图1可知,可溶性蛋白、可溶性糖、叶绿素a、叶绿素b含量均表现为草本>灌木>乔木,其中草本可溶性蛋白、叶绿素a、叶绿素b含量均显著高于灌木和乔木,而灌木和乔木之间差异不显著;可溶性糖含量表现为草本和灌木均显著高于乔木,但草本和灌木之间差异不显著;游离脯氨酸和丙二醛含量表现为灌木>草本>乔木,并且三者之间的差异均达到显著水平。从上述生理指标来看,总体上草本植物优于灌木和乔木。
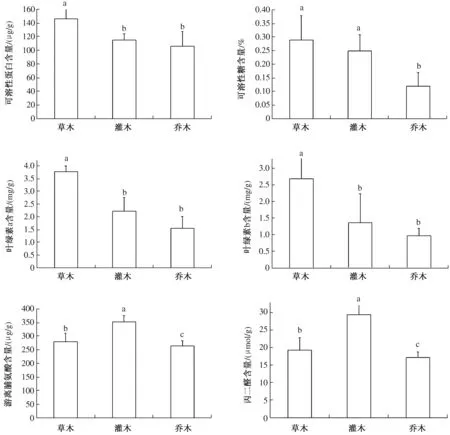
图1 几种园林植物叶片非酶类生理指标
2.2 几种园林植物根区土壤酶活性及其垂直分布
2.2.1 土壤酶活性 由图2可知,植物根区土壤脲酶、酸性磷酸酶、转化酶、蔗糖酶活性均表现为草本>乔木>灌木,草本和乔木根区土壤酸性磷酸酶、转化酶、蔗糖酶活性差异不显著,二者均显著高于灌木;草本、灌木和乔木根区土壤脲酶活性差异达到显著水平。综上,草本植物土壤酶活性高于乔木和灌木。
2.2.2 土壤酶活性的垂直分布 由图3可知,几种园林植物根区土壤脲酶、酸性磷酸酶、转化酶、蔗糖酶活性均随着土层深度的增加呈降低趋势,表现出明显的表聚性; 同一土层,总体表现为草本>乔木>灌木,局部有所波动。土壤表层以下,土壤酶活性急剧降低,与20~30 cm土层相比,草本、灌木和乔木0~10 cm土层土壤脲酶活性分别提高75.23%、256.41%和156.32%,酸性磷酸酶活性分别提高213.15%、118.24%和151.42%,转化酶活性分别提高143.52%、168.71%和213.07%,蔗糖酶活性分别提高132.56%、192.01%和236.25%。综上,几种园林植物根区土壤酶活性均表现出明显的表聚性,且草本植物土壤酶活性高于乔木和灌木。
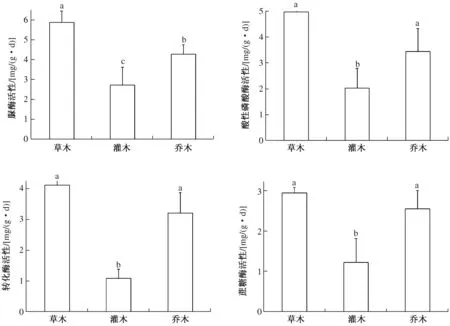
图2 几种园林植物根区土壤酶活性

图3 几种园林植物根区土壤酶活性的垂直分布
3 结论与讨论
3.1 几种园林绿化植物的生理特性
叶绿素作为植物光合作用的物质基础和光敏化剂,在光合作用过程中起着接受和转换能量的作用[15-17]。可溶性蛋白和可溶性糖中包含一些代谢的酶,其含量的多少与植株体内的代谢强度有关[18-19]。本研究结果表明,可溶性蛋白、可溶性糖、叶绿素a、叶绿素b含量均表现为草本>灌木>乔木。草本植物叶绿素a和 b含量均高于灌木和乔木,说明草本植物叶片的叶绿素合成能力高于灌木和乔木,能够更多的利用光能合成叶绿素。这可能是由于草本植物在光照不足的情况下仍能够增加对光能的利用效率,也可能与植物自身的生理生化特性和抗逆性有关[20-22]。防御相关酶SOD、POD、CAT、PPO、PAL活性的变化是园林植物对于环境胁迫所表现出来一种应激机制[16-17],本研究中具体表现为草本>乔木>灌木,一般酶活性越高,暗示该种植物抵御逆境的能力越强。
3.2 几种园林绿化植物的土壤酶活性
土壤酶活性是土壤养分循环和土壤微生物代谢活性的重要指标,通过分泌酶的方式参与土壤生态系统营养循环等,能够反映土壤养分累积、分解转化规律和土壤中各种生化过程的强度及其方向[5-6,23-24]。本研究结果表明,土壤脲酶、酸性磷酸酶、转化酶和蔗糖酶均表现为草本>乔木>灌木,说明相对于灌木和乔木,草本植物对于环境的变化表现出更高的可塑性;另一方面,灌木和乔木的生长年限过长,土壤酶活性较低,生长年限可能会抑制植物对土壤酶活性的吸收,因此乔木和灌木根区土壤酶活性较低。另外,几种园林植物土壤转化酶活性的变化幅度较大,即植物对土壤转化酶的敏感性较高。几种园林植物根区土壤脲酶、酸性磷酸酶、转化酶和蔗糖酶活性随着土层深度的增加均呈降低趋势,表现出明显的表聚性; 同一土层,总体表现为草本>乔木>灌木,局部有所波动,造成这种分布的主要原因可能是由于几种园林植物的根系释放的化学物质不一致、植物根尖细胞的敏感性和生长过程中离子积累不一致[5-6,23-24]。园林植物在代谢过程中各种酶的活性对环境的变化都很敏感,微弱的环境变化即会对根细胞中酶系的活性产生影响,因而园林植物对环境的胁迫适应性反应仍是复杂的生理生态学问题[4-6,25-26]。此外,植物根系分泌物的化感作用以及外界环境的变化也会改变土壤酶活性的变化。
[1] Paul E A.Soil microbiology,ecology and biochemistry[M].England:Academic press,2014.
[2] Lavelle P.Faunal activities and soil processes: Adaptive strategies that determine ecosystem function[J].Advances in Ecological Research,1997,27(27):93-102.
[3] Spirito F,Yahdjian L,Tognetti P M,etal.Soil ecosystem function under native and exotic plant assemblages as alternative states of successional grasslands[J].Acta Oecologica,2014,54(1):4-12.
[4] McDaniel M D,Kaye J P,Kaye M W.Increased temperature and precipitation had limited effects on soil extracellular enzyme activities in a post-harvest forest[J].Soil Biology and Biochemistry,2013,56:90-98.
[5] Paz-Ferreiro J,Fu S L,Méndez A,etal.Interactive effects of biochar and the earthworm Pontoscolex corethrurus on plant productivity and soil enzyme activities[J].Journal of Soils and Sediments,2014,14(3):483-494.
[6] Peyrot C,Wilkinson K J,Desrosiees M,etal.Effects of silver nanoparticles on soil enzyme activities with and without added organic matter[J].Environmental Toxicology and Chemistry,2014,33(1):115-125.
[7] Fajun C,Kunhao C,Yonggui X,etal.Phenological patterns of main plants in karst ecosystem in northwest Guizhou,China[J].Journal of Mountain Science,2010,28(6):695-703.
[8] Monteiro J,Ramos M,Arajo E,etal.Dynamics of medicinal plants knowledge and commerce in an urban ecosystem (Pernambuco,Northeast Brazil)[J].Environmental Monitoring and Assessment,2011,178(1/2/3/4):179-202.
[9] Marco A,Lavergne S,Dutoit T,etal.From the backyard to the backcountry: How ecological and biological traits explain the escape of garden plants into Mediterranean old fields[J].Biological Invasions,2010,12(4):761-779.
[10] Wang X F,Zhou Q X.Ecotoxicological effects of cadmium on three ornamental plants[J].Chemosphere,2005,60(1): 16-21.
[11] 魏左平.呼和浩特地区园林植物评价筛选及繁殖特性研究[D].呼和浩特: 内蒙古农业大学,2008.
[12] 台培东,郭书海,宋玉芳,等.草原地区不同生态类型的植物生理特性的比较研究[J].应用生态学报,2000,11(1): 54-57.
[13] 高俊凤.植物生理学指导[M].北京:高等教育出版社,2006.
[14] 邱莉萍,刘军,王益权,等.土壤酶活性与土壤肥力的关系研究[J].植物营养与肥料学报,2004,10(3): 277-280.
[15] 韩俊永.深圳市主要园林植物生理生态特性与生态效益研究[D].南京: 南京林业大学,2005.
[16] Baziramakenga R,Simard R R,Leroux G D.Effects of benzoic and cinnamic acids on growth,mineral composition,and chlorophyll content of soybean[J].Journal of Chemical Ecology,1994,20(11): 2821-2833.
[17] Wu C Y,Niu Z,Tang Q,etal.Estimating chlorophyll content from hyperspectral vegetation indices:Modeling and validation[J].Agricultural and Forest Meteorology,2008,148(8/9):1230-1241.
[18] Xu F,Cheng S Y,Zhu J,etal.Effects of 5-aminolevulinic acid on chlorophyll,photosynthesis,soluble sugar and flavonoids of ginkgo biloba[J].Notulae Botanicae Horti Agrobotanici Cluj-Napoca,2011,39(1): 41-47.
[19] Vu J C,Allen L H,Gesch R W.Up-regulation of photosynthesis and sucrose metabolism enzymes in young expanding leaves of sugarcane under elevated growth CO2[J].Plant Science,2006,171(1): 123-131.
[20] Gonzalez-Meler M A,Rucks J S,Aubanell G.Mechanistic insights on the responses of plant and ecosystem gas exchange to global environmental change: Lessons from Biosphere 2[J].Plant Science,2014,226(3):14-21.
[21] Steinbrecher R,Contran N,Gugerli F,etal.Inter- and intra-specific variability in isoprene production and photosynthesis of Central European oak species[J].Plant Biology(Stuttgart,Germany),2013,15(S1):148-156.
[22] Shen H,Wang S,Tang Y.Grazing alters warming effects on leaf photosynthesis and respiration inGentianastraminea,an alpine forb species[J].Journal of Plant Ecology,2013,6(5):418-427.
[23] Wang C Y,Lv Y N,Liu X Y,etal.Ecological effects of atmospheric nitrogen deposition on soil enzyme activity[J].Journal of Forestry Research,2013,24(1):109-114.
[24] Hu W,Jiao Z,Wu F,etal.Long-term effects of fertilizer on soil enzymatic activity of wheat field soil in Loess Plateau,China[J].Ecotoxicology,2014,23(10):2069-2080.
[25] Bottero M,Ferretti V,Mondini G.From the environmental debt to the environmental loan:Trends and future challenges for intergenerational discounting[J].Environment,Development & Sustainability,2013,15(6):1623-1644.
[26] Dan D W,Guo W Z,Wei Q L.Plants adapt to long-term potassium deficiency by accumulation of membrane lipids in leaves and maintenance of lipid composition in roots[J].Plant Diversity and Resources,2014,36(2):163-176.
Research on Physiology Characteristics of Some Kinds of Garden Plants and Soil Enzyme Activities
XU Jingwen
(Institute of Natural Resources and Eco-environment,Zhengzhou University,Zhengzhou 450001,China)
Taking some kinds of green plants as experimental material,the physiology characteristics and soil enzyme activities were studied to provide a scientific basis for the ecological landscape configuration and choosing suitable greening plants.The results showed that the SOD,POD,CAT,PAL and PPO activities in the leaves of different green plants showed herb>arbor>shrub,the SOD,POD,CAT activities in the leaves had no significantly difference among three kinds of green plants,the PAL,PPO activities in the leaves of herb were significantly higher than that of arbor and shrub.The urease,acid phosphatase,invertase and sucrose enzyme activities in different green plants root zone soil showed herb>arbor>shrub,acid phosphatase,invertase and sucrose enzyme activities in herb and arbor root zone soil were higher than that in shrub root zone soil,and there were no significantly difference among three kinds of green plants.The enzyme activities in different green plants root zone soil decreased with the increase of soil depth,showing obvious surface accumulation; overall,the order was herb>arbor>shrub with a local fluctuation in same soil layer.
green plants; physiology characteristics; soil enzyme activities
2015-06-27
河南省科技攻关项目(102102310395)
徐景文(1966-),男,河南嵩县人,高级工程师,硕士,主要从事植物栽培及种植设计研究。 E-mail:xujingwen66@163.com
S154.36;S688
A
1004-3268(2016)01-0065-06
