同源多倍化对拟南芥减数分裂前期Ⅰ过程的影响
2016-02-06李云玲田保明毋瑞华师恭曜
李云玲,田保明,杨 妍,毋瑞华,师恭曜,位 芳
(郑州大学 生命科学学院,河南 郑州 450001)
同源多倍化对拟南芥减数分裂前期Ⅰ过程的影响
李云玲,田保明,杨 妍,毋瑞华,师恭曜,位 芳*
(郑州大学 生命科学学院,河南 郑州 450001)
为研究同源多倍化对拟南芥减数分裂前期Ⅰ过程的影响,以哥伦比亚生态型(Columbia)二倍体拟南芥为试验材料,经0.2%秋水仙素加倍处理,利用流式细胞仪和细胞学方法鉴定倍性,获得同源多倍体拟南芥;分析同源多倍体拟南芥的形态特征,利用荧光显微观察不同倍性拟南芥的减数分裂前期Ⅰ过程,并利用荧光定量PCR技术分析与减数分裂前期Ⅰ过程相关的基因的表达变化。结果表明,与二倍体拟南芥相比,在细胞学水平上,不同倍性拟南芥的减数分裂过程基本一致;在分子水平上,多倍化对拟南芥减数分裂产生一定影响,同源重组相关基因的表达量呈现上调或下调的变化,且功能相关或有相互作用关系的基因的表达量变化趋势相似。
多倍化; 拟南芥; 减数分裂; 同源重组; 前期Ⅰ
多倍化是植物进化的一种重要推动力量。近年来,关于多倍体的研究也相继展开,但同源多倍体的研究相对滞后。同源多倍化后其中的基因组迅速扩张发生部分或全部重复,在对减数分裂中染色体行为产生影响的同时,也涉及到大范围的分子和生理调整,最终调控植物的进化。基因组加倍显著影响基因的表达[1],研究表明,多倍化后各个生物合成途径相关基因的表达都发生变化,如新陈代谢、光合作用、转录调控、细胞生长与维持、信号和衰老、抗逆性以及植物激素调控等[2-5]。
同源重组是指减数分裂中同源染色体DNA发生交换的过程,与同源染色体的联会和配对有密切联系,这些过程均由一系列基因共同调控协调完成,基因的缺失或改变都会对这些过程造成影响。在拟南芥减数分裂过程中,许多与之相关的基因在功能上都得到了证实,SPO11-1和SPO11-2相互作用,并与PRD1和PRD2形成异源复合体,共同诱发减数分裂期DNA双链断裂;MSH4参与形成修复复合体对DNA断裂缺口进行修复,为等位基因的同源重组提供了保证。RAD50和NBS1以复合物的形式作用于重组过程中DNA双链断裂修复[6-7],ZIP4[8-9]、PTD[10-11]和MLH3[12]均参与同源重组修复过程,此外,MUS81也是重组过程必需的蛋白[13-14]。同源多倍化是推动植物进化的主要动力,也是基因组加倍的重要途径,对植物生殖繁衍具有重要意义。减数分裂期同源重组是植物变异和遗传多样化的重要源泉,因此,本研究分析了多倍化对减数分裂和同源重组相关基因的影响,旨在为多倍体植物遗传资源育种提供理论依据。
1 材料和方法
1.1 材料
将哥伦比亚生态型(Columbia)二倍体拟南芥(Arabidopsisthaliana)种子点播在MS培养基中,置于(20±2)℃、16 h光照/8 h黑暗的光照培养室中萌发并生长。取生长2周左右的材料用0.2%秋水仙素暗处理茎尖3~4 h,无菌水冲洗后转移至营养土中培养。分株收种。
1.2 方法
1.2.1 同源四倍体鉴定
1.2.1.1 流式细胞仪法 取生长1个月左右的拟南芥幼龄叶片,置于250 μL的抽提缓冲液中,用刀片切碎释放细胞,加750 μL Cy-Stain荧光染色液,冰床上放置30 s至1 min,用流式细胞仪测定DNA含量,判断植物倍性。
1.2.1.2 染色体计数法 取刚刚露白的花序立即放入卡诺固定液(乙醇∶冰乙酸=3∶1)中固定3~4 h;柠檬酸缓冲液和无菌水分别清洗2~3次,37 ℃酶解(酶液成分:纤维素酶∶果胶酶=1∶1)5~6 h,将酶解后的花序转移至干净载玻片上,用解剖针捣碎释放花粉母细胞,经40 μm过滤网过滤、离心富集,制备成细胞悬液,滴片烘干后,经50 μg/mL的PI染色,进行观察。
1.2.2 同源四倍体形态观察和花粉活力鉴定 取同一时期2种倍性的拟南芥,对比观察叶片、茎杆、花器等方面的生物学特征。
于上午10:00左右取主茎上刚刚露白的花朵置于干净的培养皿中;在载玻片上滴1滴BK萌发液,用镊子拨下花瓣露出花药,在液滴上蘸粉至无明显花粉落下;把载有花粉的玻片放到铺有湿滤纸的培养皿中,盖上皿盖放入37 ℃培养箱培养3~4 h;用品红染色盖片镜检观察。统计花粉萌发率。
1.2.3 二倍体和同源四倍体拟南芥减数分裂过程观察 试验方法同1.2.1.2。
1.2.4 拟南芥减数分裂重组相关基因的荧光定量分析
1.2.4.1 同源重组相关基因和内参基因的引物设计 根据同源重组相关基因和内参基因β-actin的CDS保守序列,用Vector NTI软件设计引物,由上海生工生物工程股份有限公司合成。纯度为ULTRAPAGE级。内参基因及同源重组相关基因的qRT-PCR引物序列见表1。

表1 qRT-PCR引物序列
1.2.4.2 二倍体和同源四倍体拟南芥总RNA的提取和纯化 选取在光照培养室中生长1个月左右的健康拟南芥植株,分别摘取5~10簇二倍体和同源四倍体材料的花序。花序RNA的提取采用刘洋等[15]的方法进行。提取的总RNA用DNase Ⅰ处理排除DNA污染,并对提取的总RNA进行电泳分析。
1.2.4.3 cDNA的合成及qRT-PCR检测 反转录使用晶彩生物公司的反转录试剂盒,获得的cDNA作为qRT-PCR的反应模板。20 μL PCR反应体系:上下游引物各0.8 μL、cDNA 2.0 μL、2×SYBR qPCR Mix 10 μL,以ddH2O补足20 μL。PCR反应程序为: 94 ℃预变性2 min;94 ℃ 20 s,55~60 ℃ 20 s,72 ℃ 20 s,40个循环; 72 ℃延伸2 min。每个样品cDNA设置3个重复,用2-△△Ct法计算并统计各基因的相对表达量。
2 结果与分析
2.1 同源四倍体鉴定结果
流式细胞分析技术因其操作简单、快速和检测量大等特点,已广泛应用于植物倍性鉴定。由图1A、图1B可知,二倍体拟南芥的主峰荧光强度位于7附近,同源四倍体拟南芥的主峰荧光强度位于10附近,与二倍体主峰值近似成2倍关系,初步判断同源四倍体加倍成功。
染色体计数法是鉴定倍性较为可靠的一种方法。拟南芥基因组相对较小,二倍体拟南芥有10条染色体。由图1a、图1b可知,二倍体拟南芥中2n=10,四倍体拟南芥中2n=20,因此确定成功获得同源四倍体拟南芥。
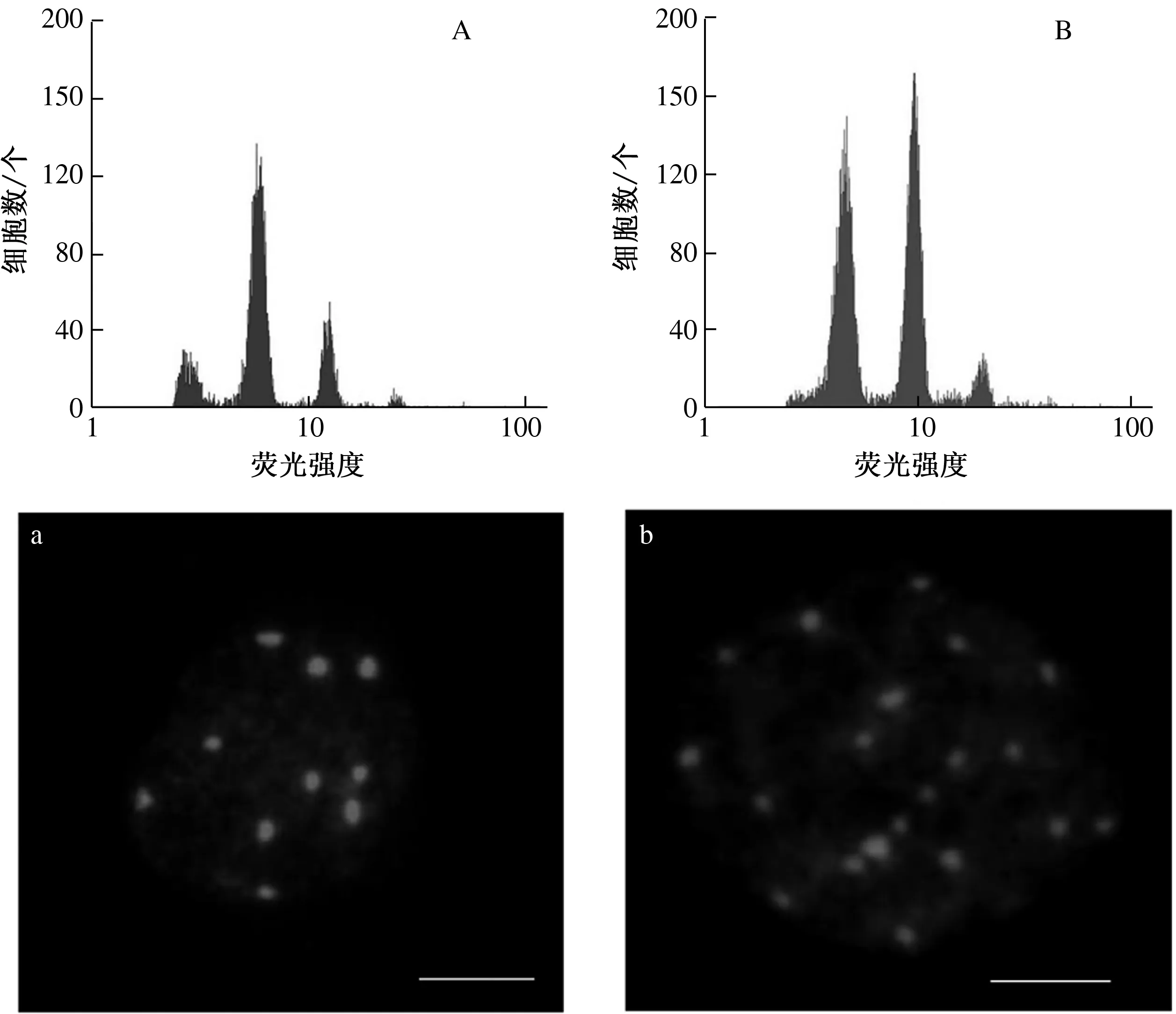
A、B分别为二倍体、同源四倍体拟南芥的流式细胞峰图;a、b分别为二倍体(2n=10)、同源四倍体(2n=20)拟南芥的染色体(bar=10 μm)
2.2 二倍体和同源四倍体拟南芥形态观察与花粉活力鉴定
多倍体植株大多在形态上与二倍体有明显差异。如图2所示,与二倍体拟南芥相比较,同源四倍体拟南芥花器较大,叶片肥厚,同源四倍体的叶片宽度增大,长度变小,叶形指数(长度与宽度之比)变小且叶片普遍有卷曲现象,植株整体变高变壮。

a叶片形态; b、c分别为四倍体、二倍体拟南芥的花器
由图3可知,二倍体拟南芥的花粉活力为81.27%,同源四倍体拟南芥的花粉活力为76.55%,同源四倍体的花粉活力略低于二倍体。花粉由减数分裂形成,因此可知,同源四倍体的减数分裂过程无明显异常,可产生正常配子。
2.3 二倍体和同源四倍体拟南芥细胞学对比分析
同源重组发生在减数分裂前期,与减数分裂染色体联会配对有密切关系。二倍体和同源四倍体拟南芥减数分裂过程大体一致。由图4可见,同源四倍体拟南芥因染色体数目加倍,减数分裂前期簇拥在一起的染色体较多;从同源四倍体减数分裂前期的观察可知,染色体间的着丝粒较多,即联会配对活动频繁。

a、b为二倍体减数分裂前期Ⅰ;c、d为同源四倍体减数分裂前期Ⅰ;*为核仁组织区; 箭头代表配对的着丝粒
2.4 拟南芥减数分裂重组相关基因的表达分析结果
2.4.1 拟南芥总RNA的提取质量鉴定 RNA的提取结果见图5,提取的总RNA条带清晰,其中的28S rRNA和18S rRNA条带轮廓清晰且亮度较高,5S rRNA条带较暗基本不可见,条带均无明显拖尾现象。由此可知,提取的RNA质量良好,可用于后续试验。

图5 不同倍性拟南芥总RNA的电泳结果
2.4.2 减数分裂重组相关基因的表达情况 图6所示,与二倍体相比,NBS1表达量极显著上调,PRD2、RAD50表达量显著上调,PRD1表达量上调(P>0.05),MSH4表达量显著下调。PRD1和PRD2为同源基因,且有部分功能重叠,因此有相近的变化趋势;RAD50和NBS1同为MRN复合物的组成部分,部分次要功能相同但主要功能不同,所以二者表达量的变化趋势不同,主要功能性强且参与多项重组相关功能的基因表达量变化明显,功能性相对单一的表达量变化则不明显。

图6 不同倍性拟南芥减数分裂重组相关基因的表达分析
3 结论与讨论
细胞学观察结果表明,加倍后的同源四倍体拟南芥减数分裂过程与二倍体基本一致,能产生正常配子,这与花粉活力鉴定结果一致。但其中染色体的各种联会配对活动更加频繁,染色体行为发生变化会导致联会配对重组相关基因的表达量也发生变化。
拟南芥中目前已发现的与双链缺口形成有关的基因有5个,除了SPO11-1和SPO11-2基因还有PRD1、PRD2和PRD3,它们通过形成某种复合物来调控双链缺口的形成[16-17]。PRD1基因在双链缺口形成中的功能是其主要功能;PRD1还与DMC1有一定的相互作用关系,并最终影响重组的发生;而且,在酵母双杂交系统中Atprd1 和Atspo11-1能相互作用,说明PRD1与SPO11-1也相互作用[18]。PRD2主要编码卷曲螺旋蛋白MPS1,与减数分裂的纺锤体组装有关,且参与某种调控双链缺口形成的复合物的形成。四倍体拟南芥中二者相对表达量提高,说明加倍后双链断裂过程发生频繁,且染色体相关的活动比纺锤体的活动量大,是减数分裂过程中的主要活动。
RAD50主要通过形成MRN复合物对双链缺口作出反应并进行修复[19]。研究表明,RAD50的结构当中有一个DNA接口,当它与DNA结合时,其功能作用点就发生改变,对于DNA双链缺口修复就不重要了,转而对端粒的维护有着重要作用[20-21]。同源四倍体的DNA含量加倍,RAD50与之结合参与端粒的维护,因此其含量增加,不与DNA直接结合的部分参与双链缺口修复。NBS1在激活ATM和ATR方面发挥着唯一且重要的作用,ATM和ATR是对DNA双链断裂作出回应的2种蛋白[22-23]。RAD50参与形成MRN复合物,在DNA双链断裂修复中发挥作用;另外RAD50还具有协同端粒酶维护端粒的作用。NBS1相对表达量变化趋势明显于RAD50,是因为其功能性强且加倍后减数分裂前期双链断裂的活动更频繁。
MSH4是减数分裂特异基因,通常在减数分裂前期Ⅰ表达,与同源重组的起始过程以及同源染色体交叉形成有关[24]。一般情况下,MSH4通过与其他几个基因组装形成ZMM蛋白复合体行使各种功能。在Shodhan等[24]的研究中发现,若敲除MSH4或MSH5基因,减数分裂过程中同源染色体形成二价体的数量显著减少。本研究中同源四倍体拟南芥该基因的表达量减少,说明减数分裂过程中二价体减少,即会有新的染色体构型出现。对同源四倍体白菜的减数分裂过程研究发现,除了有终变期染色体构型多样的现象外,其减数分裂过程及各时期的染色体行为与二倍体基本一致,减数分裂完成,生成的四分体结构正常,没有出现三分体或微核的现象[25],本试验结果与之相符。
此外,相关研究表明,与二倍体拟南芥相比,同源四倍体和异源四倍体减数分裂过程中同源重组频率显著提高[26],这一研究结果与本研究结果基本一致。因此推测,多倍化能诱导减数分裂染色体行为异常及基因表达量的改变,从而影响多倍体植物相关生物学性状的改变。
[1] 李朋波,李召虎,华金平.植物多倍化对基因组的冲击及对植物的影响[G]//中国棉花学会2006年年会暨第七次代表大会论文汇编.保定:中国棉花学会,2006:91-94.
[2] Comai L.The advantages and disadvantages of being polyploid[J].Nature Reviews Genetics,2005,6(11):836-846.
[3] Chen Z J,Ni Z.Mechanisms of genomic rearrangements and gene expression changes in plant polyploids[J].Bioessays,2006,28(3):240-252.
[4] Adams K L,Wendel J F.Polyploidy and genome evolution in plants[J].Current Opinion in Plant Biology,2005,8(2):135-141.
[5] Shaked H,Kashkush K,Ozkan H,etal.Sequence elimination and cytosine methylation are rapid and reproducible responses of the genome to wide hybridization and altopolyploidy in wheat[J].The Plant Cell,2001,13(8):1749-1759.
[6] 谢文军,史典义,蔡泽熙,等.联会复合体的组成、功能及遗传控制[J].遗传,2012,34(2):167-176.
[7] 刘晓林,于佳,范云六,等.拟南芥减数分裂重组发生的遗传学研究[J].中国农业科技导报,2008,10(2):22-28.
[8] Shen Y,Tang D,Wang K,etal.ZIP4 in homologous chromosome synapsis and crossover formation in rice meiosis[J].Journal of Cell Science,2012,125(11):2581-2591.
[9] Yelina N E,Ziolkowski P A,Miller N,etal.High-throughput analysis of meiotic crossover frequency and interference via flow cytometry of fluorescent pollen inArabidopsisthaliana[J].Nature Protocols,2013,8(11):2119-2134.
[10] Lu P,Wijeratne A J,Wang Z,etal.ArabidopsisPTD is required for typeⅠcrossover formation and affects recombination frequency in two different chromosomal regions[J].Journal of Genetics and Genomics,2014,41(3):165-175.
[11] Macaisne N,Vignard J,Mercier R.SHOC1 and PTD form an XPF-ERCC1-like complex that is required for formation of classⅠcrossovers[J].Journal of Cell Science,2011,124(16):2687-2691.
[12] Sonntag Brown M,Lim E,Chen C,etal.Genetic analysis ofmlh3 mutations reveals interactions between crossover promoting factors during meiosis in baker's yeast[J].G3(Bethesda),2013,3(1):9-22.
[13] Schwartz E K,Wright W D,Ehmsen K T,etal.Mus81-Mms4 functions as a single heterodimer to cleave nicked intermediates in recombinational DNA repair[J].Molecular and Cellular Biology,2012,32(15):3065-3080.
[14] Lukaszewicz A,Howard-Till R A,Loidl J.Mus81 nuclease and Sgs1 helicase are essential for meiotic recombination in a protist lacking a synaptonemal complex[J].Nucleic Acids Research,2013,41(20):9296-9309.
[15] 刘洋,何心尧,马红波,等.用CTAB-PVP法提取棉花各组织总RNA的研究[J].中国农业大学学报,2006,11(1):53-56.
[16] Grelon M,Vezon D,Gendrot G,etal.AtSPO11-1 is necessary for efficient meiotic recombination in plants[J].The EMBO Journal,2001,20(3):589-600 .
[17] 张丞.调节拟南芥染色体同源重组起始过程中双链缺口形成的新基因——AtDFO[D].上海:华东师范大学,2012.
[18] De Muyt A,Vezon D,Gendrot G,etal.AtPRD1 is required for meiotic double strand break formation inArabidopsisthaliana[J].The EMBO Journal,2007,26(18):4126-4137.
[19] Williams R S,Williams J S,Tainer J A.Mre11-Rad50-Nbs1 is a keystone complex connecting DNA repair machinery,double-strand break signaling,and the chromatin template[J].Biochemistry and Cell Biology,2007,85(4):509-520.
[20] Rojowska A,Lammens K,Seifert F U,etal.Structure of the rad50 DNA double-strand break repair protein in complex with DNA[J].The EMBO Journal,2014,33(23):2847-2859.
[21] Bleuyard J Y,Gallego M E,White C I.Meiotic defects in theArabidopsisrad50 mutant point to conservation of the MRX complex function in early stages of meiotic recombination[J].Chromosoma,2004,113(4):197-203.
[22] Kobayashi M,Hayashi N,Takata M,etal.NBS1 directly activates ATR independently of MRE11 and TOPBP1[J].Genes to Cells,2013,18(3):238-246.
[23] Hopfner K P.ATP puts the brake on DNA double-strand break repair:A new study shows that ATP switches the Mre11-Rad50-Nbs1 repair factor between signaling and processing of DNA ends[J].Bioessays,2014,36(12):1170-1178.
[24] Shodhan A,Lukaszewicz A,Novatchkova M,etal.Msh4 and Msh5 function in SC-independent chiasma formation during the streamlined meiosis ofTetrahymena[J].Genetics,2014,198(3):983-993.
[25] 崔群香,王倩,唐红艳,等.普通白菜同源四倍体花粉母细胞减数分裂及其雄配子体发育研究[J].扬州大学学报(农业与生命科学版),2012,33(4):56-60.
[26] Pecinka A,Fang W,Rehmsmeier M,etal.Polyploidization increases meiotic recombination frequency inArabidopsis[J].BMC Biol,2011,9:24.
Effects of Autopolyploidy on Meiotic ProphaseⅠinArabidopsisthaliana
LI Yunling,TIAN Baoming,YANG Yan,WU Ruihua,SHI Gongyao,WEI Fang*
(School of Life Sciences,Zhengzhou University,Zhengzhou 450001,China)
In the present study,the effects of autopolyploidy on meiotic prophaseⅠwas analyzed inArabidopsisthaliana(Columbia eco-type).A.thalianadiploids were treated with 0.2% colchicine,and then the flow cytometry and cytology were used to identify the autopolyploid progeny.The morphological characteristics of autopolyploidA.thalianawas analyzed,and meiotic prophaseⅠwas observed under fluorescent microscope.Meanwhile,the quantitative real-time PCR was applied to analyze the expression of several meiotic recombination related genes in diploid and autotetraploidArabidopsis.The results showed that,in comparison with diploids,cytologically the similar meiosis progress was observed in autopolyploidArabidopsis,and the gene expression was either up-regulated or down-regulated at the molecular level,and the changes of gene expression were mostly correlated with their specific functional roles during meiosis.
autopolyploidy;Arabidopsisthaliana; meiosis; homologous recombination; meiotic prophase Ⅰ
2015-07-28
国家自然科学基金项目(U1204308)
李云玲(1989-),女,河南鹤壁人,硕士,主要从事植物分子细胞遗传学研究。
*通讯作者:位 芳(1981-),男,河南项城人,副教授,博士,主要从事植物遗传学方面的教学与研究工作。 E-mail:fangwei@zzu.edu.cn
Q943
A
1004-3268(2016)01-0036-06
